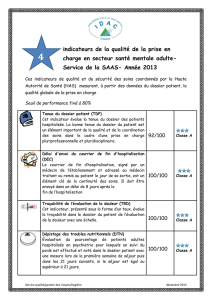
fiche d`observation - Mectizan Donation Program

Annexe VI-D Mai08
1
FORMULAIRE DE DECLARATION
D’EFFETS INDESIRABLES GRAVES
Programme de Traitement de l’Onchocercose
REMPLIR CE FORMULAIRE UNIQUEMENT
POUR LES CAS REPONDANT AUX CRITERES CI-DESSUS
et
le renvoyer dans les plus brefs délais à :
Mectizan Donation Program
325 Swanton Way
Decatur, GA 30030
USA
TEL: +1-404-371-1460
FAX: +1-404-371-1138
Un cas d’effet indésirable grave se définit comme étant une réaction qui survient à la suite d’une prise
de médicament et qui a entrainé chez le patient:
un décès
la mise en jeu du pronostic vital
une hospitalisation ou prolongation d’une hospitalisation
une incapacité ou une invalidité permanente
une anomalie congénitale ou un trouble à la naissance
un cancer
un surdosage (accidentel ou intentionnel)
Tout évènement médical important n’entraînant pas la mort, ne mettant pas en danger la vie
du patient, ou ne nécessitant pas son hospitalisation, peut néanmoins être considéré comme
un cas d’effets indésirables graves, si, après avis médical, on considère que la vie du patient
ou du sujet est menacée ou qu’une intervention médicale ou chirurgicale s’avère nécessaire
pour éviter l’une des conséquences précitées: il est impératif de signaler de telles réactions.

Annexe VI-D Mai08
2
Formulaire de Déclaration d’Effets Indésirables Graves
Programme de Traitement de l’Onchocercose
Pays :
Date du Rapport : / /
(Jour/Mois/Année)
1. Informations sur le Patient
Nom et Prénoms
Age (ans)
Sexe (M/F)
Village
District
Province/Région
2. Etat Clinique Initial
Etat général du patient avant le traitement par Mectizan® (y compris les troubles du système
nerveux central) :
Infections Parasitaires
1. Onchocercose
2. Loase
Confirmée
Suspectée
Sans réponse
Négative
Détails
Si la loase est confirmée
mf/ml (sang):
mf/ml (LCR):
Autres infections parasitaires, connues ou suspectées
(ex: malaria)
Autres médications en cours (actuellement ou récemment)
La patiente est-elle enceinte ? Oui Non Sans réponse
Alcool :
a) Consommation d’alcool dans les 24 h suivant ou précédant la
prise de Mectizan
b) Alcoolisme chronique
3. Informations sur le dernier traitement par Mectizan®
Date du traitement (Jour/Mois/Année): / /
Origine du traitement :
Programme communautaire
dans une formation sanitaire
Autres
Dose de Mectizan
(nbre de comprimés)
Taille du patient
(cm)
Poids du patient
(kg)
Etait-ce un premier traitement par Mectizan
? Oui Non Sans
réponse
Si la réponse est “Non”, veuillez expliquer quand et dans quelles conditions les traitements précédents
ont été administrés ?

Annexe VI-D Mai08
3
4. Description des Effets Indésirables Graves*
/ /
Date des premiers signes (Jour/Mois/Année)
heures OU jours
Combien de temps après la prise de Mectizan ?
Signes Cliniques et Symptômes
A-t-on observé une intoxication aigüe à l’alcool lors du premier examen ?
Oui Non Sans réponse
Résultats de laboratoire
Dates des tests
(Jour/Mois/Année)
/ /
/ /
/ /
Prise en charge, chronologie, thérapie (ex: hospitalisation – date d’admission et raisons d’admission) :
a) Hospitalisation : Oui Non
Si “Oui”, indiquez : Date d’admission (Jour/Mois/Année) / /
Date de sortie (Jour/Mois/Année) / /
(Joindre tout document jugé utile)
b) Traitements administrés :
*Un cas d’effets indésirables graves se définit comme une réaction sévère à la suite d’un traitement médicamenteux et se
caractérise par l’un des symptômes suivants: décès, réaction grave au produit mettant en danger la vie du patient,
hospitalisation du patient ou prolongation d’une hospitalisation déjà en cours, handicap/invalidité patente ou persistante,
anomalie congénitale ou troubles à la naissance, cancer, surdosage (accidentel ou intentionnel).
Tout évènement médical important n’entraînant pas la mort, ne mettant pas en danger la vie du patient, ou ne nécessitant pas
l’hospitalisation, peut être considéré comme un cas d’effets indésirables graves, si, après avis médical, on considère que la vie du
patient ou du sujet est menacée ou qu’une intervention médicale ou chirurgicale s’avère nécessaire pour éviter l’une des
conséquences précitées: il est impératif de signaler de telles réactions.

Annexe VI-D Mai08
4
5. Etat du Patient lors du dernier examen
Guérison totale : Oui Non Sans réponse
Persistance des troubles : Oui Non Sans réponse
Incapacité/Invalidité patente/persistante : Oui Non Sans réponse
Si “Oui”, veuillez décrire le handicap :
Décès : Oui Non
Si “Oui”, indiquez
Date du décès
(Jour/Mois/Année)
Cause du décès
/ /
En cas de décès, veuillez indiquer ci-dessous et de façon détaillée les circonstances entourant ce décès.
Veuillez produire le rapport d’éventuelle autopsie y compris le rapport histopathologique de tout
prélèvement effectué et toute autre analyse biologique faite (utilisez des pages supplémentaires si
nécessaire pour compléter le rapport :
Diagnostic présumé :
6. Conclusions
Pensez-vous que le traitement par Mectizan® a été la possible cause de l’effet indésirable grave?
Oui Non On ne peut l’assurer
Si “Oui”, veuillez expliquer :
Si “Non”, ou si “On ne peut l’assurer”, quel est à votre avis la cause de cette réaction ?

Annexe VI-D Mai08
5
7. Identité de la Personne ayant établi ce rapport
Nom de la Personne qui a établi ce rapport
Fonction
Organisation
Adresse
Numéro de Téléphone
Numéro de Fax
Veuillez envoyer ce rapport à :
Mectizan Donation Program
325 Swanton Way
Decatur, GA 30030
USA
TEL: +1-404-371-1460
FAX: +1-404-371-1138
1
/
5
100%