UE9-JJH-Réaction d`hypersensibilité (word)

1
UE 9 - Immunopathologie et Immunointervention
JJ. Hoarau
Date : 19/04/16 Plage horaire : 14h-16h
Promo : P2 2015-2016 Enseignant : JJ Hoarau
Ronéistes : Pawak
Anne Robert
L’hypersensibilité de type 1 : L’allergie
I. Définitions et introduction aux réactions d’hypersensibilité
1. Définitions
2. Les différents types de réaction d’hypersensibilité
II. Réactions de type I
Hypersensibilité induite par l’IgE (type I)
Les allergènes
A. Les IgE
B. Les mastocytes
C. La dégranulation
D. Les médiateurs des réactions de Type 1
Conséquences des réactions de type I
Anaphylaxie localisée (atopie)
Anaphylaxie systémique (choc anaphylactique)
III. Les causes des phénomènes d'hypersensibilité immédiate
1. Lymphocytes TH1 et TH2
2. Régulation
3. Amplification par IL-4
4. Différenciation TH1 / TH2 dans le poumon
IV. Rôle des facteurs de l'environnement
V. Diagnostic
Tests cutanés
RIST (RadioImmunoSorbent Test)
RAST (RadtioAllergoSorbent Test)
VI. Traitement
1. Traitements classiques
2. Immunothérapie

2
I. Définitions et introduction aux réactions d’hypersensibilité
1. Définitions
L’hypersensibilité : Mode de réponse de l’immunité adaptative face à un antigène (du soi ou du non soi) et
qui se manifeste par des effets néfastes pour l’hôte. Souvent dans les dysfonctionnements du système
immunitaire, quand c'est l'immunité innée qui est mise en cause, c'est souvent lié à des pathologies d'origine
génétique. Dans la plupart des maladies, type hypersensibilité, maladie auto-immune… ce sont les cellules
de l'immunité adaptative qui sont mises en cause.
Les premières tentatives de mise en évidence de l’hypersensibilité proviennent de travaux menés par Portier
et Richet en 1913 à Monaco. Ils ont essayé de comprendre la cause des chocs anaphylactiques suite à des
piqûres de méduse. Ils ont donc essayé de « vacciner » les chiens en leur injectant des toxines de méduse. Ils
se sont rendu compte que lors de la 2ème injection, les gens faisaient des chocs anaphylactiques et cela
entrainait la mort.
L’allergie : Capacité pour un organisme pré-sensibilisé à une substance exogène (= allergène) de réagir
spécifiquement et ce d’une façon « altérée » lors de la réintroduction de cette substance.
Au sens large, l’allergie désigne le développement d’un phénomène d’hypersensibilité face à un antigène de
l’environnement.
Il est important de noter que les sujets ne font des allergies que lorsqu’ils ont été pré-sensibilisés, ce qui
implique que nous ne pouvons pas faire d’allergie la première fois que l’on rencontre un antigène.
Lorsque l’on parle de réaction d’hypersensibilité, il ne faut pas comprendre que le sujet « sur-répond ». Il
s’agit plutôt d’une réponse inadaptée du système immunitaire. L’hypersensibilité est donc une réponse
anormale à un antigène.
2. Les différents types de réaction d’hypersensibilité
La classification sépare les différents types d’hypersensibilité en fonction de la nature de l'antigène et des
molécules effectrices impliquées lors de la réaction.
Classification de Gell et Coombs
- Type I : réactions anaphylactiques et atopiques
Hypersensibilité immédiate à IgE (classiquement utilisée dans la lutte contre les parasites). L'organisme va
produire des IgE alors qu'il ne devrait pas le faire.
- Type II : réactions de toxicité et de neutralisation, IgG, complément ou ADCC
- Type III : réactions secondaires aux effets des complexes immuns, IgG, IgM, complément
- Type IV : réactions à médiation cellulaire, Hypersensibilité retardée, lymphocytes T
On a ainsi 4 types d’hypersensibilité :
Les réactions allergiques appartenant pour la plupart au type I. Ce sont des réactions anaphylactiques et
atopiques (= se produisant sur un terrain génétique particulier) liées à une hypersensibilité immédiate
induite par les IgE. On parle d’hypersensibilité immédiate car les individus sensibilisés auront une réponse
très rapide face à l’allergène commun de l’environnement.
La réaction d’hypersensibilité de type II fait intervenir des réactions de toxicité/neutralisation qui se

3
forment quand on a des complexes immuns. Elle aura pour médiateurs des anticorps de type IgG, IgM, qui
vont se fixer sur les surfaces membranaires et entrainer la destruction de ces tissus. Dans le cas des IgG,
cette réaction est liée aux auto-anticorps (maladie auto-immune), qui vont activer les mécanismes du
complément, de la cytotoxicité et qui vont faire qu'on aura des atteintes de nos tissus.
L’hypersensibilité de type III est proche de la réaction de type II et elle est basée, elle aussi, sur le rôle des
anticorps, plus précisément au fait que des complexes immuns peuvent se déposer au niveau des tissus ou
circuler dans le sang, codant leur attaque par les phagocytes et entrainant leur destruction. D’autres
maladies auto-immunes peuvent alors être retrouvées comme le lupus érythémateux disséminé.
Le dernier type d’hypersensibilité, le type IV, est dit retardé car sa mise en place va prendre plusieurs jours
(3 à 4 jours environ), avec l’intervention des lymphocytes T (via des cytokines qui vont activer des
macrophages qui vont attaquer les tissus). La réaction va apparaître à distance de l'élément qui déclenchera
la réaction. On retrouve ici encore d’autres types de maladies auto-immunes associées à cette
hypersensibilité, telle que la sclérose en plaques.
Il faut remarquer que beaucoup des maladies auto-immunes sont liées aux réactions d’hypersensibilité.
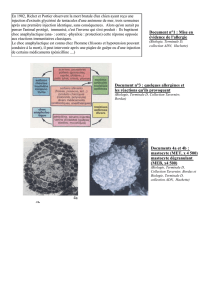
Tableau qui résume les différentes réactions d'hypersensibilité.
Question/Réponse 2015 : Au niveau de la réaction d'hypersensibilité de type I, il y a quand même des
cellules de l'immunité innée qui interviennent, avec les mastocytes par exemple ?
Effectivement dans l'hypersensibilité de type I, on va voir que la composante principale c'est la production
par les plasmocytes d'IgE et ces IgE vont pouvoir être captés par les cellules de l'immunité innée,
notamment les mastocytes. Donc il y a bien la composante immunité adaptative qui entre en jeu mais
l'apparition des symptômes est due aux cellules de l'immunité innée. Les cellules de l'immunité innée ne sont
donc pas à l'origine de la maladie mais vont y participer.

4
II. Réactions de type I
C’est une réaction qui suit immédiatement l’exposition à un antigène de l’environnement (allergène).
Il faut faire attention au terme « immédiat ». En effet, la réaction allergique ne peut apparaitre que sur un
sujet pré-sensibilisé. La réaction ne se fera que lors du 2eme contact avec l’allergène. Il faut donc
comprendre ici : « immédiatement après la réexposition de l’allergène ».
Notion de sensibilité anormale à un antigène banal.
Lorsque l’on se demande pourquoi certaines personnes sont plus sensibles aux allergies, on peut dire qu’il y
a un certain terrain génétique. C’est l’atopie :
Atopie : prédisposition héréditaire au développement de réactions d’hypersensibilité immédiate contre les
antigènes banaux de l’environnement. On a d'autant plus de chance de développer une allergie lorsque nos
deux parents sont allergiques.
Ainsi lorsque la réaction allergique est liée au terrain génétique de l’individu on parle de réaction
atopique. Mais ça a été mis en évidence que dans un cas sur deux, même si on suspecte que ça doit être le
cas général.
Néanmoins les prédispositions génétiques et héréditaires ne sont qu’un des facteurs d’allergie, car
l’environnement joue un rôle très important dans ces phénomènes.
Le terme d’allergie est souvent utilisé comme synonyme de réaction d’hypersensibilité immédiate, même si
certains types d'hypersensibilité immédiate peuvent être classés différemment de l'allergie.
1. Hypersensibilité induite par l’IgE (type I)
Cette réaction se décompose en 2 étapes.
- La première étape se caractérise par le premier contact avec l’allergène (= présensibilisation) ; à ce
moment, l’individu ne va pas répondre immédiatement. Effectivement, lorsqu’un individu entre en contact
avec cet allergène, il y aura production immunoglobulines par les plasmocytes, plus précisément d’IgE. Ces
plasmocytes se trouvent dans les épithéliums et ont la particularité de ne pas présenter d’Ig à leur surface.
L'organisme va donc traiter ces antigènes comme s'ils étaient parasitaires. Ainsi tous les Ig produites seront
sécrétées. De plus, les plasmocytes n’ont pas la capacité d’expansion clonale. De ce fait, lorsqu’ils seront
activés, ces derniers ne feront que produire des Ig.
Les IgE produites vont venir se fixer à la surface des mastocytes et des basophiles via les récepteurs Fcε et
les sensibiliser. Ces deux types cellulaires vont jouer un rôle central. Cette première étape n’est donc pas
symptomatique.

5
- La réaction allergique apparait lors du deuxième contact (ré-introduction de l'allergène). Le cross-
linking des allergènes, via les IgE qui se sont fixées aux récepteurs Fc des mastocytes, entraîne une
dégranulation (histamine, sérotonine) de ces derniers de façon relativement importante. La réaction
allergique est ainsi mise en place, elle aura différentes manifestations : le rhume des foins, l’asthme, la
conjonctivite, etc ; et correspondra à des phénomènes inflammatoires, de contraction des muscles lisses
(broncho-constriction), augmentation de la perméabilité vasculaire accrue et de vasodilation, responsables
des symptômes observés.
Cela impose qu'entre le premier et le second contact, le temps de contact soit limité. Généralement, on
estime que les IgE ont une capacité à persister à la surface des mastocytes et des basophiles durant une
20aine de jours. Si on dépasse cette période, il faut resensibiliser une nouvelle fois.
Tout démarre par une présentation antigénique. Les lymphocytes B (qui ont une certaine affinité pour
l’allergène) vont entrer en interaction avec des lymphocytes T helper via la sécrétion d’interleukine 4. Les
lymphocytes B vont alors se différencier en plasmocytes (qui sont des cellules résidentes des épithéliums et
qui sont en phase terminale de différentiation) et en LB mémoires. Les plasmocytes vont alors produire : des
IgM et des IgG, des IgA et des IgE (en moindre quantité).
Les IgE vont alors se fixer sur les FcϵR et entrainer la dégranulation des mastocytes. Elles vont agir sur les
muscles lisses, sur les vaisseaux sanguins, entrainer la production de mucus, et agir sur les plaquettes.
La synthèse d’IgE est généralement restreinte à la réponse antiparasitaire indépendamment de l’origine de
l’antigène. Ainsi certains extraits protéiques issus de parasites tels que le nématode peuvent entrainer la
production d’IgG ou d’IgE :
- soit en stimulant directement les lymphocytes B (pour produire les immunoglobulines G1 et E)
- soit via des Lymphocytes T CD4 qui vont favoriser la réponse Th2 et stimuler la production de cytokines
qui vont stimuler la réponse humorale. Cependant, certains individus produisent des IgE contre des
antigènes banals, non parasitaires. Ces individus sont dits atopiques avec un terrain génétique particulier et
les antigènes vis-à-vis desquels leur système immunitaire réagit sont dits allergènes.
Un allergène peut donc être défini comme un antigène de l’environnement non parasitaire capable de
stimuler spécifiquement le système immunitaire des individus allergiques. A noter que chez les
personnes atteintes d’atopie, tous les antigènes ne sont pas des allergènes.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%