La chimie au lycée concepts introduits en classe de terminale

D – Comment le chimiste contrôle-t-il les transformations de la
matière ?
▀ Les exemples d’activités pour la partie D du programme proposés par ce document et son cédérom
d’accompagnement sont issus des sciences de l’ingénieur et des sciences de la vie.
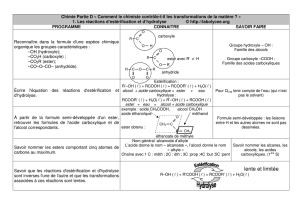
Comment le chimiste peut-il contrôler l’évolution des systèmes ?
En cinétique, des modes de contrôle ont été rencontrés : par exemple chauffer pour accélérer une
transformation ou au contraire refroidir et diluer pour la stopper dans le but d’un titrage. Lors de l’étude
de cette partie en classe, il a été montré qu’un apport d’énergie a permis de forcer l’évolution du
système, par exemple lors de la charge d’un accumulateur, ce qui constitue une forme de contrôle.
Il est proposé dans cette dernière partie de montrer que l’on peut optimiser des synthèses industrielles
en utilisant les connaissances précédemment acquises. Comme support de cette étude, nous avons
choisi l’estérification et l’hydrolyse de l’ester, pour plusieurs raisons : historiquement, ces réactions ont
tenu une grande place dans le progrès des connaissances sur les équilibres chimiques et les vitesses
de réaction ; d’autre part, si l’on veut montrer l’effet d’un catalyseur, il faut que la transformation soit
lente dans des conditions usuelles ; si l’on veut en augmenter le rendement, il faut que le taux
d’avancement ait une valeur ni trop grande ni trop petite pour pouvoir mesurer un changement avec
les moyens dont on dispose ; en outre, ces transformations impliquant un acide, le suivi temporel et la
mesure de l’avancement final peuvent se faire par titrage en présence d’un indicateur coloré mettant
en jeu une réaction acido-basique ; enfin, ces espèces ont une faible toxicité.
S’agit-il de procéder à nouveau à une étude cinétique des transformations ?
Il s’agit de montrer qu’un catalyseur a un effet sur la vitesse de réaction mais pas sur l’état d’équilibre
du système, et de percevoir que le taux d’avancement final peut être accru par élimination d’un produit
formé (l’eau ou l’ester) ou par ajout d’un excès d’un réactif (alcool ou acide).
L’état d’équilibre d’un système étant atteint, l’ajout d’un réactif crée une perturbation instantanée du
système qui diminue momentanément le quotient de réaction. Le système réagit en consommant les
réactifs pour amener la valeur du quotient de réaction à la valeur de K . Le même raisonnement vaut
si l’on élimine un produit (par distillation).
Est-il possible de contrôler la synthèse de l’aspirine et dans celle d’un savon?
La synthèse d’un ester est lente et la transformation n’est pas totale. Même si l’on utilise un catalyseur
et un excès d’un réactif, il faut ensuite séparer le produit formé du mélange réactionnel, ce qui n’est
pas toujours aisé. L’optimisation de la synthèse d’un ester peut aussi s’envisager en remplaçant
l’acide carboxylique par une espèce plus réactive : l’anhydride d’acide. Dans ces conditions, la
formation de l’ester ne s’accompagnant pas de la formation d’eau, la réaction inverse d’hydrolyse est
empêchée.
La synthèse de l’aspirine est un exemple de synthèse optimisée d’un ester. C’est ainsi qu’elle est
réalisée industriellement ; il est facile de comprendre en effet, qu’une transformation lente et non
totale est préjudiciable aux aspects économiques d’une synthèse. L’hydrolyse d’un ester est, elle
aussi, une transformation lente et non totale. L’ion hydroxyde est plus réactif que la molécule d’eau ;
pratiquée en milieu basique concentré et à chaud, l’hydrolyse est plus rapide et quasi totale, sans
possibilité de retour vers l’ester.
La synthèse d’un savon utilise l’hydrolyse basique, appelée aussi saponification.
Ces deux exemples de synthèses organiques, pris dans l’industrie des médicaments et des produits
cosmétiques, montrent bien les diverses stratégies mises en œuvre par le chimiste pour contrôler les
transformations de la matière, les aspects cinétiques étant améliorés par le chauffage et la catalyse,

les rendements thermodynamiques étant accrus par utilisation d’un excès de réactif ou élimination
d’un produit, ou mieux en utilisant une espèce très réactive.
Qu’en est-il des réactions compétitives ?
Le titrage direct de l’aspirine permet de réinvestir les connaissances acquises depuis la classe de
seconde pour élaborer un protocole simple de titrage d’une espèce comportant plusieurs groupes
caractéristiques, par exemple la molécule d’acide acétylsalicylique (acide carboxylique et ester). Les
deux peuvent réagir avec la solution de soude ; les deux réactions sont donc compétitives. Pour
réaliser un titrage simple, il faut en quelque sorte interdire la réaction de saponification ; en opérant à
froid, avec une solution d’hydroxyde de sodium diluée et en réalisant rapidement un titrage, seule la
réaction acido-basique a lieu.
Un deuxième niveau de réactions compétitives concerne l’indicateur coloré qui ne doit réagir que
lorsque la réaction de l’aspirine avec la soude est parvenue à son avancement maximal.
En enseignement de spécialité, une synthèse fait appel à un raisonnement sur les réactions
compétitives : c’est la synthèse de l’acide benzoïque à partir de l’alcool benzylique. Cette synthèse est
faite en milieu basique et non en milieu acide (comme la plupart des oxydations par le permanganate)
pour éviter de catalyser l’estérification entre l’alcool réactif et l’acide formé.
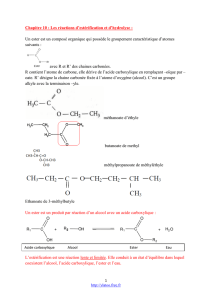
Comment le chimiste procède-t-il pour “ copier ” la nature ?
Au début de la classe de seconde, il a été montré par l’exemple de l’acétate de linalyle, ester présent
dans la lavande, que le chimiste peut parfois “ copier ” la nature, bien qu’il ne maîtrise pas les
transformations aussi bien que celle-ci.
Les processus employés par les plantes, par exemple, sont plus doux que ceux du chimiste, qui
réalise des synthèses à des températures souvent élevées.
En classe terminale, le programme fait allusion à quelques unes des spécificités des réactions au sein
du vivant : catalyse enzymatique, réactions couplées, maintien du système ouvert hors équilibre, auto-
organisation de la matière, etc. L’étude de ces réactions permettra peut être, dans les années à venir,
de procéder à des synthèses plus douces mais aussi de synthétiser des espèces actuellement
inaccessibles. Cette ouverture proposée à la fin du programme permet à l’enseignant de conclure
l’année en montrant la richesse d’une approche interdisciplinaire, et en abordant un domaine où la
recherche est intensive.
Ce programme de chimie dans son entier permet d’appréhender le métier du chimiste et de mieux
comprendre les objectifs des activités auxquelles il se consacre. La préface de Bernadette Bensaude-
Vincent replace les activités du chimiste dans leur contexte historique et donne ainsi une vision
évolutive de la chimie.

Liste des activités
La couleur noire signale les documents disponibles également dans l’édition papier.
Référence du
programme
Durée
indicative
par partie
Contenus
Activités
D.1.2
7 HCE
4 TP
D. Comment le chimiste contrôle-t-il les
transformations de la matière ?
1. Les réactions d’estérification et d’hydrolyse
- Formation d’un ester par la réaction
d’estérification
- Hydrolyse d’un ester
- Contrôle du rendement
- Contrôle de la vitesse : température et
catalyseur
2. Des exemples de contrôle de l’évolution de
systèmes chimiques
- Changement d’un réactif : synthèse d’un
ester à partir d’un anhydride, d’un savon par
saponification d’un ester
- Utilisation de la catalyse
TP. Contrôle des transformations mettant
en jeu les réactions d’estérification
d’hydrolyse des esters (doc.D1)
TP. Contrôle de la synthèse d’un ester
par changement de réactif :
hémisynthèse de l’aspirine à partir d’un
anhydride d’acide (doc.D2)
TP. Contrôle de l’hydrolyse d’un ester :
synthèse d’un savon par saponification et
propriétés des savons dans l’eau
(doc.D3)
TP. Compétition entre plusieurs réactions
chimiques : cas du titrage direct de
l’aspirine (doc.D4)
Compléments
Critère d’évolution appliqué au rendement de l’estérification (comp.D1)
Critère d’évolution appliqué au rendement de l’estérification, un exemple de calcul (comp.D2)
La catalyse hétérogène (comp.D3)
La catalyse enzymatique (comp.D4)
Nomenclature (comp.D5)
1
/
3
100%