Immunité et peau

19/04/17
– 1 – / 14
IM M U N I T E E T P E A U
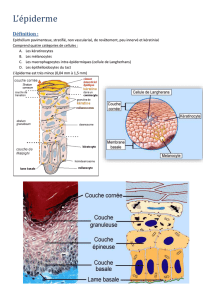
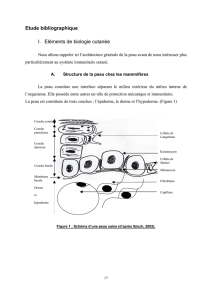
I. Revêtement cutané
- La superficie chez l’adulte : 1,8m2
- varie avec l’âge, le poids et le sexe. Environ 5kg.
- Barrière physique de 1-4mm, variation en fonction de la région du corps.
- Épiderme - membrane basale – derme-hypoderme (riche en graisses)
Chacun des éléments contribue à la défense.
A. Rôle
Rôle :
- d’enveloppe
- de défense et d’homéostasie de l’organisme :
barrière contre
o les chocs,
o les substances étrangères (micro-organismes, liquides, solides),
o dessiccation (perte de liquide),
o rayonnement (UV++),
façonnement du système immunitaire influence le fonctionnement du système immunitaire.
Thermorégulation
fabrication des différentes substances (vit D intervenant dans mécanisme phosphocalcique + régulation immunitaire)
B. Rôle de la peau dans l’immunité anti-infectieuse
Assuré par divers acteurs :
- Constituants de la peau :
épiderme, membrane basale, derme ->barrière mécanique
rôle actif des kératinocytes ( ils se comportent comme des cellules immunitaires de la réponse innée)
glandes sudoripares, et sébacés (modification du pH, libération de liquide interférant avec les capacités d’attache des bactéries,
substances anti-bactériennes …)
- terminaison nerveuse → modulation de la réponse immunitaire.
- Cellules immunitaire (tissu lymphoïde associé à la peau, non décrit mais quasi équivalent++)
- Microbiome = bactéries à la surface de la peau (flore commensale) jouant un rôle important dans les défenses contre les agents
pathogènes.
II. Système immunitaire cutané
Principales fonctions :
- lutte contre les agents infectieux tentant de traverser la peau défense locale
- homéostasie de la réponse immunitaire globale ; T régulateur, microbiome
- cicatrisation = rétablissement de la continuité (engage différents types de cellules immunitaires

– 2 – / 14
A. Principaux composants de la barrière cutanée
- Aspect purement physique de la barrière : épiderme ++
L’épiderme est composé de différentes couches. Les kératinocytes constituent la majeure partie l’épiderme ainsi qu’une masse assez
cohérente, homogène, solide assurant l'imperméabilité de la peau. Un certain nombre de structure d’attache et de connexion entre les
différents kératinocytes assurent la cohésion de l'épiderme et son étanchéité : desmosomes et Ephrines ( + tight junction)
L'ancrage à la MB des kératinocytes les plus basaux ce fait par les hémidesmosomes.
La couche superficielle, faite de kératinocytes morts en train de desquamer (par perte des desmosomes ++) est constituée de cellules plates
comportant essentiellement de l’eau et de la kératine.
Au dessus de cette couche de cellules mortes, on trouve une couche lipidique provenant de la confluence des sécrétions des glandes
sébacées et des restes des cellules → hydrophobe , d'une part et d'autre part des secrétions sudoripares (sueur) → hydrophiles : d’où la
constitutions des gouttelettes de sueur !!
C’est un film protecteur au dessus des kératinocytes, constitué d’une structure lamellaire et d’une grande variété de lipides.
Ce film est à l'origine du pH de la peau est acide, approprié à la colonisation ou la vie d’un certain nombre de bactéries mais
empêchant la fixation d’autres bactéries.
Au niveau de la jonction entre deux kératinocytes le système d'attache majeur est le desmosome ; il relie les filaments de kératine des
cellules. Leur structure est comparable a un scratch (ou un « velcro » comme dirait Kais). Ils peuvent être atteints au cours de pathologies auto
immunes ( : auto Ac contre ces structures), avec cliniquement une perte de cohésion des kératinocytes entre eux
Les hémidesmosomes attachent les cellules basales a la membrane basale ; leur atteinte entraîne la formation de bulles ( ici, le
clivage ce fait entre derme et épiderme).
Dans ces atteintes, il faut faire le test de Nikolsky : exercer une pression tangentielle sur la peau, si on observe un écartement ou un
mouvement de la couche superficielle par rapport aux couches profondes, le test est positif (→ dermatoses bulleuses autoimmunes)

– 3 – / 14
B. Cellules immunitaires de la peau
1. Cellules résidentes
Elles sont en permanence présentes sur la peau :
- Kératinocytes
- Lymphocytes T (mémoires++) :
épithéliaux ( mémoire intra épidermique )
dermiques
- Cellules dendritiques présentes en permanence en dehors des infections :
Langerhans dans l’épiderme
Myéloïde dans le derme
- Mastocytes
2. Cellules non résidentes
Elles peuvent être recrutées pendant une infection :
- Polynucléaires
- Cellules dendritiques plasmocytoïdes (en cas d’infection virale notamment, on ne les retrouve pas dans une peau « normale »)
- LT naïfs et mémoires (circulants)
- LB
Toutes ces structures cellulaires constituent le tissu lymphoïde associé à la peau se trouvent en contact permanent avec le système
lymphatique et sanguin.
En résumé :
Cellules résidentes
o Migrent peu
o Toujours présentes sur la peau
o Kératinocytes
o Lymphocytes au niveau épithélium : LT
mémoire ++ intraépidermiques et dermiques
o Cellules dendritiques : Langerhans
(épiderme) et myéloïdes (dermique)
o Mastocytes
précurseur commun médullaire
Cellules non résidentes
o Recrutées lors d’agression
o PN basophiles, éosinophiles, neutrophiles
o Cellules dendritiques plasmocytoïdes
o LT naïfs et mémoires (circulants)
o LB
III. Immunité innée
Population cellulaire :
- cellule dendritique épidermique c de Langerhans /dermique : cellules de Langerhans
- cellules NK (pas des cellules résidentes mais peuvent être recrutées)
- macrophages (dérivent des monocytes)
- mastocytes
- PN : non résidents, mais recrutés après agression
- Cellules endothéliales : partenaire dans la réponse immunitaire.
- Kératinocytes : (singulier a la peau) se comportent des cellules appartenant à l’immunité innée.
A. Cellules dendritiques
- Issue de la moelle osseuse
- Cellules de Langerhans migrent au travers de l’épiderme et constituent la 2e ligne de défense après l’aspect purement mécanique de
la peau : captent le moindre agent étranger qui a pu pénétrer l'épiderme.
- Cellules myéloïdes au niveau du derme (en permanence)
- Représente < 2% des cellules de la peau
- Capte les germes pathogènes qui ont passé la barrière = réseau sentinelle
- cellules plasmocytoides : recrutées à partir des gg, doivent traverser les vaisseaux sanguins pour coloniser le derme et contrer
l'agression par l'agent infectieux.
Les dendrites peuvent avoir des prolongements longs (10 fois le diamètre du corps !) , projetés à distance contacts serrés entre les dendrites
des différentes CD. Ce qui donne un aspect quasi cortical à ces structures.

– 4 – / 14
Ce sont des structures capables de migrer surtout quand elles captent une substance étrangère. Elles regagnent par les vaisseaux lymphatiques
le ganglion sentinelle (notion de territoire de drainage lymphatique) .
Rappel sur les cellules dendritiques :
Elles naissent dans la moelle osseuse, puis vont coloniser les tissus lymphoïdes secondaires comme la rate, la peau ou les ganglions.
Elles sont alors dans un état immature (arrondie avec peu de dendrites, dotée de capacité de phagocytose, exprimant peu de récepteur aux
chimiokines ce qui permet de les retenir dans les ganglions).
Les cellules dendritiques immatures sont peu efficaces pour communiquer avec les LTCD4+, elles possèdent aussi peu de molécules
CD80-CD86 (dont l'interaction avec le récepteur CD28 au niveau des LT permet activation pleine du lymphocyte). Elles présentent très mal l’Ag
au LT car elles ont peu de CMH2.
Une fois qu’elles phagocytent, elles vont être activées et vont se différenciées en cellules dendritiques matures (acquisition des dendrites, du
récepteur CCR7 aux chimiokines
permet la migration). La cellule dendritique devient apte et majore le niveau d’expression des CMH2. Elle
devient la CPA la plus importante, car la plus performante de l’organisme.
Quand une cellule dendritique mature entre en contact avec un LT, elle est capable de stimuler le LT et d’induire son activation. Alors que
quand une cellules dendritique immature rentre en contact avec un LT, elle ne l'active pas, elle peut même induire un phénomène d'anergie ,
donc de tolérance.
Ce contact LT-CD crée une interface très étroite ; le LT est quasi englobé par la cellule dendritique. C’est une interaction directes, physique
faisant intervenir des récepteurs de surface ; ainsi que des substances modulant les capacités du LT (module l'état d'activation) sécrétées par la
cellule dendritique.
En résumé +++ : CD immature CD mature
BREF : la CD immature bouge pas, présente mal, et active mal ; par contre elle bouffe tout. La CD mature bouge son body, présente très bien,
active bien, et mange peu.
B. Mastocytes
Ils jouent un rôle important dans les défenses et leur rôle est de mieux en mieux compris (rôle dans l’allergie et la réaction d’hypersensibilité).
Il contient de nombreuses granulations cytoplasmiques
Il exprime un grand nombre de récepteurs en surface notamment pour les fragments Fc et plus particulièrement FC-ε pour les IgE (rôle dans
l'allergie ++ ).
Il existe deux mécanismes de dégranulation du mastocyte :
- Une substance (allergène ++ ) est reconnue par les IgE, elle permet le pontage entre plusieurs IgE, ce qui aboutit a l'activation et donc
a la dégranulation de mastocyte.
- La dégranulation peut aussi avoir lieu par contact direct, par agression directe du mastocyte par une substance.
Les granules sont riches en histamine, leucotriène, tryptase... Molécules capable d’agir sur les vaisseaux du derme vasoD + augmentation de
la perméabilité membranaire (→ œdème), recrutement des cellules inflammatoires réaction inflammatoire importante, rapide voire
immédiate.

– 5 – / 14
Donc, il existe deux voies d'activation qui aboutissent au même
résultat (la dégranulation) il est donc nécessaire de pratiquer des
examens complémentaires pour identifier la voie mise en jeu.
La réaction inflammatoire immédiate se voit notamment dans les hypersensibilités immédiates. En quelques secondes le tableau s’installe :
- Un œdème lié à la sortie hors du vaisseau du sérum, voir du plasma
- afflux de cellules intervenant dans la réaction inflammatoire, dégranulation → prurit
Le mastocyte lorsqu’il migre dans des ganglions ou autres tissus lymphoïdes, peut se doter d’une capacité de présentation d’Ag. L’importance
de cette présentation n’est pas encore bien connue.
((Pré requis de L2 :p : les CPA = les cellules dendritiques+ les LB+ les macrophages + les mastocytes.))
C. Polynucléaires
Capable de phagocyter (production d enzymes de destruction bactérienne, radicaux libres, …)
Peptides antibactériens
Synthèse de leucotriène, PAF-acéter...
D. Macrophages
Les macrophages sont capables de phagocyter, de présenter l’Ag, de sécréter des cytokines participant à la potentialisation de la réponse
initiale et à la modulation réponse immunitaire.
E. NK
Les NK comportent 2 types de récepteurs et la résultante des stimulations de ces deux types de récepteurs va faire que le NK va être activé ou
inhibé. Le ligament du récepteur activateur n’est pas très bien connu. Le ligand de l'inhibiteur est le CMH 1 !
Si une cellule cible perd ses molécules de CMH1 (cellules tumorales ou infectée par un virus), les NK vont être activés et vont détruire la cellule
ar absence du CMH 1 justement !).
Attaque de la cellule cible et déversement des granules qui sont composé de :
perforine → création de pores dans la membrane
gransine induction apoptose.
Rq : Mr Lassoued c'est embrouillé +++ en cours et a inverser les deux effets (voir une source pas mal sur :
http://www.nature.com/nature/journal/v468/n7322/full/nature09518.html )
F. Cellules endothéliales
À ce niveau se fait la migration des cellules immunitaires.
Elles expriment des sélectines et des intégrines permettant le roulement des cellules à la surface des cellules endothéliales (rolling) et de les
ralentir, puis elles s’arrêtent et pénètrent la barrière endothéliale pour rentrer dans les tissus (notion de diapédèse leucocytaire ((Carooooole)).
Ce sont des cellules pouvant exprimer des molécules de co-stimulation (CD40).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%