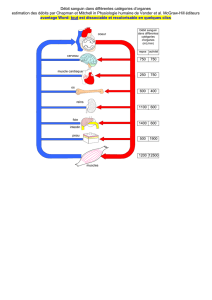
Choc chirurgical

Choc chirurgical
Généralité et choc hémorragique
Le choc est un syndrome qui se définit par une diminution du volume sanguin efficace
conduisant une perfusion tissulaire effective inadéquate compte tenu des impératifs métaboliques,
aboutisant à la mort cellulaire voire au décès de l’indivudu.
On classifie le choc selon les différentes causes :
Hémorragie : le choc hémorragique résulte en général d’une perte sanguine rapide excédant
30% du volume sanguin totale.
Traumatisme : Le choc traumatique recouvre donc un vaste domaine et il est fréquent au
cours des polytraumatismes où la multiplicité des lésions et leur potentialisation réciproque sont
un facteur de gravité supplémentaire.
Le choc hémorragique et le choc traumatisme font partie au choc hypovolémique.
Infection : le choc septique est lié dans la très grande majorité des cas à une infection par
bacille Gram négatif ou par cocci Gram positifs.
Défaillance cardiaque : le choc cardiogénique peut être le résultat d’un infactus, d’une
myocardite, d’une traumatisme cardiaque, d’un déséquilibre du milieu interieur ou de la présence
de substances nocives pour le myocarde.
Forme rare : le choc anaphylactique dans lequel qu’il s’agit d’abord d’une perturbation
vasculaire périphérique.
Le choc hypovolémique et le choc septique se voient le plus fréquemment en clinique
chirurgicale.
Physiopathologie
Aspects hémodynamiques
a) Principes d’hémodynamique normale
trois facteurs principaux contrôlent la circulation :
- la dynamique cardiaque : Le debit cardiaque est le résultat du rythme cardiaque et
du débit systolique. Le débit systolique est fonction du ① remplissage cardiaque, qui
dépend de l’extensibilité de la fibre myocardiaque et du retour veineux,
②de la force de contration du myocarde , qui depend de son integrité, de la circulation
coronaire, et de l’action locale des catécholamines.
- le tonus vasculaire : La résistance périphérique, reflete l’état de contraction
artériolaire qui est sous l’influence du système nerveux sympatique. Il peut se produire
une vaso-constriction au niveau des récepteurs alpha (rein, peau, zone splanchnique) et
une vaso-dilatation au niveau des récepteurs beta (coeur, muscles striés). L’état de
contraction ou de dilatation du système veineux joue un rôle important dans le contrôle
du retour veineux. En définitive la perfusion tissulaire dépend de l’état de la
micro-circulation, ou système capillaire.
- Le volume sanguin : il contribue au maintien de la tension artérielle en assurant un

retour veineux, et par conséquent un débit cardiaque adéquat.
b) L’hémodynamique du choc et changements de la micro-circulation
la dynamique cardiaque :-- dans la phase initiale, des mécanismes neuro-humoraux
(cathécholamines,etc) provoque une augmentation du rythme et de la force de
contraction cardiaque. Ceci contribue au maintien du débit sanguin, mais une diminution
marquée du retour veineux due à une perte de volume sanguin ou une accumulation de
sang dans le réservoir veineux peut forcer une chute du débit cardiaque. De plus , dans
une phase plus avancée, des altérations du milieu intérieur (pH, électrolytes) et
l’apparition de substances toxiques (métabolites, toxines) agiront sur le myocarde et
produiront une défaillance cardiaque.
Dans le cas ou le choc est du à une insuffisance cardiaque aigue (infactus, tamponade,
déséquilibre électro-lytique ) il y a défaillance cardiaque des la phase initiale.
Dans le choc septique ,on peut même rencontrer un débit cardiaque élevé. On a qualifie
ce paradoxe de choc hyperdynamique. Il a été attribué au début à l’ouverture
d’anastomoses artério-veineuses qui court-circuiteraient le lit capilaire.
- Le tonus vasculaire. –La libération initiale de catécholamines dans le choc produit une
vaso-constriction artériolaire au niveau des récepteurs alpha. Il s’agit d’un phénomène
compensateur qui tend à maintenir la tension artérielle et protège les organes vitaux (myocarde,
cerveau) au détriment des tissus périphériques. Cependant, une persistance trop prolongée de
l’anoxie cellulaire périphérique engendrera la production de métabolites et de substances toxiques
dont l’effet sera une vaso-dilatation artériolaire secondaire et une dépression du myocarde.
Dans la micro-circulation il y a constriction des sphincters pré-capillaires dès le debut du
choc. Ceci produit une diminution de la pression hydrostatique dans le lit capillaire qui produit un
mouvement du liquide interstitiel vers les espaces vasculaires. C’est ce mécanisme qui est
responsable de l’hémodilution compensatrice. Mais il y a aussi anoxie cellulaire et accumulation
de produits du métabolisme anaérobique tel que l’acide lactique qui dilatent les capillaires,
augmentent leur perméabilité et permettent l’extravasion de sang dans les tissus. Eventuellement
sous l’influence de ces métabolites locaux. Les spincters pré-capillaires s’ouvrent de nouveau et
participent à la vaso-dilatation tardive du choc.
Le comportement du système veineux dans le choc est encore plus mal connu que sa
physiologie normale. Certains auteurs pensent qu’il y a d’abord une vasoconstriction d’origine
sympathique suivie plus tard d’une vaso-dilatation. D’autres suggèrent une vaso-dilatation initiale.
Il est donc évident qu’après une phase initiale de vasoconstriction, le choc passe plus tard à
une phase vasodilatatrice autant au niveau des artères que des capillaires et des veines. Cette
vaso-dilatation engendre une stase et une accumulation sanguine périphérique qui peut être
considérable et que l’on décrit sous le nom de <<pooling>>. Un des effets de ce pooling est de
diminuer le retour veineux et par conséquent le débit cardiaque. Ainsi s’établit un des cercles
vicieux du choc.
- Volume sanguin : une diminution du volume sanguin peut être absolue ou relative. Elle est
absolue lorsqu’il y a eu effetivement une perte sanguine ou liquidienne. Elle est relative
lorsque le « pooling » péripherique augmente la capacité vasculaire. La présence d’une
pression veineuse centrale abaissée indique une diminution absolue ou relative du volume

sanguin qu’il faut corriger afin de rétablir une pression de remplissage cardiaque normale et
un débit cardiaque adéquat.
L’hypovolémie du choc tend à ce corriger de plusieurs façon. Tout d’abord, il y a
diffusion d’eau provenant des espaces extra-vasculaires. De plus il y a réduction de l’excrétion
urinaire par les mécanismes suivants :① diminution de la filtration glomérulaire due à la
restriction de la perfusion renale, ② l’hypovolémie et l’hypotention stimulent les centres
barorécepteurs qui agissent sur l’axe hypothalamo-hypophysaire pour libérer de l’hormone
anti-diurétique, de l’ACTH et de l’hormone glomérulotropique.
Aspects métaboliques et cellulaires
La défaillance circulatoire initiale conduit à l’anoxie cellulaire et engendre la production de
métabolites et de produits toxiques qui exercent un effet nocif sur la micro-circulation, le retour
sanguin veineux et le myocarde.
Métabolisme du glucose.- l’hypoxémie conduit à l’accumulation d’acide lactique et à une
dimunution importante de la production ATP et de substrats énergiques essentiels aux fonctions
cellulaires vitales. En plus , l’accumulation d’acide lactique contribue à l’acidose métabolique du
choc et sa concentration sérique constitue un élement de pronostic fiable.
Métabolisme des protéine.- En cas de choc , le glucose produit de façon endogène ne
contribue pas de façon suffisante à augmenter la production d’énergie. Dans les formes sévères de
choc septique, il existe une insuffisance hépatique qui diminue la production de glucose à partir de
l’alanine et cause ainsi une augmentation de la concentration des acides amines dans le sang. Anici,
l’hyperalaninémie s’ajoute à l’hyperlactacidémie pour augmenter l’acidémie déjà établie.
Metabolismes des graisses.- les acides gras libres produits sous l’effet des différents
médiateurs hormonaux ne peuvent être généralement utilisés comme tels par la cellule comme
source d’énergie dans le choc. Ils s’accumulent alors dans la circulation et produisent certain effets
toxique sur le coeur, les poumons et la coagulation sanguine et l’équilibre acido-basique.
Les électrolytes.- il y a augmentation de la kaliémie et dimunition de la natrémie. Ces
altération conduisent à la production d’oedème interstitiel et cellulaire et nuisent à la fonction
normale de la cellule.
Manifestations cliniques du choc hémorragique
Les manifestations varient selon la cause du choc et les différents stades d’evolution. Cependant,
il y a certains signes communs à la majorité des formes étiologiques puisqu’ils réflectent une
physio-pathologie commune.
Le choc hémorragique est un état clinique caractérisé par une hypotension systolique
généralement inférieure à 90 mmHg ou inférieure de 50 mmHg à son chiffre habituel, associée à
une pâleur et une froideur des extrémités, des sueurs, des troubles de la conscience et une oligurie.
Le mécanisrne physiopathologique du choc hémorragique est représenté par la réduction du flux
sanguin efficace et l’inadéquation de la perfusion tissulaire avec diminution du transport
d’oxygène vers le lit capillaire et ses conséquences sur le métabolisme cellulaire. La gravité du

choc hémorragique dépend de l’importance et de la rapidité de la perte sanguine, de l’ âge du
patient et de son état général, de la précocité, de l’ efficacité et de la nature de la réanimation. En
présence d’une maladie cardiovasculaire ou d’une anémie préalable, on peut s’attendre à une
modification de la réponse physiologique augmentant le risque d’hypoxie tissulaire et ses
conséquences délétères. d’une augmentation de la mortalité.
Manifestations cardiovascuIaires
La détresse circulatoire est évidente devant une tachycardie et une hypotension sévère avec
pincement de la différentielle. Il existe une pâleur marquée des téguments et des muqueuses. Le
remplissage des capillaires sous-unguéaux est médiocre. La peau est froide, surtout au niveau des
extrémités , mais non cyanosée . La pression veineuse centrale, si elle est mesurée à ce moment,
est basse. L’importance de l’hémorragie conditionne beaucoup la sévérité du choc. On estime
généralement qu’une hémorragie correspondant à 10-25 % de la volémie (entre 500 et l 250 ml
chez un adulte de 70 kg) entraîne un choc léger. Entre 25 et 35 %, le choc est le plus souvent
modéré.Entre 35 et 50 %, il est sévère.
En fait, il est difficile d’ évaluer à partir des seuls signes cardiovasculaires l’importance exacte de
l’hémorragie. En effet, la mise en jeu des mécanismes compensateurs, au premier rang desquels la
stimulation alpha-adrénergique, est variable d’un sujet à l’autre et variable chez un même sujet
suivant qu’il est éveillé ou sous anesthésie générale. Néanmoins on estime que chez l’adulte jeune
une soustraction sanguine de 10 % entraîne une diminution modeste du débit cardiaque.
PAS(pression artérielle systolique) et fréquence cardiaque (FC) ne sont pas significativement
modifiées. Lors d’une perte sanguine de 15 % la diminution du débit cardiaque devient très
significative, de l’ordre de 20 %, ensuite le DC (débit cardiaque) continue à s’abaisser
proportionnellement plus vite que la volémie, puisque pour une hémorragie de 20 % la baisse du
DC est de l’ordre de 40 %. Par contre, pour la même hémorragie, la PAS ne diminue que de l5 %,
tandis que PAD (pression arterielle diastolique) et PAM(pression arterielle moyenne) ne sont

pratiquement pas modifiées. La fréquence cardiaque s’accélère proportionnellement à la baisse de
la PAS.
Manifestations respiratoires
La tachypnée et la réduction du volume courant font partie des signes précoces du choc. La
ventilation/minute peut être doublée, le travail respiratoire et la consommation d’oxygène des
muscles respiratoires augmentent alors considérablement. On observe également une
augmentation de la capacité résiduelle fonctionnelle de causes diverses, parmi lesquelles
interviendrait la diminution du volume sanguin pulmonaire. Initialement, cette réduction du
volume sanguin pulmonaire améliore la compliance et l’hématose, faisant passer la majeure partie
des poumons en zones 1 et 2 de West. Il résulte de ces modifications fonctionnelles respiratoires,
une hypocapnie avec alcalose respiratoire tandis que la PaO2 se maintient, du moins à la phase
précoce du choc. A la phase tardive, les altérations de la perméabilité capillaire pulmonaire par les
médiateurs humoraux, responsables d’oedème lésionnel, expliquent l’apparition d’une hypoxie,
parfois réfractaire.
Manifestations rénales
Au cours de l’hypovolémie, il se produit une redistribution du flux sanguin rénal de la corticale
vers la zone juxta-médullaire ainsi qu’une activation du système rénine-angiotensine. Il en résulte
une oligurie avec une réabsorption sodée maximale. A la phase initiale de l’état de choc, la
natriurèse est inférieure à 10 mmoles avec un rapport osmolarité urinaire/osmolarité plasmatique
supérieur à 2. Le rein est l’organe le plus souvent lésé au cours des hémorragies graves. Pour des
hémorragies nécessitant une transfusion supérieure à 150 % du volume sanguin total, l’incidence
d’une insuffisance rénale est de 35 % chez les sujets âgés de moins de 35 ans, et de 100 % chez les
patients de plus de 50 ans.
Manifestations neurologiques
Le tableau clinique neurologique associe une angoisse, une agitation, la soif puis des troubles de
la conscience. Chez les sujets âgés de plus de 50 ans victimes d’un choc hémorragique, on note
dans 14 % des cas soit une obnubilation prolongée soit la survenue d’un accident vasculaire
cérébral. Ces manifestations peuvent survenir et s’aggraver dans les trois semaines qui suivent l’
état de choc.
Manifestations hépatiques
Au cours de tout état de choc, on observe une atteinte hépatique rapide et importante, Elle
s’explique par la diminution de la circulation hépatique surtout aux dépens du débit veineux portal,
La conséquence en est une souffrance hépatocytaire, une réduction des synthèses hépatiques et des
fonctions d’ épuration. Ces modifications rendent compte d’anomalies biologiques telles que l’
élévation des transaminases, la baisse du TP, l’hypoalbuminémie, l’hyperbilirubinémie et en partie
l’hyperlactacidémie.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%