Corrigé du contrôle 2 1er trimestre 2008

Corrigé du contrôle 2 1er trimestre 2008
A- Enzymes et température (4 points)
1° En quelle(s) unité(s) la vitesse d’une réaction enzymatique
peut-elle être mesurée ?
La vitesse se mesure en quantité de substrat qui disparaît par
unité de temps ou en quantité de produit qui apparaît par unité
de temps.
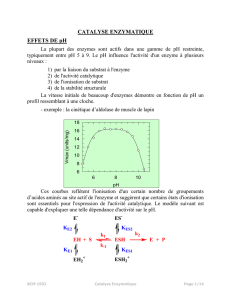
2° Sur le graphe ci-contre, retrouver la température optimale
de cette enzyme. Donnez-en une définition.
T° = 40°C. C’est la t° pour laquelle la vitesse de la réaction est
maximale.
3° Expliquer ce qui se passe pour des températures supérieures à la température optimale.
Les t° > t°opt diminuent la V car elles dénaturent les protéines (perte de la configuration spatiale) donc le site actif
(portion de la surface de l’E constituée d’AA et qui s’associe au substrat dt il a une forme complémentaire) est
d’autant plus endommagé voire détruit que la t) est élevée.
B- Comprendre le mécanisme d’action d’un antibiotique (8 points)
Les sulfanamides sont une famille d’antibiotiques qui perturbent, chez les bactéries, la fabrication de certains
nucléotides de l’ADN. Ainsi les cellules incapables de répliquer leur ADN ne peuvent se multiplier dans
l’organisme.
Cette fabrication nécessite l’intervention d’acide folique, molécule synthétisée à partir d’acide para
aminobenzoïque. Une enzyme bactérienne catalyse la synthèse de l’acide folique à partir de l’acide para
aminobenzoïque.
L’activité de cette enzyme est d’abord évaluée sans la présence d’une molécule de la famille des sulfamides, en
mesurant la vitesse de transformation de l’acide para aminobenzoïque (PABA) en fonction de sa concentration
(document1).
Lors d’une seconde série d’expériences, pour chacune d’entre elles, on ajoute au milieu une même quantité de
sulfamide quelle que soit la concentration en substrat. La structure de la molécule de sulfamide et de l’acide para
aminobenzoïque sont indiquées dans le doc 2.
1° Quel est l’effet de l’antibiotique sur la vitesse de la réaction enzymatique catalysée par l’enzyme ?
(Pour répondre comparez précisément les 2 courbes) (3)
R Pour des concentrations assez faibles en S , V1 est > V2 puis + la S est élevée plus la différence entre
les 2 vitesse diminue pour s’annuler.
I : C’est l’antibiotique qui est responsable de la diminution de la vitesse de la réaction enzymatique.
C : L’antibiotique diminue la vitesse de la réaction d’autant plus que la S est faible.
( dont 0,5 pour méthode ERIC)
Vitesse de la réaction
Document1
Document 2

2° Utiliser le doc 2 pour justifier le qualificatif d’inhibiteur compétitif donné à cette molécule. (3)
R Ces 2 molécules ont des formules chimiques proches qui ne diffèrent que par un radical (COOH/SO2NH2).
I : Leurs configurations spatiales doivent être proches.
C : L’antibiotique prend la place du PABA sur le site actif de l’enzyme et limite ainsi le nbre de sites actifs
disponibles par unité de temps, ce qui entraîne une diminution de la vitesse (inhibition). Il y a compétition entre
les 2 molécules pour le site actif d’autant plus forte que la concentration en substrat est faible.
3° Utiliser votre réponse précédente et l’ensemble des informations pour retrouver le mécanisme d’action probable
de cet antibiotique. (2)
Les sulfamides par inhibition compétitive diminuent la vitesse de la réaction catalysée par l’enzyme à savoir la
transformation de PABA en acide folique. Or celui-ci en moindre quantité ne peut favoriser la synthèse des
nucléotides eux-mêmes indispensables à la synthèse d’ADN donc à la multiplication des bactéries.
C- Comparer deux enzymes (5)
La trypsine et la chymotrypsine sont 2 enzymes digestives
sécrétées par le pancréas. Elles catalysent toutes les deux
l’hydrolyse de liaisons peptidiques au sein des protéines.
• La trypsine catalyse l’hydrolyse de liaisons peptidiques à
proximité d’un acide aminé à radical basique comme l’arginine
ou la lysine, tandis que la chymotrypsine catalyse l’hydrolyse
de liaisons peptidiques à proximité d’un acide aminé à radical
aromatique comme la tyrosine, le tryptophane ou la
phénylalanine.
On a comparé les sites actifs de ces 2 enzymes et les résultats
sont consignés dans le tableau.
1° Exploiter ces résultats pour donner un nom précis à la zone A et à la zone B. (3)
Données :d’après le tableau, les 2 enz possèdent le même site B, mais diffèrent par le site A.
I : Or ils catalysent la même réaction chimique : l’hydrolyse de la liaison peptidique mais pas sur les mêmes
substrats (acides aminés différents)
C : la zone A est le site de fixation ; la zone B est le site catalytique
2° Comparer alors les spécificités de ces 2 enzymes. (2)
Ces enzymes ont donc même spécificité d’action mais des spécificités différentes de substrat.
D- La Rubisco, une enzyme primordiale dans le monde vivant (3points)
La Rubisco, ou Ribulose 1-5 biphosphate carboxylase oxygénase est une enzyme qui représente plus de 50% des
protéines solubles des chloroplastes des végétaux chlorophylliens. Cette enzyme est alors probablement la plus
abondante de notre planète.
Elle doit son nom à sa double fonction. Etant capable de carboxyler son substrat, le ribulose-1,5-biphosphate, ou de
l'oxygéner. L'O2 se fixe sur le même site catalytique que le CO2.
C’est la richesse relative du milieu en O2 et CO2 qui oriente l’activité de l’enzyme.
1° En quoi cette enzyme semble-t-elle originale ?
Cette enzyme possède un substrat le ribulose 1-5 biphosphate (spécificité de substrat ) et catalyse 2 réactions
chimiques différentes une oxydation et une carboxylation. ( pas de spécificité d‘action)
NB on peut aussi discuter de la spécificité de substrat dans la mesure ou l’O2 et le CO2 étant des réactifs de chaque
réaction chimique, ce sont, comme le ribulose, des substrats de cette enzyme.
Chymotrypsine
trypsine
Zone A
Sérine 189
Acide
aspartique102
Zone B
Acide aspartique
102
Histidine 57
Sérine 195
Acide
aspartique 102
Histidine 57
Sérine 195
1
/
2
100%