Biologie cellulaire du 1 mars

1
Biologie cellulaire du 1 mars : 2ème cours Bottari
Les protéines G : leur spécificité.
- Spécificité conféré à la sous unité :
-Gs : s : stimule l’adénylate cyclase. Selon les types cellulaires elle interagit avec différents
complexes β γ.
-Gi : i : inhibe l’adényl cyclase. Il y a plusieurs isoformes.
-Go : o : other ou zero. Découverte par clonage par homologie : pêcher des protéines
homologues avec des sondes. Abondante au niveau du cerveau. Inhibe les canaux Ca++ et
stimule les canaux K+.
-Gq : q : active la phospholipase C,…
-G12 : 12 : Stimule PLA2 et d’autres.
-Gt (ou T) : est la seule exprimé au niveau de la rétine et responsable de la transmission du
signal photonique. Active une phosphodiestérase du GMPc.
Mécanismes de régulation de l’adénylate cyclase.
-Il y a aussi des récepteurs qui agissent par Gi.
-Les récepteurs stimulant l’adénylate cyclase sont les récepteurs S ou stimulateurs et les autres
I ou inhibiteurs.
-Il y a les hormones : extracellulaires qui régulent cette enzyme mais il y a d’autres
mécanismes qui peuvent expliquer des pathologies.
-Hormones : Quand dysfonctionnement au niveau de ces voies de signalisation, ça peut
expliquer pourquoi ces voies peuvent être perturber.
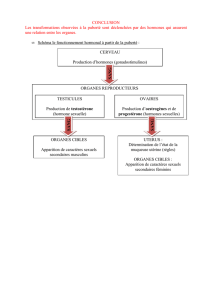
- ACTH, TSH, LH, FSH : sont des hormones hypophysaires. L’hypophyse se trouvant
à la base du cerveau, sous contrôle de l’hypothalamus (plusieurs noyaux).
-ACTH : hormone corticotrope qui stimule le cortex surrénalien des glandes
surrénales. Le cortex synthétise les hormones stéroïdiennes : les glucocorticoïdes (cortisol
chez l’homme) et les minéralocorticoides (aldostérone). Hormones qui agissent sur des
organes périphériques par des récepteurs nucléaires ou intracellulaires. Les glucocorticoïdes
jouent un rôle sur le métabolisme glucidique et au niveau de la régulation des mécanismes
immunitaires. L’ACTH agit au niveau de récepteurs du cortex surrénalien pour stimuler
l’expression d‘AMPc qui est responsable de l’expression de gènes donc d’enzymes.
-TSH : Stimule la thyroïde qui sécrète les hormones thyroïdiennes (thyroxine et tri
iodo thyronine) qui agissent par des récepteurs intracellulaires.
-FSH et LH : sont les gonadotropines qui sont des hormones à effet gonadotrope c’est
à dire stimulent les gonades.
-PTH : c’est la parathormone qui est sécrété par la parathyroïde (4) et qui joue un rôle
important sur le métabolisme du phosphore et du calcium donc au niveau du remodelage
osseux (car le plus gros stock de calcium).
-Adrénaline : Rôle sur le métabolisme glucidique, tonus du muscle lisse, fonction
cardiaque, réponses liées au stress. Agit par différents récepteurs donc les récepteurs β
adrénergiques agissent par Gs pour stimuler l’activité de l’adénylate cyclase.
-Glucagon : action opposé à l’insuline. Permet de mobiliser du glucose à partir des
stocks intracellulaires par l’intermédiaire de la glycogènolyse.
-Les hormones agissent tous par des récepteurs spécifiques (chacun a son récepteur) et ceux ci
vont tous agir par l’intermédiaire de Gs pour activer l’adénylate cyclase. Pourquoi des effets
différents pour toutes ces hormones alors que même protéine G ? C’est une histoire de
différence d’expression d’enzymes, de présence de microdomaines et de formation de dimères
entre récepteurs de différents types.

2
Mutations : anomalie sur un gène pour avoir un dysfonctionnement ou manque
d’expression de protéines. Des mutations au niveau de Gs ou du récepteur.
- Mutations du récepteur : de la TSH. Les hyperthyroïdies sont un
dysfonctionnement de la thyroïde : celle ci synthétise et sécrète trop d’hormones
thyroïdiennes. Donc à priori il s’agit d’une stimulation trop grande de la thyroïde par
l’hormone hypophysaire : la TSH car si hypophysectomie on peut normaliser la situation.
Chez ces malades, le taux de TSH est effondré donc il ne s’agit par de l’hypophyse qui
produit trop de TSH donc il s’agit bien d’un défaut au niveau de la glande thyroïde. Car c’est
un système de rétrocontrôle négatif qui fait que la production des hormones thyroïdiennes
freine la production des hormones hypophysaires (TSH) ou hypothalamique dans d’autres
systèmes endocriniens. Donc certaines mutations du récepteur ont un rôle activateur car la
conformation est modifiée. Ceci a permit de comprendre quels sont les changements
conformationels qui permettent au récepteur de se coupler aux protéines G. Pour le récepteur
à TSH, on a comprit quelle est la conformation du récepteur pour activer la protéine Gs.
D’autres mutations maintiennent le récepteur dans une conformation inactive. Ca a permit de
faire comprendre le mécanisme des analogues synthétiques des hormones :
- Agoniste : analogue mimant l’action de l’hormone donc conformation favorable à
l’interaction avec G.
- Antagoniste : se lie au récepteur mais ne déclenche pas de cascade de signalisation. Il y a des
antagonistes qui maintiennent le récepteur dans une conformation native donc inactive et
d’autres molécules le mettent dans une conformation qui empêche toute interaction avec les
protéines G. La différence entre les 2 c’est que le récepteur dans sa conformation native peut
encore interagir à une faible affinité pour la protéine G mais le second cas c’est des molécules
qui peuvent mettre le récepteur dans une conformation telle qu’il est incapable d’interagir
avec la protéine G. Ces mutations peuvent expliquer des pathologies.
-Il est important de savoir si l’hyperthyroidie est dû à :
-une hyperproduction de TSH (--) (en général à cause d’adénome pas sensible à l’effet de
rétrocontrôle négatif par les hormones thyroïdiennes).
-la présence d’autres molécules stimulant le récepteur comme dans les maladies auto-
immunes où les anticorps activent le récepteur (++) (taux de TSH effondré à cause du
rétrocontrôle négatif)
-une mutation activatrice (difficile de freiner l’activation du récepteur sauf si on trouve
analogue pouvant modifier la conformation du récepteur pour l’empêcher d’interagir). Dans
ce cas on essai d’agir en aval du système en bloquant l’action des enzymes stimulés par
l’activité de l’AMPc. (++) (taux de TSH effondré).
- Dans les hyperthyroïdie dû à ces mutations ou la présence d’Anticorps on bloque la synthèse
des hormones thyroïdiennes en donnant des molécules interférant avec les enzymes impliqués
dans la synthèse d’hormones thyroïdiennes.
-Mutations des protéines G :
- Gs : Dans des adénomes hypophysaires (tumeurs bénignes) il y a des mutations activatrices
de la protéine Gs. Beaucoup de ces adénomes sont hyperactifs, vont produire soit beaucoup
d’ACTH soit de FSH/LH. Ces mutations concernent la sous unité . Des mutations
inactivatrices au niveau des cellules sensibles à l’action de la PTH (= parathormone) qui a un
rôle sur le métabolisme phosphocalcique et là ça donne lieu à une maladie : la pseudo para
thyroïdie. Les malades ont beaucoup de PTH mais ne répondent pas à la PTH donc
développent des troubles du métabolisme phosphocalcique (hypocalcémie). En faite c’est une
mutation au niveau de Gs : s essentiellement au niveau de certains organes sensibles à la
PTH donc ça bloque la réponse à la PTH. « Hypoparathyroidie » car ils ont les symptômes

3
d’une hypoparathyroidie et « Pseudo » parce qu’ils ont un taux de PTH élevé. Donc c’est une
résistance à l’action de la PTH. ( Il y a aussi des résistances à l’insuline donc diabète type II).
- Gi
Mécanisme des toxines :
- toxine cholérique (sécrété par la bactérie responsable du choléra : diarrhée lié à la
sécrétion d’eau donc mortalité du choléra c’est la déshydratation) : agit au niveau d’ s et
suite à l’activation irréversible d’ s il y a activation de canaux ioniques qui entraînent une
sécrétion de sodium et eau importante donc perte d’eau. Cette toxine agit par l’ADP
ribosylation qui est une modification covalente des protéines qui fait appel au NAD
(nicotinamide adénine dinucléotide). Cette toxine catalyse la réaction d’ADP ribosylation qui
clive le nicotinamide du NAD et greffer l’adénine- 2 ribose au niveau d’ s.
- toxine pertussique : Pertussis = coqueluche qui provoque la toux et cardiotoxicité.
Le mécanisme d’action est l’ADP ribosylation spécifique de la protéine Gi. Elle désactive Gi
de façon irréversible.
- Ces toxines sont spécifiques car reconnaissent un AA différent au sein de séquence
spécifique différent sur Gs et Gi.
- Ce n’est pas le même effet pour les deux toxines car la cellule est la cible de
beaucoup de stimulis différents donc le fait d’inhiber i a des conséquence à partir du
moment où la cellule est stimulé par d’autres mécanismes qui stimulent l’adénylate cyclase.
L’adénylate cyclase
- Peut être la cible de la forskoline trouvé dans des plantes. Elle active directement l’adényl
cyclase irréversiblement sans passer par récepteur ou G.
Hormones agissant par récepteurs inhibant l’adénylate cyclase en se couplant à Gi.
- Adrénaline et noradrénaline : 2 molécules voisines qui agissent par les mêmes récepteurs
adrénergiques qui lient les deux molécules avec la même affinité. Les récepteurs 2
adrénergiques sont responsables de l’inhibition de l’adénylate cyclase.
- Somatostatine : produite par de nombreux tissus. Elle inhibe l’action de nombreuses
hormones et en particulier d’hormones qui agissent par récepteurs couplés à Gs. C’est donc
une hormone qui contre régule, freine les mécanismes d’activation de l’adénylate cyclase.
Elle a un effet anti prolifératif.
- Angiotensine : augmente la tension artérielle en produisant une vasoconstriction et en
agissent sur les reins où augmentation de la réabsorption du sodium et d’eau.
- Dopamine : C’est le précurseur de la noradrénaline et l’adrénaline. Sécrété principalement
au niveau du SNC dans le système dopaminergique. Le déficit de synthèse en dopamine est
responsable de la maladie de Parkinson. La dopamine agit aussi par des récepteurs couplés
aux protéines Gi.
- Vasopressine : augmente la tension artérielle, augmente la réabsorption d’eau au niveau du
rein pour augmenter le volume plasmatique.
ADP ribosylation
- Les 2 toxines provoquent l’ADP ribosylation.
- la cholérique agit qu’au niveau des protéines Gs. L’ADP ribosylation d’ s provoque son
activation irréversible et ça peut aussi agir sur la transducine mais en général ça ne va pas
jusque dans la rétine.
- la pertussique agit au niveau des protéines de la famille Gi donc Go, T. L’ADP ribosylation
inhibe irréversiblement l’activité de Gi.

4
-T possède la séquence reconnu par les deux toxines.
-Ce sont les deux seules toxines qui ADP ribosyle les protéines G hétérotrimériques. Les
petites protéines G : RAS, Rho, Rag sont ADP ribosylé par d’autres toxines.
Classification des sous unités des protéines G.
- Les protéines G ont étés identifiées par clonage par homologie : On prends une séquence en
nucléotide qui correspond à une séquence en AA ce qui permet de cribler les banques
d’ADNc et de sortir les protéines qui ont un certain degré d’homologie avec cette séquence.
- La famille Gs : s, olf (au niveau de l’épithélium olfactif). Seules sensibles à la toxine
cholérique.
- La famille Gi : 3 isoformes d’ i. 2 isoformes de Go. La transducine et Z. Elles sont toutes
sensibles à la toxine pertussique.
- La famille Gq : q, 11, 14, 15, 16.
- La famille G12 : 12 et 13.
- Classification basée sur le degré d’homologie : pourcentage d’AA conservé. Entre les
protéines Gs et G12, il y a moins de 50% d’homologie.
Fonctions des sous unités .
- Gs : s : Aucune différence au niveau de la fonction de ces différentes formes ni de Golf.
-Elles stimulent toute l’adénylate cyclase et elles peuvent activer la GTPase de la
tubuline qui est une protéine du cytosquelette.
-Ca active Sarc qui est un protooncogène = protéine qui muté devient oncogénique.
Sarc est une tyrosine kinase impliquée dans de multiples voies de signalisation, quand elle est
muté elle induit une prolifération cellulaire irréversible. Ce qui explique pourquoi des
hormones par l’intermédiaire de Gs peuvent stimuler la prolifération cellulaire. C’est
important pour l’ACTH, TSH, FSH, LH car toutes ces hormones hypophysaires stimulent la
synthèse des hormones par les glandes cibles mais aussi avoir un effet trophique : stimuler la
prolifération de ces glandes.
- Gi :
- i 1, 2, 3 : Inhibition de l’adénylate cyclase.
-Go : active GTPase de la tubuline, stimule SARC et stimule des canaux calcique et
potassique.
-Gz.
-Gt : active la phosphodiestérase du GMPc. Le GMPc régule l’ouverture de canaux
sodique donc lorsqu’on dégrade le GMPc cela module l’ouverture de ces canaux sodique donc
c’est la transmission du sodium qui est responsable de la transmission de l’influx nerveux
pour conduire à la perception visuelle vers le cerveau.
- G (gustative) : responsable de la transmission du goût mais on ne connaît pas
l’enzyme effectrice.
-Gq : q, 11, 14, 15, 16.
- Active la PLC β.
- Active une tyrosine kinase qui est un proto-oncogène donc impliqué dans la
stimulation de la prolifération cellulaire.
-G12 :
- Active un échangeur sodium/proton : régule le PH intracellulaire. C’est cruciale.
C’est régulé par des hormones parce que des modifications du PH peuvent être nécessaire
pour certaines fonctions comme la division cellulaire.
- Active la Phospholipase D.

5
- Active Rho (petite protéine G monomérique importante dans la régulation,
l’organisation du cytosquelette).
- Active INOS = NO synthase qui synthétise le NO.
Fonctions des sous unités β γ.
- Les PLC sont activés par une protéine G de la famille Gq donc par les sous unités q mais
aussi par les sous unités β γ. Donc la spécificité des protéines G n’est pas uniquement dû à
mais aussi à β γ. Toutes les sous unités β γ de toutes les protéines G ne sont pas capables de
faire la même chose. On a jamais pu montré que Gs était capable d’activer la PLC donc β γ
couplé à s ne va jamais activer la PLC. C’est une histoire de microdomaines qui fait qu’on
ne trouve pas au même endroit les récepteurs couplés à Gs, Gs et la PLC.
-L’adénylate cyclase est régulé par s et i mais aussi par β γ et selon les cellules et les
microdomaines il y a dans certain cas inhibition et dans d’autre activation.
-canaux K et Ca sont régulés par o (Go) mais aussi par les sous unités β γ : stimulation des
canaux K, inhibition des canaux calciques.
-Kinases des récepteurs aux protéines G : Fonction primordiales des sous unités β γ
- PI3K,… stimulés par β γ.
-Calmoduline : protéine régulatrice des kinases.
-Dynamine : protéines du cytosquelette en modulant l’activité GTPase et c’est important car
le GTP est le substrat des petites protéines G aussi qui ont rôle dans l’organisation du
cytosquelette.
-RAF et RAS régulés par des facteurs d’échanges dont β γ.
Protéine Gq
- Active PLC β.
- Les PLC utilisent pour substrat le PIP2.
- L’inositol est phosphorylé en 4 et 5.
- Le DAG, la phosphate et l’inositol phosphorylé en 4 et 5= PIP2
- La PLC clive PIP2 entre le phosphore et l’oxygène donc il va resté d’un côté le DAG et de
l’autre l’inositol triphosphate.
- Le DAG est inséré dans la membrane. Le phosphate lit le DAG à l’inositol 4,5 P.
- Le PLC donne donc le DAG qui reste dans la membrane et l’inositol triphosphate (1,4,5).
Les autres isoformes d’IP3 n’ont aucune activité biologique et certaines enzymes le
transforment en IP3 (1,3,4) qui n’a aucune activité biologique.
- Le DAG est indispensable à l’activation de la PKC.
- L’IP3 joue un rôle pour libérer le calcium du réticulum endoplasmique.
- L’IP3 agit par l’intermédiaire de récepteurs canaux calciques exprimés sur le RE donc le
calcium sort à cause de l’énorme gradient. En 30 seconde, la concentration de calcium passe
de 10-7 à 10-5 molaires.
-Suite à cette augmentation de concentration, le calcium se lit à la calmoduline ce qui va
pouvoir activer les calmodulines kinases. Les sous unités β / γ peuvent réguler l’activité des
calmodulines kinases directement.
-Le calcium peut activé la PKC et jouer un rôle dans la régulation de facteurs de transcription.
-Quand la concentration de calcium cytosolique a augmenté abondamment, il faut que la
calcium du cytosol sorte donc une partie va dans le RE par des Calcium ATPases spécifiques.
-Une partie est rejeté à l’extérieur par des calciums ATPases.
-Le DAG reste ancré à la membrane et il est nécessaire à l’activation de la PKC qui nécessite
aussi la présence de Pser.
 6
6
1
/
6
100%