B5_temps et evolution chimique - leprof

Page 1 sur 7
Chap. B5 Temps et évolution chimique
I. Transformations lentes et rapides
1- Evolution d’un système
Pour suivre l'évolution d'un système chimique en fonction du temps, il faut disposer d'une technique de
mesure d'une grandeur intervenant dans la description de ce système, par exemple la concentration de
l'un des réactifs ou des produits.
Une mesure n'est jamais instantanée : elle dure un certain temps. Cette durée dépend de la technique de
mesure utilisée.
Exemples : La durée d'un titrage est de quelques minutes. Une mesure de pH avec un papier pH dure
quelques secondes. En conductimétrie, la durée d'une mesure est très brève, de l'ordre du dixième de
seconde.
Pour suivre l'évolution d'un système chimique en fonction du temps, il faut toujours choisir une
méthode de mesure telle que la réaction étudiée soit lente vis à vis de cette méthode.
2- Transformations rapides.
Une transformation rapide se fait en une durée trop courte pour que nous puissions en suivre
l'évolution à l'œil ou avec nos instruments de mesure.
Exemples : La décomposition d'un explosif ou les réactions de précipitation, comme la précipitation du
chlorure d'argent et de l'hydroxyde de cuivre (II).
3-Transformations lentes.
Une réaction chimique est dite lente par rapport à une technique de mesure donnée si la grandeur
mesurée ne change pas de façon significative pendant la durée de la mesure.
4- Transformations infiniment lentes.
Une réaction est dite infiniment lente lorsque l'évolution du système ne peut être appréciée, même
après plusieurs jours : un tel système est dit cinétiquement inerte.
Certaines transformations sont tellement lentes qu'il semble qu'elles ne puissent se produire. On dit
qu'elles sont cinétiquement bloquées. Comme la synthèse de l'eau.
II. Suivi d’une transformation
1- Avancement
Soit la réaction chimique d'équation : a A + b B c C + d D.
La composition initiale du mélange est niA moles de A et niB moles de B.
À la date t (après le début de la réaction), il reste nA moles de A, nB moles de
B et il est apparu nC moles de C et nD moles de D. On peut dresser le tableau
Il a donc disparu niA - nA moles de A et niB - nB moles de B.
En tenant compte des nombres stoechiométriques de l'équation de la réaction, on peut remarquer que :
ann A
i
A
bnn B
i
B
c
nC
d
nD
La valeur commune de ces rapports s'appelle l'avancement x de la réaction à la date t.
On aura donc : x
ann A
i
A
bnn B
i
B
c
nC
d
nD

Page 2 sur 7
2- Méthode
Toutes les transformations chimiques étudiées dans ce chapitre se déroulent dans un milieu réactionnel
dont le volume V reste constant.
Pour effectuer le suivi temporel d'une transformation se déroulant à volume constant, on mesure à
différents instants successifs la concentration d'un réactif ou d'un produit dans le milieu réactionnel.
Pour cela, on dispose de différentes méthodes chimiques (titrage) ou physiques (pHmétrie,
conductimétrie ou spectrophotométrie).
3- Evolution
Les mesures effectuées permettent de tracer la courbe représentant l'évolution temporelle de la
concentration suivie. Pour un réactif, cette concentration décroît au cours du temps et pour un produit,
elle croît:
4- Avancement et concentration
Dans le cas particulier d'une réaction en solution, au cours de laquelle le volume V de la solution reste
constant, il est possible de faire apparaître la concentration molaire des espèces en solution.
La concentration [X] d'une espèce en solution est définie par:
V
n
Xx
[X] : concentration molaire (en mol.L-1)
nx : quantité de matière de X en solution (en mol)
V: volume de la solution (en L)
D'où, en reprenant la relation de définition de l'avancement et en divisant par V :
d
D
c
C
bBB
aAA
Vii
x
5- Vitesse volumique
a) définition
La vitesse volumique v d’une réaction chimique (ou simplement vitesse de réaction) est définie à partir
de l’avancement x de la réaction et du volume V du système chimique au sein duquel se déroule la
réaction. Elle est donnée par la relation v =
t
x
d
d
V
1
La vitesse de formation d’un produit est v(P) =
dt
Pd
et la vitesse de disparition d’un réactif est
v(R) = -
dt
Rd
, ce sont des grandeurs déduites de l’expérience.
b) Détermination
Il faut avoir accès à la courbe x =f (t), ou à un tableau de mesures qui permet de tracer la courbe
précédente, ou qui peut être traité grâce à un tableur.

Page 3 sur 7
Dans la définition v =
t
x
d
d
V
1
,
t
x
d
d
représente la valeur de la dérivée par rapport au temps de
l'avancement x. La valeur
t
x
d
d
est obtenue en évaluant le coefficient directeur de la tangente à la courbe
x =f (t) à la date t.
Il y a la méthode graphique : tracer la tangente à la courbe x =f (t) à la date t, calculer la valeur du
coefficient directeur de cette tangente (il est égal à tan ) puis diviser par le volume V de solution, ou
l’utilisation d'un tableur: à partir des valeurs de x, t et V, le tableur calcule les valeurs de la vitesse v
aux différentes dates.
6- Temps de demi-réaction.
a- Définition
Le temps de demi-réaction, noté t1/2 est la durée nécessaire pour que l'avancement x soit parvenu
à la moitié de sa valeur finale xf. t1/2 s'exprime en seconde, minute, heure, année ...
Une méthode de mesure est adaptée pour suivre une transformation chimique si la durée
de la mesure est au moins dix fois plus petite que le temps de demi-réaction de la transformation.
Le temps de demi-réaction permet d'évaluer la durée nécessaire à l'achèvement de la
transformation chimique étudiée.
Pour une transformation totale, pour t = t1/2 alors x =
2
max
x
b- Détermination
Le temps de demi-réaction se détermine graphiquement dès qu'on peut déterminer xf . C'est l'abscisse
du point de la courbe x(t) dont l'ordonnée est xf /2.
III. Facteurs cinétiques
1- Température.
En général, une réaction chimique est d'autant plus rapide que la température
du système chimique est plus élevée. On dit que la température est un facteur
cinétique.
La valeur de l’avancement final reste inchangée
2- Concentration. En général, une réaction chimique est d'autant plus rapide que la
concentration initiale d'au moins un des réactifs est plus élevée. On dit
que la concentration des réactifs est un facteur cinétique.
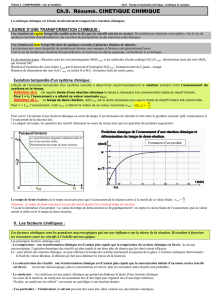
La figure ci-contre montre l'évolution de l'avancement x de la réaction en
utilisant des concentrations initiales de réactif limitant différentes.
Pour la courbe (1), [S2O82-(aq)]i = 0,018 mol.L-1 et pour la courbe (2),
[S2O82-(aq)]i = 0,036 mol.L-1. Dans les deux cas, la température est la
même. Le tracé des tangentes à l'origine permet d'évaluer les vitesses
initiales (à la date t = 0). On peut observer que lorsque la concentration
initiale d'un réactif augmente, la valeur du coefficient directeur de la tangente augmente; donc la
vitesse initiale de réaction augmente.

Page 4 sur 7
IV. Suivi cinétique d’une réaction chimique
1- Méthode chimique
Ces méthodes consistent à doser l'une des espèces chimiques (réactif ou produit) lors de la réaction. Le
dosage s'effectue à intervalles de temps réguliers. Cette méthode a déjà été utilisée pour suivre
l'évolution de la quantité de diiode formé lors de la réaction lente correspondant à l'équation :
2 I-(aq) + S2O82-(aq) I2(aq) + 2 SO42-(aq)
Le diiode formé est dosé par l'ion thiosulfate S2O32-(aq). Ce dosage fait intervenir une réaction
d'oxydoréduction. Selon la réaction étudiée, on pourrait également envisager des dosages acido-
basiques.
Ces méthodes présentent cependant des inconvénients
- pour que le système réactionnel n'évolue pas en cours de dosage, il faut stopper la réaction. On
effectue alors une trempe ou une forte dilution;
- pour ne pas perturber le mélange réactionnel, on doit fractionner le système réactionnel en plusieurs
échantillons pour les analyser séparément aux dates choisies;
- le dosage est effectué à des dates précises, ce qui signifie que l'on ne peut pas suivre continûment
l'évolution de la réaction.
Les méthodes chimiques ne permettent pas d'enregistrer continûment l'évolution dans le temps d'une
quantité de matière ou d'une concentration.
2- Méthodes physiques
Les méthodes physiques permettent de suivre l'évolution dans le temps d'une grandeur physique dont la
valeur dépend de la quantité de matière (ou de la concentration) d'un réactif ou d'un produit de la
réaction .
L’avantage des méthodes physiques est qu’elles ne perturbent pas le système réactionnel et permet un
enregistrement continu de l’évolution d’un réactif ou d’un produit.
a. pHmétrie
Lors d'une réaction, si le pH du système réactionnel varie suffisamment au cours du temps en raison de
l'apparition ou de la disparition d'ions H+(aq), on peut enregistrer la variation de pH
L’enregistrement permet de déterminer les concentrations ou les quantités de matière des réactifs et
produits de la réaction.
b. Conductimétrie
La réaction de la soude sur l'éthanoate d'éthyle, encore appelée saponification, consomme des ions HO-
(aq) et produit des ions éthanoate. La conductivité ionique molaire des ions HO-(aq) étant différente de
celle des ions éthanoate, la conductance de la solution varie au cours du temps. En suivant l'évolution
dans le temps de la conductance de la solution, on peut en déduire la variation de la concentration de
ces deux espèces et, par conséquent, la vitesse de la réaction.
c. La mesure de pression
Pour les réactions produisant ou consommant des gaz.
d. Echelle de teintes et spectrophotométrie
On utilise les propriétés optiques des solutions colorées.
L’avantage des méthodes physiques est qu’elles ne perturbent pas le système réactionnel et permet un
enregistrement continu de l’évolution d’un réactif ou d’un produit.
La loi de Beer-Lambert relie l'absorbance de la solution à la concentration C de l'espèce absorbante :
A = . l . C
où l est l'épaisseur de la cuve traversée par le faisceau lumineux et le coefficient d'absorption
molaire(dépend de la substance, de la longueur d’onde et du solvant),
avec : en L. mol-1.cm-1; l en cm ;
C en mol.L-1; A sans unité.

Page 5 sur 7
V. Suivi d’une cinétique par spectrophotométrie.
1- Réaction
On étudie l'action d'une solution aqueuse de peroxodisulfate de sodium sur une solution aqueuse
d'iodure de potassium. Les couples en jeu sont : S2O82-(aq)/SO42-(aq) et I2(aq)/ I-(aq)
L’équation de la réaction est
2 I-(aq) + S2O82-(aq) I2(aq) + 2 SO42-(aq)
Il se forme du diiode, qui colore progressivement en brun la solution. L'avancement de la réaction peut
être suivi par spectrophotométrie. Remarque : Le diiode formé réagit avec les ions iodure en excès
pour former des ions triiodure : I2 + I- = I3- . C'est cet ion complexe I3- qui colore la solution.
A la date t = 0, on mélange 2,0 mL d'une solution aqueuse de peroxodisulfate de sodium à la
concentration c1 = 3,0 10-2 mol.L-1 et 2,0 mL d'une solution d'iodure de potassium de concentration
c2 = 0,150 mol.L-1. Dans les conditions de l'expérience, les ions peroxodisulfate constituent le réactif
limitant. Le tableau récapitule les transformations subies par le système au cours du temps.
Réaction
2 I-(aq) + S2O82-(aq) I2(aq) + 2 SO42-(aq)
Date
Avancement
n(S2O82-)
n(I-)
n(I2)
n(SO42-)
t = 0
x = 0
n°ox = 6,010-5 mol
n°red = 1,010-3 mol
0
0
t
x
n°ox - x
n°red - 2 x
x
2 x
2- Mise en œuvre
Le spectrophotomètre est réglé sur la longueur d'onde = 575 nm, compatible avec l'absorbance de la
solution de diiode formé.
Le spectrophotomètre, relié à un ordinateur, permet d'enregistrer en continu les valeurs de l'absorbance
en fonction du temps.
• On règle le zéro à l'aide de la solution aqueuse d'iodure de potassium (le solvant).
• À la date t = 0, on mélange rapidement les réactifs, puis on déclenche l'acquisition automatique.
3- Evolution de l'absorbance au cours du temps
On peut déterminer la vitesse volumique d'une réaction à l'aide d'un suivi spectrophotométrique.
• D'après la loi de Beer-Lambert, l'absorbance de la solution est à chaque instant proportionnelle à la
concentration en diiode :
A = K [I2(aq)] La valeur de K est obtenue par un étalonnage préalable avec des solutions de diiode
dont les concentrations sont connues.
Absorbance en fonction de la Variation de l’absorbance du milieu
concentration en diiode. réactionnel au cours du temps.
 6
6
 7
7
1
/
7
100%