Corrigé du DS 2 de seconde D du 30 novembre 2009

Corrigé du DS 2 de seconde D du 30 novembre 2009
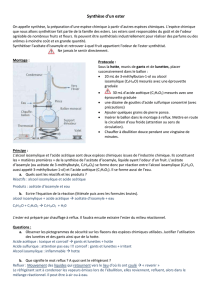
Exercice 1 : Synthèse.
1. Le montage 1 est un montage à reflux car celui-ci permet de chauffer le mélange réactionnel (pour
accélérer la réaction) et cela sans perte de matière. Les réactifs sous forme gazeuse sont liquéfiés
dans le réfrigérant à boules et retournent dans le ballon où ils sont à nouveau vaporisés.
2. Les réactifs sont : l'alcool isoamylique et l'acide acétique. Les produits sont : l'acétate d’isoamyle
et l’eau.
3. alcool isoamylique + acide acétique acétate d’isoamyle + eau
4.
4.1. Au vu des données du tableau, l'acétate d’isoamyle formé et l'alcool
isoamylique n'étant pas solubles dans l'eau vont former une
deuxième phase (phase organique). L'acide acétique qui n'a pas réagi
sera dans la phase aqueuse (phase supérieure) puisqu'il est très
soluble dans l'eau.
4.2. L'acétate d’isoamyle formé et l'alcool isoamylique n'étant pas
solubles dans l'eau vont former une deuxième phase (phase
organique) et puisque leur densité est inférieure à celle de l'eau
salée, ce sera la phase supérieure.
5. Par définition :
acétate eau acétate
m
Vd
4,35
1,00 0,87
V
5,0V mL
6. La température d’ébullition du produit synthétisé correspond à celle de l’acétate d’isoamyle donc le
produit synthétisé est de l’acétate d’isoamyle pur.
Exercice 2 : Autour du mercure
Le mercure est un métal gris et liquide caractérisé par le symbole Hg et Z=80.
1. Z est le numéro atomique. Il représente le nombre de protons présents dans le noyau.
2. A représente le nombre de nucléons
3. La représentation du noyau de cet atome est
Hg
200
80
.
4. Cet atome est composé de 80 protons, 120 neutrons et 80 électrons car il y a autant
de protons que d’électrons dans un atome pour assurer l’électro neutralité de celui-ci.
5. Charge Q du noyau de cet atome :
Q=Z.e = 801,6. 10-19 C = 1,3. 10-17 C
6. Masse approchée m d’un atome de mercure de formule
Hg
200
80
est égale à la masse de
son noyau car la masse des électrons est négligeable devant celle des nucléons.
m = 120. mn+80 mp = 2001,7.10 -27 kg = 3,4.10 -25 kg
7. Volume en m3 de cet atome :
10 3
3
4 4 (1,50.10 )
33
Vr
= 1,41.10-29 m3
8. Un noyau est 105 fois plus petit que l’atome donc l’ordre de grandeur du rayon du
noyau d’un atome de mercure est : 10-10/105=10-15m
Ampoule à
décanter
Phase
aqueuse :
Eau + acide
acétique
Phase
organique :
l'acétate
d’isoamyle
+l'alcool
isoamylique

Exercice 3 : Réfraction.
1. Voir schéma.
2. La lumière se propage rectilignement dans un milieu homogène et transparent.
3. Dans le triangle OPM :
cos
3,0 cos60 1,5
OP PM
OP m
4. Par définition :
PM
tc
8
3,0
3,00.10
t
Δt=1,0.10-8 s
5. Le rayon lumineux est dévié; c’est le phénomène de la réfraction.
6. On mesure i = 30°
7. D’après la deuxième loi de Descartes, on a :
neau x sin i = nair x sin r
eau
n sin i
sin r =
air
n
1,33 sin 30
sin r = 1,00
donc r = 42°
1
/
2
100%