docx

Page 1 sur 2
Synthèse d’espèces chimiques
I) NECESSITE DE LA SYNTHESE
II) LES ETAPES DE LA SYNTHESE
1) La transformation chimique
2) L’extraction de l’espèce synthétisée
3) La caractérisation de l’espèce synthétisée
4) Calcul du rendement de la synthèse
III) UN EXEMPLE DE SYNTHESE : SYNTHESE D’UN AROME DE BANANE
1) Présentation
2) Les réactifs de la synthèse.
Dans un ballon on introduit les réactifs suivants :
10 mL d’alcool isoamylique, 30 mL d’acide acétique pur
Puis quelques gouttes d’acide sulfurique concentré. (ou de l’acide paratoluènesulfonique)
Données :
Espèce chimique
Masse molaire en g/mol
Solubilité dans l’eau salée
densité
Acide acétique (C2H4O2 )
60
bonne
1,05
Alcool isoamylique (C5H12O )
88
Très faible
0,81
Acétate d’isoamyle (C7H14O2)
130
Très faible
0,87
3) La réaction chimique
Ecrire l’équation de la synthèse à l’aide des données ci-dessus sachant que l’autre produit de la synthèse est l’eau.
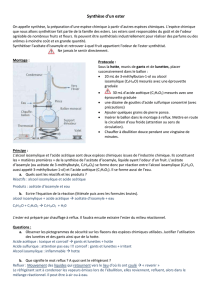
4) Le dispositif expérimental
On adapte au ballon contenant les réactifs ci-dessus un réfrigérant à eau.
Après la mise en route de la circulation d’eau on chauffe à reflux pendant environ 20 min.
Questions :
1) Légender le schéma ci-contre.
2) Quel est le rôle du chauffage ?
3) Que se passerait-il si le réfrigérant à eau n’existait pas ?
4) En déduire le rôle du chauffage à reflux.
5) Quel est le rôle de l’acide sulfurique.
6) Calculer les nombres initiaux de réactifs. En déduire le
réactif limitant et le réactif en excès.

Page 2 sur 2
5) Récupération de l’arome
a) Relargage
Après refroidissement du ballon on verse son contenu dans un verre à pied contenant de l’eau salée glacée.
b) Extraction
Puis on transvase le contenu du verre à pied dans une ampoule à décanter.
Préciser où est la phase aqueuse et la phase organique.
c) Séparation des deux phases liquide.
6) Identification par chromatographie
1) A l’aide du chromatogramme ci-dessus déterminer les espèces chimiques présentes dans la phase
organique.
2) L’essence de banane constitue-t-elle une espèce chimique ?
3) L’acétate d’isoamyle est-il une espèce chimique naturelle ?
4) L’acétate d’isoamyle est-il une espèce chimique identique à une espèce chimique naturelle ?
5) L’acétate d’isoamyle est-il une espèce chimique artificielle ?
7) Calcul du rendement de la synthèse
1) Combien aurait-on obtenu de mole d’acétate d’isoamyle si le rendement de la synthèse était de 100% ?
Aider vous si besoin d’un tableau d’avancement.
2) On a obtenu expérimentalement une masse d’acétate d’isoamyle de 9 ,2 g. En déduire le rendement de cette
synthèse.
1
/
2
100%