P2-UE8-Belmonte-Les_spirochètes (word)

1
UE8 – De l’agent infectieux à l’hôte.
O.Belmonte
Date : 15 avril 2016 Plage horaire : 14h-16h
Promo : P2 2015-2016 Enseignant : Dr O.Belmonte
Ronéistes : Alexandre TESCHER/ Nour GANGATE
Les Spirochètes
I. Généralités
II. Genre Borrelia
1. Généralités
2. Epidémiologie
3. Clinique –Lyme
4. Bactériologie
5. Traitement
6. Prévention
III. Genre Leptospira
1. Généralités
2. Epidémiologie
3. Pouvoir pathogène
4. Caractéristiques bactériologiques
5. Diagnostic
A. Diagnostic direct
B. Diagnostic indirect
6. Traitement
IV. Genre Treponema
1. Généralités
2. Epidémiologie
3. Les différentes phases de la syphilis
A. Phase primaire
B. Phase secondaire
C. Phase tertiaire
4. Cas de la transmission materno-fœtale
5. Caractéristiques bactériologiques
6. Diagnostic
A. Diagnostic direct
B. Diagnostic indirect
C. Diagnostic d’une neurosyphilis
D. Diagnostic d’une syphilis congénitale
7. Traitement
8. Prévention

2
I. Généralités
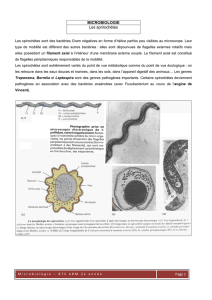
Ces bactéries appartiennent au genre Spirochetaecae
Leur mobilité vue au microscope est assez impressionnante, elles sont d’ailleurs difficiles à observer au
microscope.
Elles possèdent une membrane externe et une PEG. On note la présence d’endoflagelles insérés aux 2
extrémités de la bactérie et enroulés autour du corps bactérien. Cela représente l’organe moteur et donne sa
forme hélicoïdale à la bactérie
Elles sont non-cultivables ou du moins très difficilement cultivables et difficilement colorables.
Globalement, les spirochètes sont difficiles à identifier sur examen direct, et difficiles à faire pousser sur
milieu de culture. On utilisera plutôt des techniques d’analyse moléculaire et parfois sérologie, donc des
techniques d’identifications indirectes.
Les spirochètes sont non visibles en microscopie optique. Ils sont par contre visibles en microscopie à fond
noir (X100) = mobilité +++ (torsion, rotation, compression). Et ils sont non colorable par GRAM (elles
sont gram inopérante) et faiblement par MGG.
Il y a de grandes similitudes entre ces bactéries au niveau
des moyens de transmission et des conséquences
cliniques. Les principaux genres de spirochètes sont :
- Genre Borrelia
- Genre Leptospira (leptospirose)
- Genre Treponema (notamment Treponema
pallidum qui est l’agent de la Syphilis, une MST
qui est actuellement en recrudescence un peu
partout et aussi à La Réunion).
II. Genre Borrelia
1. Généralités
La Borrelia est à l’origine d’infections fréquentes dans l’hémisphère Nord,
car le vecteur de la bactérie y est très présent. Ces infections sont par contre
un peu moins présentes à La Réunion.
Le genre Borrelia appartient à la famille des Spirochaetaceae. Les borrélioses
humaines sont liées à la transmission le plus souvent par des arthropodes qui
vont un jour de manière accidentelle piquer un homme, ce sont des vecteurs
hématophages : qui piquent pour absorber le sang.
Le réservoir est principalement forestier, ou des rongeurs transmettent à des animaux cette bactérie. Il existe
30 espèces dont certaines sont impliquées dans des infections humaines. Celles qui nous intéressent le
plus sont :
Borréliose de Lyme (= Maladie de Lyme) :
C’est une maladie répandue dans l’hémisphère Nord, qui est la zone de répartition du vecteur : les
tiques dures du genre Ixodes. On la surveille quand même ici du fait des voyages des personnes et de la
capacité de transfert de ces vecteurs par différents moyens dans d’autres contrées.
On est donc obligé de l’évoquer à La Réunion. Il faut savoir que des cas de Maladie de Lyme chez des
patients qui n’ont jamais quitté La Réunion n’ont pas encore été diagnostiqués. Les tiques transmettent la
bactérie au cours de leur repas sanguin.

3
En Europe, il y a 3 espèces du complexe Borrelia burgdoferi sensu lato :
- B. burgdoferi sensi stricti
- B. garinii
- B. afzelii
En fonction de la région du monde où l’on
se trouve l’une ou l’autre va prédominer, ou
les trois. Aux USA, seule l’espèce B.
burgdoferi sensu stricto est présente. Les
espèces sont différentes en fonction de la
zone géographie. Et cela a un impact dans
les techniques de recherche de recherche
d’anticorps qui sont plus ou moins
spécifique de certaines espèces, lié à la zone
géographique où la personne a été infecter.
.
Voilà la zone de répartition de la maladie.
On voit qu’elle est assez répandue.
Voilà d’autres types de maladies transmises par d’autres types de Borrelia. « Je ne vous demande pas de
retenir ces autres types de Borrelia, il n’y aura pas de questions à l’examen sur ça »
Fièvres récurrentes :
Ces fièvres récurrentes sont transmises à l’Homme par :
- Poux de corps :
Borrelia recurrentis : fièvre récurrente épidémique cosmopolite.
- Ornothodoros (tiques molles) : diverses espèces de Borrelia : agents des fièvres récurrentes
endémiques Espagne/Portugal, Moyen-Orient, Caucase, Afrique, Amérique, Asie…
On en retrouve surtout sur le pourtour méditerranéen et en Afrique du Nord avec quelques cas décrits dans
d’autres régions.
2. Epidémiologie
Pour l’infection, on a besoin de la bactérie mais aussi d’un réservoir naturel (essentiellement des rongeurs,
mais surtout des animaux des forêts de l’hémisphère Nord) + un vecteur compétent (qui récupère le germe
et va le transmettre à l’homme). L’Homme est un hôte accidentel car ce n’est pas un récepteur indispensable
à la perpétuation du cycle.
Donc, on superpose la distribution de cette pathologie avec la distribution de son vecteur et de son
réservoir.
Caractéristique de cette bactérie : on a une transmission verticale, c’est-à-dire des adultes vers les larves.
La tique va transmettre à ses descendants la bactérie, puis il y aura un transfert possible au réservoir.
Au cours de ce cycle, la tique va récupérer des repas hématogène pour se multiplier et changer de stade.
Lors de ces repas, si elle n’est pas encore porteuse, elle pourra récupérer au sein du réservoir ces bactéries
qu’elle transmettra à un autre hôte. Le transfert de la bactérie peut aussi se faire de façon horizontale.
Maladie de Lyme : C’est l’anthropozoonose bactérienne par piqûre de tique la plus fréquente de
l’hémisphère Nord.
Sa répartition géographique est superposable à celle du vecteur de Borrelia Burgdoferi sensu lato (Bbsl).

4
Bbsl survit et se multiplie dans l’intestin des tiques du genre Ixodes = arthropodes exophiles forestiers.
Il parasite les animaux sauvages vivant en zones boisées, humides et tempérées de l’hémisphère Nord :
o Petits rongeurs = réservoirs majoritaire…
o Mais présent également chez les mammifères de taille moyennes, les oiseaux et grands
mammifères (exemple : cervidés).
Le cycle de la tique. Entre les stades nymphe et adulte, ce vecteur a
besoin d’un repas sanguin. Et puisqu’elle porte la bactérie, elle
l’injecte pendant la piqûre.
On observe l’ordre de taille des tiques. Si l’on exerce en médecine
libérale, il est possible de les voir. Car souvent les tiques restent fixées
au point de piqûre. On peut ainsi estimer le risque potentiel pour
l’individu si on sait les identifier. En fonction de son cycle ce vecteur à
donc besoin de se fixer sur différent hôtes. A un moment il va se
contaminer avec cette bactérie, et la transmettre. L’Homme est un hôte
accidentel terminal.
Incidence : variable entre régions, saisons…
La fréquence est plus importante en Eté. Il y a aussi une variabilité en fonction de la fréquence d’exposition
et des vêtements portés lors de l’exposition. Donc, on trouve forcément plus de cas entre Juillet et Août, car
on a plus de personnes exposées et en plus, le vecteur est dans un période particulière pour son cycle, ce qui
fait que les piqûres sont plus fréquentes. Comme exemple, on retrouve les régions les plus urbaines qui sont
concernés par cette maladie.
Maximum en Europe de l’Est Slovénie : 100 cas / 100 000 habitants.
En France, incidence moyenne = 9.5cas / 100 000 habitants (0 pourtour
méditerranéen ; X10 Nord-Est). L’incidence reste très variable d’un pays
à l’autre. Fréquence plus importante chez les enfants et les adultes après
50 ans. Les zones
Ronéo 2014 :
Fièvres récurrentes épidémiques à poux : (le prof n’en parle pas et passe les diapos)
Elles sont dues à B. recurrentis.
La transmission d’Homme à Homme se fait par piqûre de poux de corps (Pediculus humanus corporis).
Ces fièvres sont associées à des conditions socio-économiques difficiles : SDF, PVD.
On montre qu’il y a différentes conditions qui font qu’on a des facteurs d’expositions plus ou moins
importants.
Fièvres récurrentes endémiques à tiques : (le prof n’en parle pas et passe les diapos)
Ce sont des fièvres non contagieuses transmises à l’Homme par piqûre de tiques molles.
Ces tiques vivent dans les terriers des rongeurs (= réservoirs).
Répartition géographique = celle du vecteur = spécifique (Afrique, Bassin méditerranéen,…)

5
3. Clinique – Lyme
Les infections à spirotèques se développent en plusieurs phases, comme la plus part des autres borrélioses.
La pathologie se décline en 3 phases :
Quelques heures après la piqûre = phase primaire. Il y a une diffusion cutanée, un érythème migrans. C’est
une réaction inflammatoire due la multiplication et à la migration des spirochètes dans la peau autour du
point de piqûre dû à la migration du spirotèque au niveau de la peau. C’est une manifestation clinique
pathognomonique (le diagnostic est normalement posé à la vue de ce type symptôme…). Mais inconstante.
Le délai d’apparition = 2 à 45 jours après piqûre. Ces diffusions cutanées peuvent disparaître spontanément.
On a observé une évolution en cocarde avec une diffusion centrifuge et une taille très variable qui doit faire
évoquer cette pathologie.
Encore une fois, le délai d’apparition est variable. Il faut demander quand est-ce qu’on a été piqué. Si oui,
par quoi ? Est-ce que vous vous êtes promené en forêt ?...
Cette maladie peut être évoquée de manière indirecte si le patient n’évoque pas la piqûre en première
intention.
Il y a néanmoins une inconstance dans la symptomatologie et dans la systématisation de cette
symptomatologie. Ce qui fait qu’il n’y a pas de diagnostic de la maladie, donc pas de traitement. On a alors
une évolution vers d’autres stades de la pathologie avec certaines complications.
L’EM (érythème migrans) évolue de façon centrifuge si absence de traitement pendant plusieurs semaines
ou mois.
- Aspect en cocarde avec centre clair et bords érythémateux nets.
- Taille : possible plusieurs dizaines de cm.
- Indolore, non prugineux (gratte pas).
- Disparition possible spontanée.
A ce stade :
- Traitement = efficace contre les possibles complications (antibiotiques contre spirochètes). On traite
précocement avec des antibiotiques pour limiter les atteintes secondaires, que peut engendre la
bactérie après dissémination dans l’organisme.
- Absence de traitement = 10% de risque de complications par dissémination. Ici il n’y a pas de notion
d’âge ou d’immunocompétence particulière.
Manifestations secondaires :
- Après dissémination systémique par diffusion dans la circulation
- Septicémie très brève (on ne fait pas hémoculture pour recherche cette bactérie) et non/peu
symptomatique.
- Tableaux cliniques non spécifiques et variés (neurologiques, articulaires,…)
Neurologiques : C’est souvent le plus problématique. Et c’est ce qui amène le plus souvent à évoquer la
Maladie de Lyme. On peut l’évoquer en neurologie et dans les pays affectés par la Maladie de Lyme.
- Aigue : méningoradiculite, paralysie faciale ou parésie d’une autre paire crânienne, plus rare
méningite isolée, méningomyélite...
- Chronique : encéphalite persistance, encéphalomyélite, méningoencéphalite…
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
1
/
26
100%