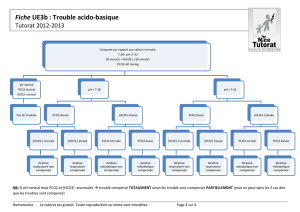
I. Equilibre acido-basique - Cours de DCEM1 2010/2011 à Amiens

Sémiologie désordre électrolytique.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
EQUILIBRE ACIDO-BASIQUE NORMAL, ACIDOSES ET ALCALOSES
I. Equilibre acido-basique
- Acide : substance capable de fourni un ion H+.
- Base : substance capable d’accepter un ion H+.
- L’organisme produit chaque jour une charge d’acide importante :
o Catabolisme protéique : 1mmol/kg/jour de H+.
o Métabolisme mitochondrial : 1500mmol/j CO2 (+H2O = H2CO3).
- Le pH plasmatique est maintenant d’un intervalle précis. Concentration d’H+ est stable :
o 40nmol/L de liquide extracellulaire.
o 100nmol/L de liquide intracellulaire.
- Equation d'Henderson-Hasselbach : pH = 6,1 + log
- Maintien de l'équilibre acido-basique :
o Le rein régule la concentration de HCO3- .
o Le poumon régule la pCO2.
- La concentration d’ions dans le plasma :
o Est très faible : 40nmol/L.
o Est maintenue constante par l’action conjuguée du rein et du poumon (36,8nmol/L <
[H+]plasma artériel < 43,6nmol/L).
- pH = - log [H+].
o Alcalose si pH > 7,42.
o Acidose si pH < 7,38.
- Les ions bicarbonates (HCO3-) constituent le principal tampon du milieu extracellulaire.
- L’hyperventilation alvéolaire entraine :
o Une diminution de la bicarbonatémie.
o Une diminution de la concentration plasmatique de proton (augmentation du pH).
- L’augmentation de la quantité d’acide fixe entraine :
o Une diminution de la bicarbonatémie.
o Une augmentation de la concentration plasmatique de proton (diminution de pH).

Sémiologie désordre électrolytique.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
- La régulation de la balance acide-base est assurée par des systèmes tampons extra et
intracellulaire :
o A court terme : tampons intracellulaire (os minéral et muscle).
o A moyen terme : adaptation ventilatoire (sous forme de CO2) JH+ + HCO3- = H2O + CO2.
o A long terme : adaptation rénale.
o Régénération de HCO3-.
o Elimination de H+.
1. Rôle du poumon
- Seconde ligne de défense d’action rapide.
- Excretion du CO2 produti par le matabolisme cellulaire.
- Réaction à l’acidose par une hyperventilation alvéolaire : diminue la pCO2.
2. Rôle du rein
- Troisième ligne de défense d’action plus lente.
- Maintenir le stock de bicarbonates de l’organisme en réabsorbant les HCO3- filtrés :
o DFG x concentration en bicarbonate plasmatique.
o 80 à 85% dans le tube contourné proximal.
o 10 à 15% dans l’anse de Henlé.
o Réabsorption grâce à une sécrétion active de H+.
- Excréter la charge acide produite quotidienne :
o TCP.
o Tube collecteur :
o Acidité titrable (AT : H2PO4-).
o L’ammoniac (NH4+). L’ammonium peut permettre l’élimination d’une grande
quantité d’H+.
- Mécanismes cellules de réabsorption d’ions bicarbonates et de sécrétions d’ions H+ au niveau du
TCP :
o Dans la lumière tubulaire : H+ + HCO3- H2CO3.
o H2CO3 H2O + CO2 grâce à l’anhydrase carbonique. CO2 et H2O diffuse librement pour
rentré dans la cellule
o Dans la cellule H2CO3 redonne H+ et HCO3- toujours grâce à l’anhydrase carbonique.
o HCO3- passe dans le plasma : symport avec sodium.
o H+ repasse dans l’urine :
o Antiport avec sodium.
o ATPase vacuolaire.
- La réabsorption du taux de bicarbonates :
o Il existe un taux de réabsorption maximum de bicarbonates. Au-delà de 27mmol/L, la
réabsorption est saturée et le surplus passe dans l’urine.
o De façon physiologique, on ne retrouve pas de bicarbonates dans les urines. Cependant
si le taux plasmatique dépasse 27mmol/L alors le rein excrète des bicarbonates dans
l’urine.
- La réabsorption des bicarbonates augmente si (++QE) :
o Le volume extracellulaire baisse (hypovolémie : alcalose de contraction).

Sémiologie désordre électrolytique.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
o La pression partielle artérielle de CO2 (PaCO2) augmente.
o Hypokaliémie.
- La réabsorption de bicarbonates diminue si (++QE):
o Le volume extracellulaire augmente.
o La pression partielle artérielle de CO2 (PaCO2) diminue.
- Excrétion nette d’acide : [H+]u = [AT]u + [NH4+]u + [HCO3-]u
II. Approche clinique des désordres acido-basiques
- Acidose : diminution du pH plasmatique (acidémie) (<7,38).
- Alcalose : augmentation du pH plasmatique (>7,42).
- Gazométrie artérielle (valeur à retenir) :
o pH = 7,4 ± 0,02.
o pCO2 = 40mm/Hg.
o HCO3 = 25 ± 2mmol/L.
o pO2 = 80 à 100mm.Hg.
o SaO2 = 95 à 99%.
- Pour interpréter un désordre acido-basique il faut également connaitre sur l’ionogramme
plasmatique :
o Kaliémie = 3,5 à 5 mmol/L.
o Trou anionique : différence entre cations et anions dosés donc correspond aux anions
indosés (utiliser dans désordres métaboliques).
o TA = [Na+ + K+] – [Cl- + HCO3-] = 16 ± 5mmol/L. A utiliser
o TA = [Na+] – [CL- + CHO3-] = 12 ± 4mmol/L. A ne pas utiliser.
- Examens urinaires :
o pHurinaire.
o Bicarbonaturie = 0 physiologiquement
o TA urinaire = [Na+ + K+] – [Cl- + CHO3-] = 30mmol/L (mesuré uniquement dans des
troubles urinaires complexes).
o pCO2 urinaire.
pH
H+
HCO3-
pCO2
Acidose métabolique
↘
↗
↘
↘
Alcalose métabolique
↗
↘
↗
↗
Acidose respiratoire
↘
↗
↗
↗
Alcalose respiratoire
↗
↗
↘
↘
III. Diagnostic d’un désordre acido-basique
- Réponses compensatoires rénales ou respiratoires.
- En cas d’acidose métabolique simple la compensation peut être prédite : ∆pCO2 = ∆[HCO3-] x 1,2.

Sémiologie désordre électrolytique.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
1. Acidose métabolique
a. Physiopathologie
- Charge acide excessive d’origine exogène ou endogène.
- Pete excessive de bicarbonates.
- Défaut d’excrétion rénale d’acide.
- Dilution brutale du compartiment extracellulaire.
b. Diagnostic biologique
- pH < 7,38.
- [HCO3-] < 22mmol/L.
- pCO2 < 36mmHg.
- Hyperkaliémie souvent.
- Compensation : pH tend vers la normal.
c. Cliniquement
- Hyperventilation alvéolaire voir détresse respiratoire.
- Dyspnée profonde et ample dite de Kussmaul.
- Obnubilation ou coma.
- Collapsus cardiovasculaires (baisse de tension) si acidose sévère ou bas débit cardiaque.
d. Diagnostic étiologique : calcul du trou anionique sanguin
- Accumulation d’acide : TA élévé (>16mmol/L)
- Perte de bicarbonates : TA normal (<16mmol/L)
- Accumulation d’acide dont l’anion est chlore : TA normal.
Trou anionique élevé (>16mmol/L)
Surproduction organiques
- Les acides lactiques (>2mmol/L) :
o Hypoxie tissulaire (état de choc).
o Intoxication du CO2.
o Médicaments et toxique : éthanol, méthanol, biguanide, salicylés, isoniazide, etc.
o Diabète sucré, insufisance hépatocellulaire, cancers.
o Héréditaires, déficits en : glucose-6-phosphate, fructose-1-diphosphate, pyruvate
carboxylase.
- Les céto-acidoses (acides acéto-acétique/β-hydroxybatyrique).
o Diabétique, éthylique, de jeûne.
o Anomalies du métabolisme du glycogène.
- Les intoxications (anions autres que le chlore) : salicylés, éthylène-glycol, méthanol, paraldéhyde.
- Les rhabdomyolyses massives.
Les insuffisances rénales
- Aigues.
- Chronique au stade terminal.
- Il y a souvent rétention de beaucoup d’anions qui augmente le trou anionique.

Sémiologie désordre électrolytique.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
Les acidoses métaboliques à trou anionique inchangé (<16mmol/L)
- Les pertes digestives de bicarbonates : la diarrhée.
- Les acidoses tubulaires rénales : excrétion urinaire insuffisance de NH4+.
o Acidose tubulaire proximale, type II (défaut de réabsorption proximale de HCO3).
o Acidose tubulaire distale, type I (défaut excrétion ions H+ ou défaut de NH3 médullaire).
o Acidose tubulaire médullaire de type IV.
- Les intoxications (anion = chlore).
- A part :
o Les acidoses de dilution.
o Les inhibiteurs de l’anhydrase carbonique (Diamox).
SCHEMA PROF
2. Alcalose métabolique
a. Physiopathologie
- Elevation du taux de HCO3- plasmatique :
o Perte accrue d’ions H+ (tube digestif ou rénale).
o Apport excessif de HCO3-.
o Déshydratation extracellulaire.
- Baisse de l’excrétion de HCO3- par le rein.
b. Diagnostic biologique
- pH > 7,42.
- [HCO3-] > 26mmol/L.
- pCO2 > 44mmHg.
- Hypokaliémie.
- Compensation : pH normal.
c. Cliniquement
- Hypoventilation alvéolaire;
- Céphalées, somnolence, syndrome confusionnel.
- Crampes musculaires, tétanie, faiblesse musculaire.
- Obnubilation, coma, convulsions.
- Troubles du rythme.
d. Diagnostic étiologique
- Volume du secteur extracellulaire.
- Chlorurie.
Causes
- Excès d’apport en bicarbonates :
o Syndrome des buveurs de lait.
o Apport exagéré de bicarbonates ou de ses précurseurs.
o Anticacides associées à des résines échangeuses de cations de cations.
o Rebond après une acidose métabolique.
- Les alcaloses sensibles au chlore + déshydratation extracellulaire, chlorurie < 20mmol/L :
 6
6
 7
7
1
/
7
100%