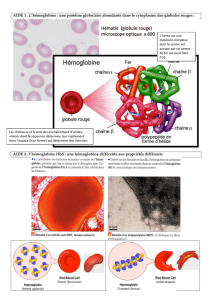
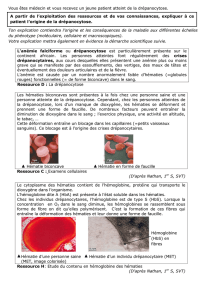
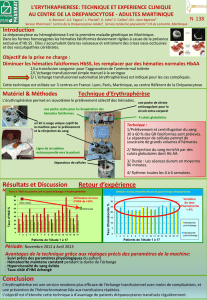
Disfonctionnement de l`hémoglobine S

URL source du document
www.lucieberger.org/svt
Document
Disfonctionnement de l'hémoglobine S
Différence structurale
entre l'HbS et l'HbA
Structure du polymère
Mécanisme de
polymérisation
Différence structurale entre l'HbS et l'HbA
Comme il a été précisé précédemment,
l'hémoglobine est une supra-molécule
composée de quatre hèmes portés par une
protéine. La formule d'une protéine, c'est à
dire la séquence d'acides aminés dont elle
est composée, est fixée par une séquence
ADN précise de l'organisme auquel elle
appartient. La moindre mutation, entraînant
un faible écart dans la composition de cette
protéine, peut provoquer, par
l'intermédiaire de nouvelles interactions ou
d'une structure tertiaire différente de la
protéine, des pathologies plus ou moins
visibles dans l'organisme. C'est le cas de
l'hémoglobine, qui est la protéine de
structure connue qui présente le plus de
variantes naturelles parfaitement
caractérisées. En effet, les biologistes ont
déjà recensé plus de 500 variétés
d'hémoglobine, dont 95% résultent de la
substitution d'un seul acide aminé. L'HbS est
un de ces mutants. Elle est issue de la

substitution d'un glutamate (Glu) par une
valine (Val) et est à la cause de l'anémie
falciforme
Etant donné la structure 3D complexe
d'une protéine, deux cas doivent être
considérés lors de l'étude de la substitution
d'un acide aminé :
Le changement a lieu à l'intérieur de
la molécule : la seule conséquence est
alors très souvent une déstabilisation
de cette chaîne.
Le changement a lieu à la surface de
la molécule : de nombreux acides
aminés étant similaires ou n'offrant
pas d'interactions fortes, cela n'a
généralement pas de conséquences
notables. Par contre, dans des cas
assez rares, si le nouvel acide aminé
offre un site pouvant présenter un
rôle fonctionnel, les interactions entre
molécules de l'environnement sont
changées, ainsi que leur
comportement. L'hémoglobine HbS
fait partie de cette exception. Le
remplacement de l'acide glutamique
par la valine induit la formation de
polymères de HbS, qui se regroupent
en fibres. Ce sont ces fibres qui
provoquent la déformation des
hématies.
Structure du polymère
Formation de fibres de HbS
Les fibres de polymères de HbS
ont été observées par micrographie
électronique. Celles-ci ont une

structure bien particulière en forme
de bâtonnets :
Schéma d'une fibre :
on distingue l'assemblage de polymères de HbS, chaque
couleur représentant un polymère de HbS et sa structure
caractéristique de double-brin
Image par
microscopie
électronique
d'une fibre d'HbS
Les fibres sont formées de
double-brins de HbS en
interactions(une couleur représente
un polymère dans le schéma
précédent). Cela s'observe bien sur
une "coupe" :
Les HbS interagissent entre
elles. Dans ce cas, sont
représentés en vert les
interactions internes aux
double- brins et en rouge
les interactions entre
polymères différents,
permettant la stabilité de la
fibre.
Fibres de HbS vue en coupe
Les interactions entre deux
polymères de HbS sont faibles mais
ici, elles sont rendues importantes par
leur grand nombre. Ce sont les
interactions internes aux double-brins

qui sont réellement intéressantes et
qui traduisent l'importance de la
présence de la valine hydrophobe à la
surface de la protéine.
Formation d'un polymère de HbS
L'HbS résulte donc de la
substitution en surface d'un
glutamate, très hydrophile, par une
valine, nettement plus hydrophobe :
Dans l'environnement aqueux
de l'organisme l'HbS aura tendance à
minimiser les interactions avec le
milieu. Ainsi, des contacts
intermoléculaires entre molécules
HbS mettant en jeu les valines de
surface, tendront à stabiliser ces
molécules hydrophobes en milieu
aqueux. En effet, sur la déoxyHbS, il
existe un site complémentaire de la
chaîne organique propre à la valine :

Les interactions entre la valine 6 d'un tétramère
et la poche définie par la Phe 85 et la Leu 88
De plus, les positions relatives
de ces deux sites complémentaires sur
une même protéine permettent
aisément la formation de dimère de
déoxyHbS. La structure de ces
dimères a été analysé par
cristallographie. La localisation de ces
interactions stabilisantes entraîne
même la polymérisation des
déoxyHbS sous forme de double-
brins. L'analyse par spectroscopie
UV- Raman a récemment complété
les résultats obtenus par
cristallographie dans ce domaine. Les
schémas suivants montrent comment
cette polymérisation a lieu.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%