Activité introductive à l`évolution temporelle des systèmes

Classe de TS Partie D-Chap 12
Chimie
1
PARTIE D : COMMENT LE
CHIMISTE CONTROLE T-IL LES
TANSFORMATIONS DE LA
MATIERE ?
Chapitre 12 : Les réactions d’estérification et d’hydrolyse
Pré requis :
La chimie organique de 1ère S : notions de groupes caractéristiques, alcool, acide carboxylique
...
Connaissances et savoir-faire exigibles :
(1) Reconnaître dans la formule d’une espèce chimique organique les groupes caractéristiques : – OH,
– CO2H, – CO2R, – CO – O – CO – (Voir chapitre 13).
(2) Écrire l’équation des réactions d’estérification et d’hydrolyse.
(3) À partir de la formule semi-développée d’un ester, retrouver les formules de l’acide carboxylique
et de l’alcool correspondants.
(4) Savoir nommer les esters comportant cinq atomes de carbone au maximum.
(5) Savoir que les réactions d’estérification et d’hydrolyse sont inverses l’une de l’autre et que les
transformations associées à ces réactions sont lentes.
(6) Savoir qu’un catalyseur est une espèce qui augmente la vitesse d’une réaction chimique sans
figurer sans l’équation de la réaction et sans modifier l’état d’équilibre du système.
(7) Savoir que l’excès de l’un des réactifs et/ou l’élimination de l’un des produits déplace l’état
d’équilibre du système dans le sens direct.
Introduction :
Comme le nom de la partie D le confirme, on va travailler sur le contrôle des transformations de a
matière, et pour se faire il est commode de prendre un exemple : ici nous allons nous intéresser à la
formation ou la destruction d’un nouveau type de composé organique : l’ester.
I Un nouveau groupe caractéristique, une nouvelle famille chimique :
Nous avons vu en seconde une molécule particulièrement odorante, que nous avons extrait de la nature et
que l’on a synthétisée : c’était l’acétate de linalyle ou essence de lavandin. Cette molécule est un ester.
1) Définition :
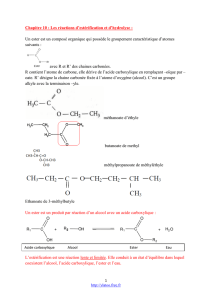
Les esters sont des composés organiques qui possèdent le groupe caractéristique –COO–.
Ils forment des composés du type R-COO-R’ où :
R est soit une chaîne carbonée, soit un hydrogène.
R’ est une chaîne carbonée.
Ces esters sont généralement obtenus par réaction entre un acide et un alcool.
2) Obtention et nomenclature (1), (3) et (4) :
a. Obtention des esters :
Ces esters peuvent être obtenus en laboratoire par réaction entre un acide RCOOH et un alcool
R’OH.
Cette réaction se nomme l’estérification, nous l’étudierons par la suite.

Classe de TS Partie D-Chap 12
Chimie
2
Ceci nous indique que d’après la formule de l’ester, nous pouvons retrouver les acide et alcool
qui ont servis à sa préparation :
L’acide fournit le groupe R, relié au carbone qui porte les deux oxygène.
L’alcool fournit le groupe R’, relié à l’oxygène simplement lié avec le carbone
b. Nomenclature :
Nous allons donc utiliser les noms des acide et alcool pour composer le nom de l’ester :
Nous commencerons par nommer l’acide (R) en lui ajoutant la terminaison « –ate ».
On ajoutera la particule « de ».
On finira par nommer l’alcool (R’) en lui ajoutant la terminaison « -yle ».
Ex :
L’acétate de linalyle est un ester obtenu en laboratoire par réaction entre l’acide acétique (éthanoïque) et
le linalol.
c. Applications :
Donner la formule semi-développée du méthanoate d’éthyle et les réactifs utilisés pour l’obtenir en
laboratoire.
Donner le nom et la formule semi-développée de l’ester obtenu par réaction entre l’acide 2-
méthylpropanoïque et le 1-méthylpropan-2-ol.
II La réaction d’estérification :
1) Mise en évidence expérimentale :
a. Expérience :
b. Observations :
On obtient au bout d’une dizaine de minutes un liquide non miscible à la solution de sulfate de cuivre
qui présente une odeur fruitée.
c. Interprétations :
Alors que le mélange réactionnel initial est soluble dans l’eau, en fin de manipulation, on obtient un
produit non miscible : il y a bien eu réaction.
((De plus, on peut relever le pH au début de la manipulation et à la fin pour voir que celui-ci à
augmenter, signe de la disparition de l’espèce acide.)) à tester.
L’odeur fruitée nous renseigne sur la nature du produit obtenu, il s’agit bien d’un ester.
2) Caractéristiques de cette réaction :
a. La réaction est lente (l’odeur de fruit ne se ressent pas instantanément dés le mélange des
réactifs), c’est pourquoi nous avons chauffer le mélange et ajouter un catalyseur.
80°C
Chauffer à 80°C pendant 10 minutes
Réfrigérant à air
Agitateur magnétique
chauffant
Verser le contenu de l’erlenmeyer dans un
verre pied contenant une solution de
sulfate de cuivre
10 mL d’acide éthanoïque
10 mL de butan-2-ol
Quelques gouttes d’acide sulfurique

Classe de TS Partie D-Chap 12
Chimie
3
Exercices n°12,14,19
et 22 p 260/261
b. Cette réaction est limitée, il n’y a donc pas de réactif limitant. On peut montrer qu’en
partant d’un mélange équimolaire de réactifs, on obtient 60% de la quantité d’ester que l’on
aurait obtenu si la réaction était totale. Ceci étant vrai quelque soit la durée de la transformation.
Attention, le rendement est différent selon la classe de l’alcool utilisé en réactif : On a 67% de
rendement avec un primaire alors que l’on n’a que 5% pour un alcool tertiaire.
c. Ainsi on peut définir la notion de rendement de cette réaction :
C’est le rapport entre le nombre de moles d’ester effectivement obtenu par le nombre de
moles d’ester que l’on aurait obtenu si la réaction avait été totale.
totaleréactionester
obtenuester
n
n
3) Equation de la réaction modélisant la transformation (2):
R-COOH + R’-OH
R-COO-R’ + H2O
La flèche permet juste d’indiquer qu’au départ,on met en présence l’acide et l’alcool pour réaliser
l’estérification
III La réaction d’hydrolyse :
1) Mise en évidence expérimentale :
a. Expérience :
b. Observation :
Le pH en fin de manipulation a diminué.
c. Interprétations :
Ceci traduit l’apparition d’un acide ce qui prouve qu’il y a bien eu réaction entre l’eau et l’ester.
2) Caractéristiques de cette réaction :
a. La diminution de l’acidité ne se fait pas fait instantanément, ce qui prouve que la réaction est
lente. C’est pour ça que la réaction de fait avec un montage de chauffage à reflux.
b. Cette réaction est limitée, quand on part d’un mélange équimolaire d’ester et d’eau, on obtient
environ en acide le 1/3 de la quantité d’acide qu’on obtiendrait si la réaction était totale.
Le rendement de cette réaction est de 33% pour un ester issu d’un alcool primaire, mais varie
selon la classe de l’alcool. Il passe à 40% pour un ester issu d’alcool secondaire et à 95% pour un
ester issu d’alcool tertiaire.
10 mL d’eau distillée
10 mL d’éthanoate d’éthyle
Eau froide
Mesurer le pH ; après avoir agité les réactifs
fortement.
Chauffer à reflux pendant 1 heure.
Après refroidissement, mesurer le pH

Classe de TS Partie D-Chap 12
Chimie
4
3) Equation de la réaction modélisant la transformation (2) :
R-COO-R’ + H2O
R-COOH + R’-OH
IV Etat d’équilibre concernant les réactions d’estérification et d’hydrolyse : Fiche élève
1) Etude expérimentale :
a. Principe :
Pour étudier cet équilibre, on va suivre l’évolution de mélanges équimolaires, d’acide éthanoïque et
d’éthanol d’une part, et d’éthanoate d’éthyle et d’eau d’autre part. Marcellin Berthelot et Péan de saint
Gilles ont réalisé ces études en procédant comme suit :
On enferme les différents mélanges dans des ampoules scellées.
On les place dans un même milieu, par exemple à une température de 100°C, à une date précise
choisie comme étant t = 0.
On sort alors une ampoule à la date à laquelle on veut connaître l’état du système et on détermine la
quantité de matière d’acide restant ou formée par titrage.
Ainsi, on peut connaître l’état du système à l’aide des tableaux d’avancement :
Equation de la réaction
d’estérification
R-COOH + R’-OH
R-COO-R’ + H2O
Etat
Avancemen
t (mol)
Initial
0
n
n
0
0
En cours
x
n - x
n - x
x
x
Etat d’équilibre
xéq
n - xéq
n - xéq
xéq
xéq
La quantité de matière d’acide à l’équilibre est na = n - xéq, on obtient
donc xéq et les autres quantités de matière des réactifs et/ou des produits.
En effectuant le même travail sur le tableau d’avancement relatif à
l’hydrolyse, on comprend que nous obtiendrons l’avancement de la réaction
directement avec la quantité de matière d’acide dans l’état d’équilibre.
b. Résultats :
Si nous traçons la courbe, pour les réactions d’estérification et d’hydrolyse, de
la quantité de matière d’ester présente dans le milieu en fonction du
temps, Nous obtenons la courbe ci-contre (en partant de mélanges
équimolaires contenant une mole de chaque réactif) :
c. Conclusion :
Ces courbes ont été obtenues pour un temps de
réaction de 200 heures environ, ce qui prouve une
nouvelle fois la lenteur des deux réactions.
Nous voyons aussi que les deux réactions
admettent une limite : il y a toujours 67%
d’ester dans le milieu à l’état d’équilibre. On
peut schématiser cela de la façon suivante :
Fin fiche élève

Classe de TS Partie D-Chap 12
Chimie
5
2) Equation de l’état d’équilibre et constante d’équilibre (5) :
D’après les équations écrites en II3) et III3) et les résultats expérimentaux, on voit que les deux
réactions d’estérification et d’hydrolyse, toutes deux lentes, sont inverses et se limitent l’une
l’autre.
Elles conduisent toutes les deux vers le même état d’équilibre, atteint quand la réaction directe et la
réaction inverse s’effectuent à la même vitesse.
On écrit cet état d’équilibre de la manière suivante :
R-COOH + R’-OH = R-COO-R’ + H2O
Et, par exemple pour la réaction d’estérification, la constante d’équilibre s’écrit :
K = Qr,éq =
alcoolacide
eauester nn nn
Remarques :
On rappelle qu’un quotient de réaction s’écrit avec des concentrations, mais qu’ici, le volume du
mélange réactionnel est V et les concentration des différentes espèces s’écrivent ni/V. Ainsi le
volume disparaît.
La grande différence avec ce que nous avons vu jusqu’à maintenant, c’est que nous ne sommes
plus en solution aqueuse : l’eau n’est plus en excès et devient un réactif ou un produit à part
entière.
Sa quantité de matière apparaît donc dans la constante d’équilibre. Fin fiche élève
V Comment contrôler les réactions d’estérification est d’hydrolyse ?
1) Contrôle de la vitesse (6) :
Vu que ces réactions sont lentes, il est intéressant industriellement de pouvoir augmenter leur
vitesse. Pour cela nous pouvons jouer sur deux paramètres :
Comme nous l’avons vu dans le chapitre 3, augmenter la température du système permet
généralement d’augmenter la vitesse des réactions qui y ont lieu.
Nous pouvons aussi ajouter une espèce dans le milieu, qui ne va pas intervenir dans la
réaction (elle n’apparaît pas dans l’équation de la réaction) mais qui a pour but d’augmenter
la vitesse de celle-ci : une telle espèce s’appelle un catalyseur.
Ex : les ions H+ apportés par l’acide sulfurique catalysent la réaction d’estérification (voir II.1.)
mais aussi celle d’hydrolyse.
Attention, ces deux paramètres ne permettent de contrôler que cinétiquement les réactions, elles
n’ont aucune influence sur la constante d’équilibre de la réaction donc sur le taux d’avancement
à l’équilibre.
Remarques :
Nous pouvons le comprendre pour ce qui est du catalyseur, mais pour la température, celle-ci a
théoriquement une influence sur K. Et même nous avons dit dans le chapitre 6 que K ne dépendait que de
la température.
Ceci est une particularité des réactions d’estérification et d’hydrolyse qui sont athermiques, c’est à
dire qui ne dégagent ni n’absorbent pas de chaleur : alors leur K ne dépend que très peu de la
température.
 6
6
 7
7
1
/
7
100%