Document

Chimie Chapitre 9
Squelettes carbonés et groupes caractéristiques
Le squelette (ou chaîne) carboné(e) désigne l’enchaînement des atomes de carbone constituant
une molécule organique.
On appelle chaîne linéaire d’une molécule la partie non ramifiée de son squelette carboné.
Règles de nomenclature. Le nom du composé est déterminé par le nombre d’atomes de carbone de la
chaîne linéaire la plus longue.
Nombre d’atomes
de carbone
1
2
3
4
5
6
7
8
9
10
Préfixe
méth..
éth..
prop..
but..
pent..
hex..
hept..
oct..
non..
déc..
La position d’une ramification est en général indiquée par un numéro. Il n’est cependant pas
nécessaire de la préciser s’il n’y a aucun doute possible concernant le nom du composé.
1. Chaînes carbonées des hydrocarbures.
1.1. Les alcanes.
Un alcane est un hydrocarbure dont le squelette carboné ne présente que
des simples liaisons : la chaîne carbonée est dite saturée.
On notera la possibilité de libre rotation des groupes autour de la simple
liaison carbone-carbone.
Nomenclature. « Nom du squelette carboné » + suffixe « ane ».
a. Alcanes à chaîne « ouverte », linéaire ou ramifiée.
Compléter le tableau.
Etablir la formule de composition d'un alcane à chaîne ouverte renfermant m atomes de carbone.
CmH
Les alcanes sont utilisés comme combustibles et carburants. Le méthane est le gaz naturel utilisé
par beaucoup d’entre nous.
b. Alcanes cycliques, ou cyclanes.
L’exemple le plus fréquemment rencontré est le cyclohexane C6H12.
Leur formule de composition est donc CmH2m.
Le cyclohexane est un solvant organique.
1.2. Les alcènes.
Les alcènes sont des cas particuliers de composés éthyléniques, composés dont
la chaîne carbonée ouverte possède au moins une double liaison carbone-
carbone. La chaîne carbonée est dite insaturée.
Un alcène est un hydrocarbure éthylénique présentant une seule double liaison.
Les alcènes sont à la base de nombreuses synthèses organiques.
Nomenclature. « Nom du squelette carboné » + suffixe « ène ».
La diastéréoisomérie (isomérie Z/E) est liée à la difficulté de libre rotation des groupes autour
de la double liaison carbone-carbone.
Z = zusammen (ensemble), E = entgegen (à travers)
Compléter le tableau.
Expliquer pourquoi le but-2-ène présente l’isomérie Z/E mais pas le but-1-ène.
C
C
120°
C
109°

Chimie Chapitre 9
Etablir la formule de composition d'un alcène à chaîne ouverte renfermant m atomes de carbone.
CmH
1.3. Les hydrocarbures aromatiques.
L’hydrocarbure de base est le benzène, dont la chaîne carbonée
cyclique n’est pas saturée. Deux représentations sont utilisées.
Le groupe phényl C6H5 est présent dans les molécules de nombreux arômes et parfums, d’où le
nom de composés aromatiques.
2. Groupes caractéristiques.
On appelle groupe caractéristique tout groupe d’atomes, autres que C et H, conférant aux
molécules des propriétés physiques et chimiques caractéristiques.
A chaque groupe caractéristique est associé une famille de composés organiques.
2.1. Les alcools. R
OH.
Dans une molécule organique, le groupe OH est le groupe hydroxyle.
R représente un groupement carboné. Le carbone fonctionnel est tétragonal.
Nomenclature. « Nom du squelette carboné » + suffixe « ol ».
On trouve l’éthanol dans les boissons alcoolisées.
2.2. Les composés halogénés. R
X
Le groupe caractéristique X est constitué d’un atome d’halogène (colonne 17 de la classification
périodique F, Cl, Br, I)
Nomenclature. Utilisation d’un préfixe (fluoro, chloro, bromo, iodo).
Le dichlorométhane est un bon solvant organique (peintures, vernis).
2.3. les composés carbonylés.
Ils renferment le groupe carbonyle . On distingue les cétones et les aldéhydes.
a. Les cétones.
L’atome de carbone fonctionnel est impérativement lié à 2 atomes de
carbone : R et R’ sont donc des groupements carbonés.
Nomenclature. « Nom du squelette carboné » + suffixe « one ».
La propanone ou acétone est un bon solvant organique.
b. Les aldéhydes.
Dans une molécule d’aldéhyde, le carbone fonctionnel du groupement
carbonyle CO porte un atome d’hydrogène, ce qui lui confère des
propriétés différentes d’une cétone.
Nomenclature. « Nom du squelette carboné » + suffixe « al ».
L’éthanal a l’odeur caractéristique de pomme pourrie où il est présent.
2.5. Les acides carboxyliques
Nomenclature. Acide + « nom du squelette carboné » + suffixe « oïque ».
L’acide éthanoïque est un des constituants essentiels du
vinaigre.
2.6. Les amines.
Les amines sont très présentes dans le domaine biologique.
C
O
H
C
O
R
R’
C
O
O H
O
C
H
N
C
O

Chimie Chapitre 9
Groupe
caractéris-
-tique
Environnement
géométrique du
carbone fonctionnel
Nombre
d’atomes de
carbone
Nombre
d’isomères
Formule
semi-
développée
Nom
Représentation
spatiale de la
molécule
Ecriture
topologique
Formule de
composition
Alcanes à chaîne
ouverte
1
2
3
4
2
x
x
x
x
x
x
x
x
x
le 2,2,4-
triméthylpentane
x
x
x
x
x
x
x
x
Alcanes cycliques
x
cyclohexane
x
x
Alcènes
(1 ?)
2
3
4
3
x
x
x
x
x
x
x
x
x
x
x
x
Hydrocarbures
aromatiques
C6H5-CH3
benzène
toluène
x
x
x
x
Alcools
1
2
3
4
2
3
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
x
Composés
halogénés
x
x
x
1,2-dichloroéthane
x
CH3Cl
CH2Cl2
x
Cétones
(1 ?)
2
3
4
x
x
x
x
x
x
x
x
x
Aldéhydes
1
x
x
x
x
l’éthanal
le butanal
x
x
x
x
x
Acides
carboxyliques
1
2
x
x
x
x
x
l’acide butanoïque
x
Amines
x
x
la méthylamine
l’éthylamine
x


Chimie Chapitre 9
Exercices.
1er exercice.
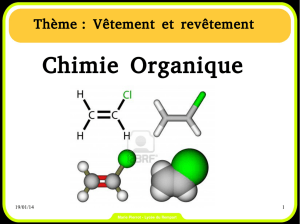
Ci-dessus sont représentées quelques molécules de la vie courante.
1. Donner pour chacune d’elles une formule semi-développée permettant de faire ressortir les
groupes caractéristiques.
2. Entourer et nommer les groupes caractéristiques.
3. Parmi ces composés, lesquels présentent l’isomérie Z-E ? Pour chacun d’eux, effectuer la
représentation des deux diastéréoisomères.
2ème exercice.
Un composé organique oxygéné CxHyOz a la composition centésimale massique suivante.
Carbone : 64,9% Hydrogène : 13,5%. Sa masse molaire est M = 74 g.mol-1.
1. Déterminer x, y et z.
2. Donner les formules semi-développées possibles, les écritures topologiques et les noms
correspondants.
3ème exercice.
La combustion complète d’une quantité de matière n d’hydrocarbure CmHp conduit à la formation de
6,0 dm3 de dioxyde de carbone gazeux et de 5,4 g d’eau liquide.
Le volume molaire des gaz dans les conditions de l’expérience est 24 dm3.mol-1.
1. Calculer les quantités de matière nCO2 et nH2O de dioxyde de carbone et d’eau formés.
2. Ecrire l’équation de la réaction de combustion.
3. Dresser un tableau d’avancement de la réaction.
4. En déduire la valeur du rapport
m
p
.
5. La masse molaire du composé est M = 72 g.mol-1. En déduire la formule de composition de
l’hydrocarbure.
6. Donner les formules semi-développées, les écritures topologiques et les noms des isomères
possibles.
OH
CH3
CH
COOH
acide lactique
CH2OHCHOHCHOHCHOHCHOHCHO
glucose
CO2H
CH3
CH
CO
(CH2)5
CH
« gelée royale », produite par la reine des abeilles
OH
CH3
CH
CH
CH3
C
CH2
C
CH3
CH2
linalol (essence de muguet)
COOH
C6H5
CH
CH
CH2
COOCH3
NH
CO
CH2
NH2
aspartame
CH3CONH OH
paracétamol
1
/
5
100%