Extraction par solvant et coefficient de partage

A10. Activité – Coefficient de partage et extraction par solvant
Ce document donne des informations théoriques explicitant la technique d’extraction liquide-liquide
(première partie). Il prend appui sur des activités expérimentales :
- une manipulation déjà proposée dans l’enseignement de spécialité du programme de 1995
(accessible dans les ouvrages scolaires, chapitre arômes, colorants et conservateurs).
L’objectif est maintenant de déterminer le coefficient de partage de l’acide benzoïque entre
l’eau et l’éther diéthylique (solvant non miscible à l’eau). L’acide benzoïque est titré en
solution aqueuse en présence d’un indicateur de fin de réaction ;
- une manipulation (deuxième partie) : Détermination du coefficient de partage du diiode entre
l’eau et un solvant organique non miscible à l’eau (manipulation introduite en classe de
seconde par le TP2 - miscibilité, solubilité, densité, page 20 du document
d’accompagnement). Les objectifs de cette manipulation sont larges puisqu’on se propose de
déterminer le coefficient de partage du diiode entre l’eau et le cyclohexane et que l’on explicite
le comportement du diiode, en solution aqueuse, en présence d’ions iodure. La constante de
formation du complexe triiodure peut alors être déterminée
Première partie : technique d’extraction liquide-liquide
Objectifs
Expliquer le principe de l’extraction liquide-liquide.
Montrer que l’efficacité d’une extraction est accrue si l’on effectue deux extractions avec deux fois
un volume donné plutôt qu’une seule extraction avec le même volume total.
Présentation du coefficient de partage
L’extraction liquide-liquide consiste à faire passer une espèce chimique d’un solvant duquel il est
souvent difficile de l’extraire, à un autre, dont elle est facilement isolable (solvant volatil, appelé
solvant d’extraction, éliminé par distillation ou par passage à l’évaporateur rotatif). Les deux solvants
ne doivent pas être miscibles entre eux. Le solvant d’extraction est choisi de telle sorte que l’espèce à
extraire y soit beaucoup plus soluble que dans le solvant initial.
Cette extraction correspond à la transformation suivante :
EI
EF
Espèce E : n0
Solvant 1, V1
Espèce E : n1 = n0 - x
Solvant 1, V1
Solvant 2, V2
Espèce E : n2 = x
Solvant 2, V2
Elle est modélisée par la réaction d’équation : Esolvant1 = Esolvant2
à laquelle est associée une constante d’équilibre, K, appelée coefficient de partage.
éq.solvant2
éq.solvant1
[E]
=[E]
K
Il s’agit de montrer que l’efficacité d’une extraction dépend de la constante d’équilibre, K, et du
fractionnement des extractions (nombre d’extractions réalisées pour un même volume de solvant
d’extraction).
Le rendement d’extraction dépend du fractionnement
Extraction d’une espèce contenue dans un volume V1 de solvant 1, à l’aide d’un volume V2 de solvant
2, en une seule opération
Esolvant1 = Esolvant2
État initial
n0
0
Au cours de la transformation
n0 - x
x
État d’équilibre final
n0 - xéq.
xéq.

À l’équilibre
éq.
éq.solvant2 2
r,éq.
0 éq.
éq.solvant1
1
[E]
= = =
( - )
[E]
x
V
QK
nx
V
d’où xéq. (V1 + K.V2) = K.n0.V2
02
éq. 12
..
=+.
n KV
xV KV
Rendement d’extraction
éq. 2
0 1 2
.
r = .
xKV
n V KV
Applications numériques
Premier cas
K = 2
V1 = 20 mL
V2 = 20 mL
r =
2 20 2 67%
20 2 20 3
Deuxième cas
K = 4
V1 = 20 mL
V2 = 20 mL
r =
4 20 4 80%
20 4 20 5
Conclusion
D’après les applications numériques, plus la constante d’équilibre K est grande, meilleure est
l’extraction. Un solvant d’extraction est un solvant dans lequel l’espèce chimique à extraire est bien
soluble ce qui implique une constante d’équilibre (coefficient de partage) de valeur élevée.
Extractions successives d’une espèce contenue dans un volume V1 de solvant 1 à l’aide de deux
volumes
2
2
V
de solvant 2 (fractionnement des extractions)
Première extraction
K = 2
n0 = 5.10-1 mol
V1 = 20 mL
2
2
V
= 10 mL
Esolvant1 = Esolvant2
État initial
n0 = 5.10-1 mol
0
Au cours de la transformation
n0 - x1
x1
État d’équilibre final
n0 - x1éq.
x1éq.
À l’équilibre
1éq.
r,éq. -1 1éq.
10
= = 2
5.10 -
20
x
Qx
1
1éq. 5.10 .2.10
= 0,25 mol
20+2.10
x
1
0 1éq.
- =5.10 0,25 0,25 molnx

r1 =
1éq.
050%
xn
Deuxième extraction
2
2
V
= 10 mL
Esolvant1 = Esolvant2
État initial
n0 - x1éq. = 0,25 mol
0
Au cours de la transformation
n0-x1éq. - x2
x2
État d’équilibre final
n0-x1éq. - x2éq.
x2éq.
A l‘équilibre
2éq.
2éq.
r,éq.
0 1éq. 2éq. 0 1éq. 2éq.
2.
10
= = = 2
( - )- ( - )-
20
xx
Qn x x n x x
x2éq. = 0,125 mol
Rendement d’extraction
r =
éq. 1éq. 2éq.
00
0,25 0,125 75%
0,5
xxx
nn
Conclusion
Ainsi, pour un même volume de solvant d’extraction (V2 = 20 mL), il est préférable de fractionner les
extractions et donc de réaliser deux extractions successives avec chaque fois 10 mL de solvant. Le
rendement passe alors de 67 % à 75 % pour une réaction dont la constante d’équilibre est K = 2.
Deuxième partie : détermination du coefficient de partage du diiode
entre l’eau et le cyclohexane (activité expérimentale)
Objectifs
Déterminer le coefficient de partage du diiode entre deux solvants non miscibles, l’eau et le
cyclohexane.
En déduire la constante de formation du complexe triiodure, I
3
.
Cette manipulation suppose que la notion d’équilibre chimique a été étudiée.
Présentation de la démarche
Le diiode, espèce chimique colorée, est peu soluble dans l’eau.
C’est pourquoi on utilise souvent des solutions de diiode dans l’iodure de potassium ; le diiode s’y
dissout en plus grande quantité que dans l’eau en raison de la formation du complexe triiodure, I
3
,
suivant la réaction : I2(aq) + I-(aq) =
3
I
(aq).
Le diode, I2, et l’ion triodure,
3
I
,se titrent de la même façon par les ions thiosulfate
2-
23
SO
, les couples
oxydant/réducteur mis en jeu sont :
I2(aq)/I-(aq)
3
I
(aq)/I-(aq)
2-
46
SO
(aq)/
2-
23
SO
(aq)
Pour déterminer la concentration molaire du diiode en solution dans l’eau, [I2], la démarche proposée
consiste à passer par l’intermédiaire du coefficient de partage du diiode entre deux solvants, l’eau
d’une part et un solvant organique non miscible à l’eau d’autre part, le cyclohexane noté S. Le
coefficient de partage est la constante d’équilibre associée à la réaction : I2(aq) = I2(S)
2
2S,éq.
2H O,éq.
I
= I
K
.

Comme toute constante d’équilibre K n’est fonction que de la température et ne dépend pas en
particulier de la présence d’autres formes de diiode (complexe par exemple) dans l’une ou l’autre
phase.
Les différentes étapes :
- Préparer une solution de diiode dans le cyclohexane de concentration molaire connue, ajouter de
l’eau en quantité connue, agiter. Une partie du diode passe de la phase organique dans la phase
aqueuse. Déterminer par étalonnage la quantité de diiode dissous dans le solvant organique et
par titrage la quantité de diiode dissous dans l’eau.
- Recommencer la même manipulation en remplaçant l’eau par une solution aqueuse d’iodure de
potassium. On dose la quantité de diiode dans le cyclohexane comme précédemment ; le
coefficient de partage permet d’en déduire la concentration molaire de diiode, [I2] dans la phase
aqueuse.
Déterminer ensuite, par titrage de la phase aqueuse, la somme des concentrations en diiode et
en ion triiodure.
Connaissant la concentration molaire apportée [I-]0 de l’iodure de potassium, calculer la
concentration molaire en ions iodure [I-], puis la constante d’équilibre de la réaction de formation
du complexe triiodure.
Protocole
Matériel et produits
Ampoule à décanter 250 mL
Pipettes de 1 mL, 10 mL, 20 mL, 50 mL
Pipette graduée de 5 mL
Fioles jaugées de 50 mL, 200mL
Bechers de 100 mL, 200 mL
Agitateur magnétique et turbulent
Eau distillée
Empois d’amidon ou thiodène
Cyclohexane
Alcool à brûler
Solution de diode dans le cyclohexane de concentration molaire 4,00.10-2 mol.L-1
Iodure de potassium solide
Solution d’iodure de potassium de concentration molaire 1,00.10-1 mol.L-1
Solution de thiosulfate de sodium de concentration molaire 5,00.10-3 mol.L-1
Mode opératoire
1. Expériences préliminaires qualitatives
- Mise en évidence de la solubilisation du diiode dans l’eau en présence d’ions iodure par
formation du complexe triiodure, I
3
, réalisée par l’enseignant
1
:
Un cristal de diode est placé dans un becher, ajouter de l’eau distillée et observer.
Ajouter alors une spatulée d’iodure de potassium, agiter et observer.
L’enseignant conclut et introduit la réaction de formation de l’ion triiodure : I2(aq) + I-(aq) =
3
I
(aq) et la
constante d’équilibre associée à la réaction, nommée constante de formation du complexe triiodure :
-
3 éq.
f-
2 éq.
éq.
[I ]
= I [I ]
K
.
La solution ainsi préparée est utilisée dans les deux expériences suivantes réalisées par les élèves.
- Détection de l’équivalence du titrage par les ions thiosulfate :
Dans un tube à essai contenant une solution d’iodure de potassium
2
, ajouter quelques gouttes
d’empois d’amidon
3
, observer.
Faire de même avec une solution de diiode puis avec la solution d’ions triiodure.
1
Le diiode est un produit onéreux.
2
Il faut disposer d’une solution fraîche d’iodure de potassium car les ions iodure s’oxydent à l’air en diiode.
3
Ou du thiodène.

L’enseignant conclut sur la formation d’un complexe bleu entre les ions triiodure et l’empois d’amidon.
Enfin dans un dernier tube à essai contenant un peu de solution d’ion triiodure ajouter la solution
de thiosulfate de sodium goutte à goutte, observer et quand la solution est jaune pâle ajouter
quelques gouttes d’empois d’amidon, observer et continuer à ajouter la solution de thiosulfate de
sodium. Conclure.
2. Détermination du coefficient de partage
Décantation
Dans une ampoule à décanter, agiter vigoureusement 20,00 mL d’une solution de diiode dans du
cyclohexane de concentration molaire 4,00.10-2 mol.L-1, avec 200,0 mL d’eau prélevée à la fiole
jaugée
4
. Laisser décanter. Repérer la phase aqueuse et la phase organique (densité du cyclohexane
à 20 °C : 0,7781).
Séparer les deux phases en prélevant chacune d’elles dans un récipient propre et sec.
Titrage de la phase aqueuse
Prélever à la pipette 50,00 mL de la solution aqueuse dans un becher
5
.
Titrer par la solution de thiosulfate de sodium de concentration molaire 5,00.10-3 mol.L-1 en agitant.
Juste avant l’équivalence (coloration jaune très pâle), ajouter quelques gouttes d’empois d’amidon.
Dosage par étalonnage de la phase organique
Prélever à la pipette 1,00 mL de la phase organique, les diluer à 50,00 mL dans une fiole jaugée avec
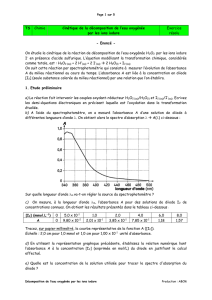
du cyclohexane. Mesurer l’absorbance de la solution à
= 520 nm et déterminer la concentration
molaire en diiode à l’aide de la courbe d’étalonnage qui est donnée (elle est établie pour des
concentrations molaires en diiode dans le cyclohexane comprise entre 1,00.10-4 mol.L-1 et 1,00.10-3
mol.L-1).
3. Détermination de la constante de formation du complexe triiodure
Recommencer en remplaçant les 200,0 mL d’eau par 200,0 mL de solution d’iodure de potassium de
concentration molaire 1,00.10-1 mol.L-1 (rincer l’ampoule préalablement avec quelques mL d’alcool à
brûler puis avec de l’eau).
Prélever à la pipette 10,00 mL de la solution aqueuse dans un becher. Titrer par la solution de
thiosulfate de sodium de concentration molaire 5,00.10-3 mol.L-1 en agitant.
Prélever à la pipette graduée 2,50 mL de la phase organique, les diluer à 50,00 mL dans une fiole
jaugée avec du cyclohexane. Mesurer l’absorbance de la solution à
= 520 nm et déterminer la
concentration molaire en diiode à l’aide de la courbe d’étalonnage.
Exemples de questions
1. Détermination du coefficient de partage
Quelles sont les espèces présentes dans la phase aqueuse ? Dans la phase organique ?
Ecrire l’équation de la (ou des) réaction(s) d’oxydoréduction mise(s) en jeu dans le titrage de la
phase aqueuse.
Déterminer la concentration molaire en diiode dans chacune des phases. Etait-il nécessaire de
doser la quantité de diiode dans les deux phases ?
En déduire le coefficient de partage, constante d’équilibre associée à la réaction :
I2(aq) = I2(S)
2
2S,éq.
2H O,éq.
I
= I
K
.
2. Détermination de la constante de formation du complexe triiodure
Déterminer la concentration molaire en diiode dans la phase organique.
En déduire la concentration molaire en diiode dans la phase aqueuse.
Quelles sont les espèces présentes dans la phase aqueuse ? Lors du titrage de cette phase
aqueuse quelles sont les espèces titrées ?
Déterminer la concentration molaire du diiode sous toutes ses formes dans la phase aqueuse.
En déduire celle des ions triiodure.
4
La fiole jaugée a été choisie car même si la fiole jaugée porte la mention « in » (la verrerie est jaugée au
contenu), la précision sera meilleure que si une éprouvette graduée est utilisée.
5
Il est également possible d’utiliser une fiole jaugée de 50 mL à condition de la rincer et de joindre les eaux de
rinçage au contenu du becher qui va être titré.
 6
6
1
/
6
100%