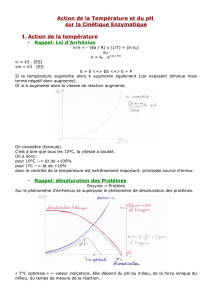
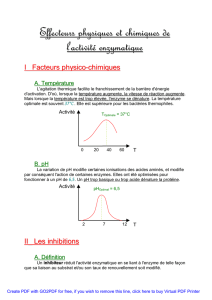
4eme cours: 30 sept

BIOCHIMIE
P16
INHIBITION NON COMPETITIVE
Pas de changement d’affinité enz-substrat ( même Km) mais le fonctionnement de l’enzyme
est altéré (Vm différente).
P17
4-3 cinétique non michaëlienne
On observe différentes structures quaternaires, les sous unités sont associées entre
elles par des liaisons non covalentes hydrophobes et ioniques. Le comportement cinétique
devient alors différent.
P18
Courbe :
Pour une structure quaternaire on observe un comportement de type sigmoïde.
Ex : hémoglobine et sa capacité à lier l oxygène
Schéma
Lorsqu’on a plusieurs sous unités elles interagissent entre elles : changement de conformation
peu adapté à lier le substrat et donc de faible affinité.
Un monomère a une plus gde affinité.
En augmentant la concentration en substrat, on arrive à lier une molécule de substrat à au
moins une sous unité, un changement de conformation accompagne la liaison et se transmet à
l ‘ensemble de la molécule : plus gde affinité pour le substrat.
Analyse de la courbe
Au départ, zone de fable affinité puis changement de conformation donc augmentation rapide
de l’activité, atteinte d’un maximum.
Au point d’inflexion correspond la vitesse maximale/2 et Km.
On peut déterminer une concentration physiologique définie entre deux limites correspondant
à l’activité maximale et minimale. Ce qui n’est pas de même pour la courbe hyperbolique
pour laquelle l’activité sera similaire dans cette même zone.
P19
ALLOSTERIE :
Intervention d’un régulateur qui se fixe sur un autre site de chaque sous unité, il peut être
-activateur : il modifie la conformation des sous unités de façon à ce qu’elles
deviennent plus affines.
La liaison du substrat à faible concentration se fait donc plus facilement.
-inhibiteur : effet inverse

courbes : comportement cinétique
courbe sigmoïde donc enzyme à structure quaternaire avec effets coopératifs
en comparaison a la courbe de contrôle, on observe
un déplacement de la courbe vers la droite, donc une augmentation de Km.
on en déduit l’action d’un inhibiteur allostérique
un déplacement de la courbe vers la gauche, donc une diminution de KM
on en déduit l’action d’un activateur allostérique
Une enzyme peut donc être soit subitement accélérée ou subitement inhibée.
Ex :
E1 E2 E3 E4 E5
A B C D E F
Généralement, l’enzyme allostérique qui intervient dans la régulation est la
première(E1) car -cela permet de limiter la consommation d’énergie
-les produits intermédiaires ne servent pas à grand chose
L’inhibiteur de cette voie est le plus souvent le produit final (F)
Il exerce un rétrocontrôle négatif sur E1 (feed back)
Différents moyens de moduler l’activité d’un enzyme
ALLOSTERIE
Permet de comprendre comment les composés formés effectuent un rétrocontrôle négatif.
Action instantanée.
PHOSPHORYLATION
Activation ou inhibition d’une voie métabolique, activation ou blocage d’une protéine.3
Environ quelques secondes (cascade d’informations)
EXPRESSION d’un gène
Transcription, post transcription, traduction
Modification de la quantité de l’enzyme
Quelques heures
Ces 3 mécanismes interviennent de façon complémentaire mais différente.
P20
5) RELATION STRUCTURE/FONCTION DES PROTEINES
ENZYMATIQUES
tous les types de protéines peuvent correspondre à des enzymes : protéines globulaires
solubles, protéines à structure quaternaire, protéines membranaires…
notion d’isoformes : 2 protéines différentes ayant la même activité enzymatique

soit produits de 2 gènes différents, soit produits du même gène (épissage alternatif,
modification post traductionnelle, glycosylation…)
structure tridimensionnelle des enzymes. notion de site actif
différents repliements qui définissent une protéine globulaire avec des espaces définis
pour fixer le substrat.
P21 MODE DE FONCTIONNEMENT DE LA CHYMOTRYPSINE
1er et 2ème schéma :
ligne pointillée : poche hydrophobe riche en acides aminés
R : cycle aromatique appartenant à un AA ( Phe, Tyr, Try )
Par une réaction en chaîne, 3 acides aminés de la chymotrypsine ( Asp 102, His 57
Ser 195 ) se mettent à proximité l’un de l’autre formant ainsi une « triade catalytique ». Par
des phénomènes de délocalisation électronique, cette triade se fixe via la serine sur la poche
hydrophobe.
3ème schéma :
formation d’une liaison acyl ester : acylation du site actif.
On passe donc par une acyl enzyme
Libération de l’extrémité NH2
4ème schéma :
mécanisme en chaîne. fixation d’une molécule d’eau.
liaison peptidique qui engage le COOH de l’AA hydrophobe.
1
/
3
100%