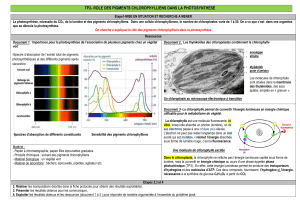
Séparer les différents pigments d`une solution de chlorophylle brute

Ce que dit le programme
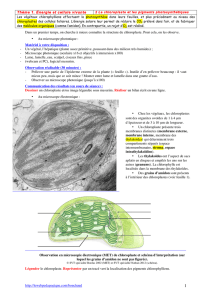
La cellule chlorophyllienne des végétaux verts effectue la photosynthèse grâce à l'énergie lumineuse. Le
chloroplaste est l'organite clé de cette fonction. La phase photochimique produit des composés réduits
RH2 et de l'ATP. La phase chimique produit du glucose à partir de CO2 en utilisant les produits de la phase
photochimiqu
La plupart des cellules eucaryotes (y compris les cellules chlorophylliennes) respirent : à l'aide de
dioxygène, elles oxydent la matière organique en matière minérale. La mitochondrie joue un rôle majeur
dans la respiration cellulaire. L'oxydation du glucose comprend la glycolyse (dans le hyaloplasme) puis le
cycle de Krebs (dans la mitochondrie) : dans leur ensemble, ces réactions produisent du CO2 et des
composés réduits R'H2. La chaîne respiratoire mitochondriale permet la réoxydation des composés
réduits ainsi que la réduction de dioxygène en eau. Ces réactions s'accompagnent de la production d'ATP
qui permet les activités cellulaires.
Poste : Couleur d’un végétal et capacité à la photosynthèse
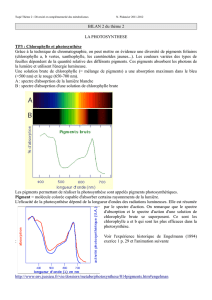
OC : les feuilles réalisent la photosynthèse grâce à des pigments chlorophylliens, chlorophylle a et b,
carotène et xanthophylle qui absorbent les radiations lumineuses.
Om : Réaliser une solution de chlorophylle brute et une chromatographie en suivant un protocole
Adopter une démarche explicative
CR obtention d’une chromatographie où les différents pigments sont identifiables, manipuler en respectant
les consignes de sécurité
On cherche à éprouver l’hypothèse suivante : les feuilles d’un végétal de couleur rouge sont capables
d’absorber l’énergie lumineuse et de la convertir en énergie chimique.
a- Proposer une démarche d’investigation permettant de vérifier que les feuilles d’un végétal de
couleur rouge sont capables d’absorber l’énergie lumineuse et de la convertir en énergie
chimique.
b- Réaliser l’extraction et la séparation des pigments en suivant le protocole.
c- Pendant le temps d’attente de la migration, verser un peu de solution de pigments dans le tube
du spectroscope manuel et comparer le spectre obtenu au spectre de la lumière blanche.
d- Faire un schéma légendé des résultats obtenus
Protocoles
Extraire une solution de chlorophylle brute
Placer dans un mortier un peu de sable fin. Ajouter des feuilles bien vertes coupées en petits morceaux.
Broyer à sec (le sable casse les parois cellulaires).
Ajouter un peu d'alcool à 90' pour solubiliser certaines substances et continuer à broyer doucement pendant 5 min.
Filtrer le contenu du mortier.
Conserver dans un bêcher la solution dite de chlorophylle brute.
Séparer les différents pigments d'une solution de chlorophylle brute par chromatographie
1-Sur une bande de papier à chromatographie déposer à l'aide d'un agitateur à une distance d'environ 2 cm du bas 6
à 8 gouttes de solution de chlorophylle brute.
2-Laisser sécher entre les dépôts.
3-Suspendre le papier à chromatographie à l'aide du crochet, dans une éprouvette contenant 5 mi de solvant.
4-Laisser migrer 30 à 50 minutes à l'obscurité.
Précautions :
• ne pas toucher le papier sur la zone de migration
• ne pas mettre le papier en contact avec le bord de l'éprouvette
• veiller à ce que la tache de chlorophylle brute soit juste au-dessus du niveau du solvant.
Principe de la chromatographie : c'est une technique de séparation des substances présentes dans un mélange ; elle
utilise la migration d'un liquide sur un support solide (papier..). Les constituants du mélange sont entraînés plus ou moins
loin suivant leurs propriétés physicochimiques (masse, polarité, solubilité….).
Les pigments chlorophylliens solubles dans le solvant migrent sur le papier de chromatographie et se répartissent de la
façon suivante : chlorophylle b (vert jaune), chlorophylle a (vert bleuté), xanthophylle jaune), caroténoïdes (orangé).

Poste : La phase photochimique de la photosynthèse
OC : Expérience de Hill sur des thylakoïdes isolés afin de repérer les modalités du processus
photosynthétique à ce niveau d’organisation du chloroplaste ainsi que celles de l’oxydation de l’eau en O2.
OM : Concevoir une stratégie pour résoudre une situation problème. Réaliser la manipulation d’après un
protocole et utiliser une chaine d’EXAO. Traiter les informations sous forme d’un graphique
On veut vérifier que la phase photochimique qui se déroule à la lumière nécessite un accepteur d’électrons
a- Proposer une démarche d’investigation permettant de vérifier la nécessité d’un accepteur
d’électrons lors de la phase photochimique de la photosynthèse des chloroplastes.
b- Réaliser le montage et paramétrer la mesure en suivant les consignes
c- Effectuer les mesures en respectant le protocole
d- Exploiter les résultats obtenus pour répondre au problème.
EXTRACTION DES CHLOROPLASTES DES FEUILLES
Découper en fines lamelles quelques feuilles dans le mortier sortant du réfrigérateur.
Ajouter 3 mL de tampon tris-saccharose pH=l 0.5.
Commencer à broyer puis ajouter progressivement en cours de broyage une petite pincée de sable (qui
facilite le broyage) et 20 mL de solution tampon phosphate-saccharose pH= 6.5.
Broyer fermement pendant au moins 2 minutes.
Filtrer dans un entonnoir garni de gaze (3 ou 4 épaisseurs) et de coton hydrophile. Presser pour obtenir
le maximum de filtrat.
Conserver la suspension de chloroplastes ainsi obtenue à l'obscurité (erlenmeyer enveloppé de papier
aluminium) et au froid (cristallisoir rempli de glaçons) jusqu'au moment de la mesure.
Remarque : les membranes des chloroplastes sont lésées de telle sorte que le contenu du stroma est dilué
dans la solution mais les thylakoïdes sont intacts.
MESURE DE L'EVOLUTION DE LA CONCENTRATION EN DIOXYGENE DE LA SUSPENSION
Verser 6 ou 13 mL du filtrat dans l'enceinte selon sa capacité.
Fermer l'enceinte, vérifier l'absence de bulle d'air et la bonne position des capteurs.
Mettre en fonction l'agitateur.
Attendre la stabilisation des mesures puis lancer l'enregistrement.
Enregistrer pendant 12 minutes et insérer un repère sur le graphe à chaque modification des
conditions :
- 3 minutes à l'obscurité (cache),
- 6 minutes à la lumière, injecter 0,2 mL de réactif de Hill (accepteur d'électrons) après 3 minutes
d'éclairement,
- 3 minutes à l'obscurité.
Poste : respiration/ fermentation des levures
On cherche à déterminer si la souche de levures étudiée utilise le glucose par voie respiratoire ou
fermentaire
OC : les levures utilisent la fermentation ou la respiration pour produire l’énergie nécessaire à leur
fonctionnement. L’étude de la consommation de dioxygène ou du rejet de C02 permet d’identifier le
métabolisme respiratoire ou fermentaire.
Om : Concevoir une stratégie pour résoudre une situation problème. Réaliser la manipulation d’après un
protocole et utiliser une chaine d’EXAO. Traiter les informations sous forme d’un graphique
e- Proposer une démarche d’investigation permettant de montrer si le glucose utilise la voie
respiratoire ou fermentaire.
f- Réaliser le montage et paramétrer la mesure en suivant les consignes

g- Effectuer les mesures de la concentration en dioxygène et en éthanol dans la suspension de
levures en respectant le protocole
h- Exploiter les résultats obtenus pour répondre au problème.
Réalisation du montage et paramétrage de la mesure
(On réalisera les points 1 et 2 dans l’ordre qui convient en fonction du matériel)
1.verser, à l’aide d’une pipette, le volume de suspension de levures (préalablement agitée) nécessaire
pour remplir l’enceinte ;
2. installer dans l'enceinte la sonde à dioxygène et la sonde à éthanol, fermer (si nécessaire) les autres
orifices et vérifier l’absence
de bulle d’air dans l’enceinte ;
3. éponger les débordements éventuels;
4. lancer l'agitation à vitesse modérée;
5.préparer une seringue avec .........mL de la solution de glucose et sans bulle d’air ;
6. paramétrer la mesure(voir la fiche technique du logiciel ); la durée de la mesure est 10 minutes;
7. prévoir l’insertion d’un repère sur le graphique.
Protocole d’acquisition des mesures
lancer la mesure ;
à t = 2 minutes, ajouter dans le réacteur .........mL de la solution de glucose ; présenter les résultats de
façon optimale en jouant sur les fonctionnalités du logiciel.
poursuivre l’enregistrement durant le temps restant ;
1
/
3
100%