File

Sc9.1.3 – Les composés – p.1
Sciences 9e année Nom : ___________________________ Classe : _______
Sc9.1.3 : Les composés
Plan du chapitre – Guide d’étude
1. Composés et formules chimiques
a. Les composés ioniques et covalents (moléculaires) (p.73-75)
b. Composés ioniques
i. Exemples communs (NaCl, CaCO3, Na2SO4, NaOH)
ii. Le nom chimique des composés ioniques simples (p.81-82)
c. Composés covalents
i. Exemples communs (C12H22O11, CO2, CH4, H2O)
ii. Le nom chimique des composés covalents simples (p.83)
2. Les changements dans la matière
a. Changements chimiques et physiques – exemples (p.86-88)
b. Les indications d’un changement chimique possible (p.89)
c. La conservation des éléments / atomes.
d. Laboratoire : L’observation des changements dans la matière
(p.92-93)
3. Section STSE
Vocabulaire :
Composé (m)
hepta-
Molécule (f)
penta-
Covalent
hexa-
Mono-
Positif
déca-
Ion (m)
Négatif
tétra-
di-
Ionique
nona-
tri-
Formule (f)
Moléculaire
octa-
-ure
Complète les tirets pour les définitions. Utilise des articles corrects (le, la, les, l’, un,
une, des)
1. ______________________________ : une substance pure formée de
deux ou plusieurs éléments combinés chimiquement.
2. ______________________________ : un atome qui a perdu ou
gagné des électrons.
3. Un ion ______________________________ est un atome qui a perdu
un ou plusieurs électrons.

Sc9.1.3 – Les composés – p.2
4. Un ion ______________________________ est un atome qui a gagné
un ou plusieurs électrons.
5. ______________________________ chimique : utilise les symboles
des éléments pour dire quels atomes sont dans un
composé, et combien il y en a.
6. Un composé ______________________________ est formé d’ions
positifs et négatifs attirés ensemble. C’est un composé
formé par un non-métal avec un métal.
7. Un composé ______________________________, appelé aussi
______________________________ est formé quand des atomes non-
métalliques se partagent des électrons.
8. ______________________________ : un groupe d’atomes reliés par
des liaisons covalentes.
9. ________________ : un suffixe qui indique le non-métal dans un composé
ionique.
10. ________________ : un préfixe qui indique 1 atome.
11. ________________ : un préfixe qui indique 2 atomes.
12. ________________ : un préfixe qui indique 3 atomes.
13. ________________ : un préfixe qui indique 4 atomes.
14. ________________ : un préfixe qui indique 5 atomes.
15. ________________ : un préfixe qui indique 6 atomes.
16. ________________ : un préfixe qui indique 7 atomes.
17. ________________ : un préfixe qui indique 8 atomes.
18. ________________ : un préfixe qui indique 9 atomes.
19. ________________ : un préfixe qui indique 10 atomes.

Sc9.1.3 – Les composés – p.3
Les éléments, les composés, et les mélanges
Classifie les exemples du tableau.
Éléments
Composés
Mélanges
Parmi ces trois catégories :
Dans le tableau périodique, on trouve les _________________________
Les substances pures sont __________________________________
Les ______________________________ contiennent une seule
sorte de « molécules ».
Les ________________________ contiennent plus qu’une sorte de
« molécules ».
Les formules chimiques
Exemple
Nom
Signification de la formule
NaCl
MgCl2
AlCl3
CaCO3
Na2SO4
NaOH
La formule chimique utilise les _______________________________ des éléments.
Les indices (subscripts) indiquent _______________________________________.

Sc9.1.3 – Les composés – p.4
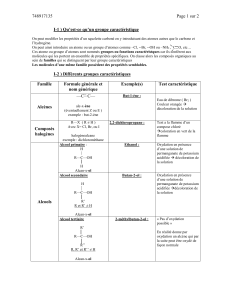
La différence entre les composés ioniques
et les composés covalents/moléculaires
Composés ioniques
Composés covalents/moléculaires
Les différences entre les deux …
Prédis : ionique ou covalent ? Comment le sais-tu ?
Le chlorure de magnésium : MgCl2
Le chlorure d’aluminium : AlCl3
Le tétrachlorure de carbone : CCl4

Sc9.1.3 – Les composés – p.5
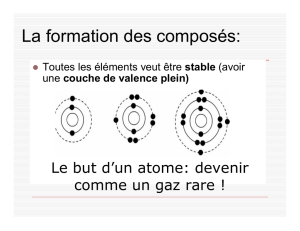
Les composés ioniques
La formation d’un composé ionique
Utilise des dessins et des explications écrites pour montrer la formation du chlorure de
sodium (NaCl) selon la vidéo « Atoms and Their Electrons ».
1.
2.
3.
4.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%