La chimie même dans nos sucreries!

SNAT 2320
Didactique et épistémologie des sciences naturelles
Printemps des sciences 2010
La chimie, même dans nos sucreries !
Defays Marie
Toussaint Eléonore
Marciano Florian
de Kemmeter Isabelle
Année scolaire 2009-2010

1
Plan
La chimie, même dans nos sucreries !
1) Description de la situation problème
2) Lien avec le programme
Public visé
Préacquis
Compétences visées : - générales
- spécifiques
3) Concepts à faire acquérir (liste et définitions)
4) Carte conceptuelle
5) Expériences envisagées (tâches)
D’où viennent les arômes, et les textures si appréciés dans les bonbons ?
a) Comment synthétiser une molécule odorante ?
b) Comment synthétiser différents arômes ?
c) Comment les bonbons acquièrent-ils différentes textures ?
6) Conclusion
7) Bibliographie
8) Annexes

2
1) Description de la situation problème
A titre de job d’étudiant, on vous propose de tenir pendant le mois de juillet le
magasin « Croque-Bonbon ». Vous vous dites : « chouette, je vais pouvoir me gâter » et vous
vous empressez d’accepter. Le gérant, qui part en vacances, vous permet d’emporter chaque
soir les bonbons qui partent le moins vite. Vous repérez de gros bonbons qui vous font saliver
mais pas de chance, chaque soir il ne reste que du réglisse, des menthes, des caramels durs ou
des bonbons à la violette qui ne vous attirent pas. Vous mettez alors le réglisse le plus en
avant possible et les violettes sur le comptoir, mais rien n’y fait, ce sont toujours les mêmes
bonbons qui partent ! Le fournisseur vous téléphone pour la commande de la semaine,
lesquels allez-vous le plus mettre en stock ?
Début de la séance : arrivée des élèves et présentation de bonbons qui se distinguent
par leur couleur, leur forme, leur odeur et leur goût. Nous leur demanderons lesquels ils
choisiraient en premier, nous ferons la transposition aux producteurs de bonbons et nous
poserons le problème suivant :
« Vous avez votre propre industrie de bonbons, comment allez-vous attirer le public pour
vendre vos bonbons ? Sur quels détails allez-vous travailler pour vendre le mieux possible vos
produits? »
Selon les réponses des élèves, nous découvrirons l’importance de la forme, du goût,
de l’odeur, des couleurs (colorants),... Nous nous tournerons alors vers les questions
qui introduisent nos expériences.
2) Lien avec le programme
Public visé : 6éme générale
Préacquis :
Chimie : états de la matière, ponts hydrogènes, composés polaires, soluté,
solvant, solution, concentration molaire, stœchiométrie, changements d’état,
différence entre glucose, fructose, saccharose (rappel en annexe).
Compétences visées :
o Compétences générales
- S’approprier des concepts fondamentaux.
- Modéliser.
- Utiliser des procédures expérimentales : réaliser une expérience, analyser les résultats
obtenus.
- Communiquer oralement.
- Résoudre des applications concrètes : réfléchir sur les méthodes, raisonnements et
procédures utilisés.
- Utiliser des savoirs scientifiques pour enrichir des représentations interdisciplinaires : la
vision du monde, la pratique de certaines activités.

3
o Compétences spécifiques
- Expliquer les relations entre les propriétés physiques et la structure moléculaire.
- Modéliser les molécules de glucose.
- Expliquer les propriétés principales et quelques utilisations des esters : montrer qu’il existe
des esters dans la nature mais également des esters fabriqués artificiellement.
- Traduire une réaction chimique par une équation chimique.
- Expliquer le rôle d’un catalyseur.
- Comprendre le monde qui nous entoure, expliquer la pratique de certaines activités
industrielles (industrie agroalimentaire) et évaluer l’impact de celles-ci sur la consommation
et la santé.
3) Concepts à faire acquérir (liste et définitions)
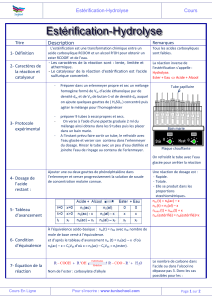
Estérification : il s’agit de la condensation d’un acide carboxylique avec un alcool donnant
un ester et de l’eau.
catalyseur
Acide carboxylique + alcool ester + eau
(R1 et R2 sont des groupes alkyls pouvant être identiques ou différents)
Fonction ester : fonction constituée d’un atome de carbone lié à un atome d’oxygène par une
double liaison ainsi qu’à un groupement OR (R = radical alkyl) et à un autre radical R’(R’=
radical alkyl) par une liaison simple.
Les esters sont principalement utilisés dans l’industrie agroalimentaire et en parfumerie. Ils
apparaissent fréquemment comme composés essentiels des substances odorantes (arômes
naturels ou artificiels) Comme exemple : l’éthanoate (acétate) d’isoamyle qui a une odeur de
banane ou encore l’éthanoate d’octyle qui a une odeur d’orange,…
Arôme naturel : arôme constituant certains éléments naturels (exemple : fruit, végétaux,…).
Arôme de synthèse : arôme identique à l’arôme naturel mais synthétisé en laboratoire.
H+

4
Arôme artificiel : arôme de structure chimique différente de l’arôme naturel et synthétisé en
laboratoire.
Principe de Le Chatelier : si on impose une modification (concentration, température,
pression) à un système chimique en équilibre, le système réagit de manière à atteindre un
nouvel état d’équilibre qui réduit au minimum la contrainte imposée par cette modification
(un principe est une affirmation qui ne peut être démontrée mais qui est admise parce que
toujours vérifiée dans ses conséquences).
Catalyseur : substance qui augmente la vitesse d’une réaction chimique. Il participe à la
réaction mais est régénéré à la fin de celle-ci. Il ne fait donc partie ni des réactifs ni des
produits dans l'équation.
Cristallisation : processus selon lequel un soluté se sépare lentement d’une solution sous
forme de cristaux, éventuellement lors de l’évaporation du solvant.
Solide cristallin : est un solide dans lequel les atomes, les ions ou les molécules sont disposés
de façon ordonnée. C’est le cas par exemple du sucre cristallisé.
Précipitation : processus selon lequel le soluté se sépare de la solution si rapidement qu’un
cristal n’a pas le temps de se former. Le soluté apparait sous forme d’une poudre fine appelée
précipité.
Solubilité : d’un composé ionique ou moléculaire, appelé soluté, est la concentration
maximale de ce composé que l’on peut dissoudre dans un solvant, à une température donnée.
Le glucose est soluble dans l’eau, il forme de nombreux ponts hydrogènes avec l’eau.
Il forme un sirop lorsqu’il est en concentration élevée. On exploite cette aptitude du glucose à
former un sirop pour fabriquer des bonbons.
Décantation : technique de séparation qui utilise les différences de densité.
Acide : Un acide est une espèce chimique capable de donner un proton H+
Base : Une base est une espèce chimique capable de fixer un proton H+
Réaction acide-base : est une réaction au cours de laquelle se produit un transfert de proton
H+ de l’acide vers la base.
4) Carte conceptuelle
La carte conceptuelle se situe en annexe de ce travail.
5) Expériences envisagées
D’où viennent les arômes, et les textures si appréciés dans les bonbons ?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%