Exercice : Arôme alimentaire

Exercice : Arôme alimentaire ( 11 points)
L’acétate d’isoamyle est un arôme alimentaire à odeur et saveur de banane.
Pour réaliser la synthèse de cet arôme, on introduit dans un ballon de l’acide acétique et de l’alcool
isoamylique. On ajoute quelques grains de pierre ponces et on adapte un réfrigérant à eau vertical sur le
ballon. On chauffe le mélange à reflux pendant une heure.
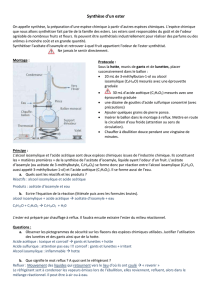
1. Faire un schéma décrivant le chauffage à reflux. Nommer les différentes parties du montage. (1pt)
2. Quel est le rôle du réfrigérant ? Préciser sur le schéma le sens de circulation de l’eau dans le
réfrigérant. (1,5pts)
3. Quel est le rôle de la pierre ponce ?(1pt)
4. Pourquoi chauffe-t-on ? Quel est l’intérêt du chauffage à reflux ? (2pts)
Pour séparer l’arôme, on laisse refroidir le mélange réactionnel, puis, à froid, on ajoute une solution
concentrée de chlorure de sodium. Après agitation, on verse la phase liquide dans une ampoule à décanter.
Après décantation on observe deux phases liquides. La phase aqueuse est la plus dense.
5. En vous aidant des données du tableau, dire dans quelle phase on trouve l’acétate d’isoamyle formé,
l’alcool qui n’a pas réagi et l’acide qui n’a pas réagi. (1pt)
6. Pourquoi ajoute-t-on de l’eau salée plutôt que de l’eau distillée ?(1pt)
7. Représenter sur un schéma légendé la séparation des phases. Dans quelle phase liquide l’arôme se trouve-
t-il ? (1,5pts)
8. Pourquoi est-il plus prudent d’élever la température de la phase contenant l’arôme pour détecter son
odeur plutôt que de la goûter ?(1pt)
9. On donne le pictogramme de l’acide acétique, quelles précautions doit-on prendre pour le manipuler?(1pt)
Données :
Densité
Température d’ébullition (°C)
Solubilité dans l’eau
Acide acétique
1,05
118
Soluble
Alcool isoamylique
0,81
130
Soluble
Acétate d’isoamyle
0,87
142
Insoluble
Correction :
1. Schéma :
2. Le réfrigérant condense les vapeurs et les refluent dans le ballon.
3. La pierre ponce régule l’ébullition.
4. Le chauffage accélère la réaction. Le chauffage à reflux évite les pertes de réactifs et de produits.
5. L’acide acétique et l’alcool se trouve dans la phase aqueuse. L’acétate dans la phase organique.
6. L’acétate est moins soluble dans l’eau salée que dans l’eau distillée. C’est le relargage.
7. Schéma :
8. La phase liquide contenant l’arôme renferme d’autres produits (acide acétique et alcool isoamylique).
L’odeur de banane est plus facile à détecter dans les vapeurs.
9. Gants, lunettes et travailler dans un endroit aéré.
1
/
1
100%