Chapitre

Classe de BTS AB2
Chapitre 8 : Les dérivés carbonylés
1
Chapitre de Chimie n°8
Les dérivés carbonylés
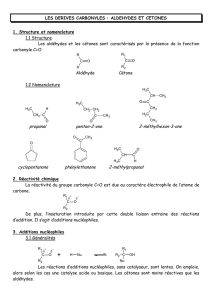
I- Présentation des dérivés carbonylés
1- Formule générale
Pour les aldéhydes, un groupement alkyle est lié au carbone fonctionnel :
Pour les cétones, deux groupements alkyles sont liés au carbone fonctionnel :
2- Nomenclature
Aldéhydes : Le nom de l’aldéhyde se déduit de celui de l’alcane correspondant auquel on ajoute la terminaison –al.
Le groupement –COH est toujours en bout de chaîne : on ne précise donc jamais la position de la fonction. Le carbone
fonctionnel porte toujours le numéro 1.
Exemples :
Méthanal :
3,4-diméthylpentanal :
Cétones : Le nom de la cétone se déduit de celui de l’alcane correspondant auquel on ajoute la terminaison –one.
Il faut cette fois préciser, lorsque cela est nécessaire, la position de la fonction.
Exemples :
Propanone (Acétone) :
Pentan-2-one :
Cyclohexanone :
Remarque : Lorsque la fonction carbonyle n’est pas la fonction principale, elle correspond au substituant oxo-.
Exemple : Acide 3-oxobutanoïque
3- Réactivité
Les charges partielles se placent, sur la fonction carbonyle, de la façon suivante, étant donné les électronégativités de chacun
des atomes :
La liaison C=O est dont très nettement polarisée. Le carbone portant une charge +, il a des propriétés électrophiles et peut donc
réagir avec des nucléophiles, tels que les amines par exemple.
De plus, l’hydrogène situé en alpha de la fonction carbonyle présente des propriétés acides, il peut donc réagir avec des bases.
Ces propriétés sont valables pour les aldéhydes et les cétones.
Par contre, les aldéhydes et les cétones ont des propriétés différentes, vis-à-vis des réactions d’oxydation.
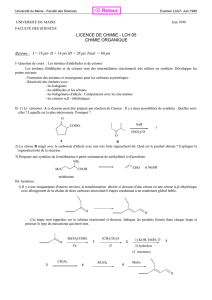
II- Additions nucléophiles
1- Addition d’eau
Les dérivés carbonylés réagissent avec l’eau, et subissent donc des réactions d’hydratation dont les produits sont appelés des
hydrates, et sont des diols.
Cette réaction peut être catalysés en milieu acide ou en milieu basique.
Equation-bilan : Formation d’un diol géminé

Classe de BTS AB2
Chapitre 8 : Les dérivés carbonylés
2
Mécanisme :
Catalyse basique :
Catalyse acide
Les aldéhydes sont plus réactifs que les cétones pour cette réaction, qui est un équilibre et peut donc être déplacé dans un
sens ou dans l’autre.
2- Addition des alcools
Les alcools s’additionnent sur les aldéhydes et sur les cétones d’une façon assez similaire à celle de l’eau. Les produits formés
sont appelés des hémiacétals, parce que ce sont des intermédiaires dans la voie menant aux acétals.
Equation-bilan : Formation d’un hémiacétal, avec une catalyse acide ou basique.
Remarque : Formation des hémiacétal cyclique du glucose.
Equation-bilan : Formation d’un acétal, en présence d’un excès d’alcool ; et avec une catalyse acide.
Mécanisme :
3- Réaction avec les amines primaires
Voir le chapitre précédent : Formation de la fonction imine.
III- Réaction avec l’hydrogène en .
1- Forme énol et équilibre céto-énolique
Les atomes d’hydrogène en du C=O sont mobiles : en effet, les électrons de leur liaison avec l’atome de C sont attirés vers
celui-ci à cause de la polarisation du groupe carbonyle. Il se forme un ion énolate lorsque le proton s’en va :

Classe de BTS AB2
Chapitre 8 : Les dérivés carbonylés
3
L’ion énolate qui porte une charge négative sur le carbone est en équilibre avec une autre forme de cet ion, appelée forme
mésomère où la charge est portée par l’atome d’oxygène :
Les aldéhydes et les cétones peuvent donc exister dans l’eau sous forme d’un mélange de deux formes en équilibre . Cet
équilibre est appelée l’équilibre céto-énolique :
L’existence de cet équilibre est nécessaire pour expliquer les deux réactions suivantes.
2- Aldolisation
En milieu basique (OH-), deux molécules d’aldéhydes peuvent s’additionner pour former un aldol. (fonction aldéhyde +
fonction alcool).
Equation-bilan : Réaction avec l’éthanal :
Remarque 1 : L’aldol formé peut se déshydrater, on obtient alors un produit contenant une fonction aldéhyde et une double
liaison. Cette réaction s’appelle une crotonisation.
Remarque 2 : Les aldéhydes tertiaires, aromatiques ou le méthanal (qui n’ont pas de H en position ) ne peuvent pas donner
lieu à des réactions d’aldolisations. En milieu basique, elles donnent lieu à une réaction de dismutation, appelée réaction de
Cannizzaro.
3- Cétolisation
En milieu basique (OH-), une molécule d’aldéhyde et une molécule de cétone peuvent s’additionner pour former un cétol
(fonction cétone + fonction alcool).
Le groupe C=O de l’aldéhyde étant plus réactif que celui de la cétone, la cétone s’additionne au groupe carbonyle de
l’aldéhyde.
Equation-bilan : Réaction de l’acétone (propanone) sur l’éthanal :
Remarque : Ce type de réaction a un rendement très faible entre deux cétones.
IV- Réactions d’oxydations
Ces réactions sont différentes pour les aldéhydes et les cétones.
1- Oxydation des aldéhydes
Les oxydations sont faciles, les aldéhydes s’oxydent en acides carboxyliques. Les oxydants peuvent être KMnO4, K2Cr2O7,
O2 (+ catalyseur).
Exemple : Oxydation de l’éthanal en acide éthanoïque en présence du dioxygène de l’air, en utilisant l’acétate de manganèse
comme catalyseur, à 80°C :

Classe de BTS AB2
Chapitre 8 : Les dérivés carbonylés
4
Remarque : L’oxydation complète de l’éthanal conduit au dioxyde de carbone et à l’eau :
On peut également utiliser des oxydants plus doux que ceux cités précédemment :
- le nitrate d’argent ammoniacal (expérience du miroir d’argent)
Le nitrate d’argent ammoniacal est préparé en additionnant une solution d’ammoniac à une solution de nitrate d’argent, après
dissolution du précipité brun d’oxyde d’argent. Cette solution contient des ions diammineargent (I) : [Ag(NH3)2]+
On ajoute de l’éthanal au nitrate d’argent ammoniacal, le tout est chauffé doucement au bain-marie.
Un dépôt d’argent apparaît alors sur les parois du tube à essais : les ions diammineargent ont été réduit en argent métal et
l’éthanal a donc été oxydé en acide éthanoïque.
- la liqueur de Fehling
Une solution de liqueur de Fehling contient des ions cuivre Cu2+ complexés avec le tartrate double de sodium et de potassium.
Par chauffage doux de la liqueur de Fehling et de l’éthanal, il se forme un précipité rouge d’oxyde de cuivre (I) : les ions Cu2+
ont été réduits.
Cette réaction est caractéristique de la fonction aldéhyde et est utilisée comme test de reconnaissance de cette fonction.
2- Oxydation des cétones
L’oxydation des cétones est rare et très difficile : elle conduit obligatoirement à la rupture de la chaîne carbonée. Elle n’a lieu
qu’avec des oxydants puissants.
Exemple : Oxydation de la propanone en acide éthanoïque et en dioxyde de carbone :
3- Réactions de réduction en alcool
La réduction d’un aldéhyde donne un alcool primaire et la réduction d’une cétone un alcool secondaire.
Cette réaction de réduction peut être réalisée par des réactifs appelés hydrures : l’aluminohydrure de lithium LiAlH4 par
exemple.
Equation-bilan :
Elle peut également être réalisée par le dihydrogène en présence d’un catalyseur (Ni, Pt).
Equation-bilan :
1
/
4
100%