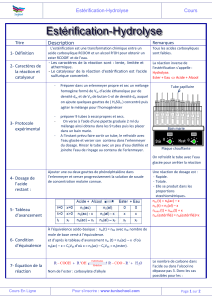
2009-2010 Sadiki

1
Collège Sadiki
Devoir de synthèse n° : 2
Sciences physiques
3ème Maths et Sc.Exp
Samedi 7-3-2009
Profs : Obey - Fekih et Cherchari
Exercice : 1 ( 3 pts) HISTORIQUE DE LA RÉACTION D’ESTÉRIFICATION
(première réaction d’estérification)
Marcellin Berthelot (1827-1907) et son élève Péan de Saint-Gilles (1832-1863)
étudièrent, l’estérification de certains acides et alcools, en particulier celle de l’acide
éthanoïque et de l’éthanol.
Le texte qui suit est un extrait du mémoire de Berthelot et Péan de Saint-Gilles, publié
en 1862 sous le titre Recherche sur les affinités.
« …Les esters sont formés par l’union des acides et des alcool ; ils peuvent reproduire
en se décomposant les acides et les alcools. […] En général, les expériences
consistent, soit à faire agir sur un alcool pur un acide pur, les proportions de l’alcool et
de l’acide étant déterminées par des pesées précises, soit à faire agir sur un ester de l’eau. Dans tous les cas de
ce genre, le produit final se compose de quatre corps à savoir : l’ester, l’alcool libre, l’acide libre, l’eau. Mais ces
quatre corps sont dans des proportions telles qu’il suffit de déterminer exactement la masse d’un seul d’entre eux,
à un moment quelconque des expériences, pour en déduire toutes les autres, pourvu que l’on connaisse les
masses des matières primitivement mélangées. […]
Ceci posé, entre les quatre éléments suivants : ester, alcool, acide, eau, le choix ne saurait être douteux, c’est
évidemment l’acide qu’il faut déterminer.[…] On transvase le produit final dans un vase à fond plat, […] on ajoute
quelques gouttes de teinture de tournesol, et l’on verse de l’eau de baryte avec une burette graduée jusqu’à ce
que la teinte rose ou violacée du tournesol ait viré au bleu franc. […]Mais dans les conditions ordinaires, l’eau
intervenant, l’estérification s’arrête à une certaine limite. La limite de la réaction est fixée par des conditions
déterminées : elle est à peu près indépendante de la température et de la pression. […]
Si on élimine l’eau, la réaction d’un acide
sur un alcool peut atteindre un rendement
de 100 %… »
Remarques :
- L’eau de baryte est une solution
aqueuse d’hydroxyde de baryum :
)aq(
2)aq(HO2Ba
( solution basique)
- La teinture de tournesol est un
indicateur coloré.
- On note : pourcentage d’acide
initial estérifié.
= Error! .100%
- (nac)estérifié = nester
Questions
1) Ecrire l’équation de cette réaction
d’estérification en donnant le nom de
l’ester.
2) Dans les différentes
transformations, quelles sont les espèces chimiques présentes dans l’état final ?
3) La réaction évoquée dans le tableau est-elle associée à une transformation lente pour l’observation
courante ? Qu’est ce qui permettrait d’augmenter la vitesse de cette réaction ?
4) Quelles sont les lignes du texte où M. Berthelot décrit un dosage ? Justifier la réponse.
5) Pourquoi avant le dosage on refroidit le prélèvement avec de la glace ?
6) Sachant que la quantité de matière d’acide éthanoïque initiale est (nac)0 = 1 mol et que la quantité de
matière d’alcool initial (nal)0 =1 mol, dresser un tableau descriptif de l’évolution des quantités de matière
du système chimique. Déterminer les quantités de matière des différents constituants du système
chimique au 72ème jour de la réaction.
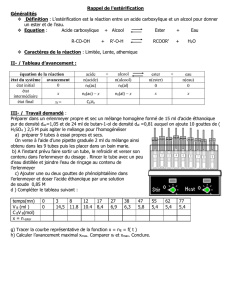
Chimie ( 7 points )
Tableau extrait du mémoire : acide éthanoïque et
éthanol en mélange équimolaire et à la température
ambiante.
Durée de l’expérience
: Pourcentage de
l’acide initial estérifié
15 jours (mai 1861)
10,0
22 jours
14,0
70 jours (juillet)
37,3
72 jours
38,3
128 jours (septembre)
46,8
154 jours (octobre)
48,1
277 jours (janvier 1862)
53,7
368 jours (juin
55,0

2
Exercice n : 2 ( 4 pts )
On donne M(C) = 12 g.mol-1 , M(H) = 1 g.mol-1 et M(O) = 16 g.mol-1.
Un acide carboxylique (A) à chaîne linéaire, de masse molaire M = 88 g.mol-1.
1. a- Donner la formule brute d’un acide carboxylique et montrer que sa masse molaire s’écrit sous
la forme M = 14n + 32 avec n est le nombre de carbone contenu dans sa formule.
b- Déterminer la formule semi développée et le nom de chaque isomère acide de (A).
2. L’isomère à chaine ramifié de (A) est obtenu par une réaction chimique à partir d’un alcool (B).
a- Donner le nom de la réaction.
b- Ecrire la formule semi développée, le nom et la classe de (B).
3- On fait réagir l’acide (A) avec le propan-1-ol, la réaction est très lente à la température ambiante,
pour l’accélérer on ajoute quelques gouttes d’acide sulfurique concentré.
a- Donner le nom de cette réaction.
b- Ecrire l’équation chimique de cette réaction.
c- Donner le nom de l’ester formé.
4- On dissout une masse m d’acide (A) dans de l’eau distillée afin de préparer 100mL de solution de
concentration molaire C= 0,01 mol.L-1. En mesurant le pH de cette solution, on trouve qu’il est égal à
3,9.
a- Calculer la masse m.
b- Calculer la concentration en ions H3O+. L’acide (A) est il faible ou fort ?
« On rappelle que [ H3O+]=10-pH »
c- Ecrire l’équation de dissolution de l’acide (A) dans l’eau.
Exercice n° : 1 ( 6 pts )
Un point mobile M est animé d’un mouvement circulaire accélération angulaire est ’’ = - Error! rad.s-2 entre les
instants t0 =0 s et t1 =20 s. Le rayon de sa trajectoire est R=25 cm. A l’origine des dates, M part de la position
d’abscisse angulaire /3 avec une vitesse angulaire initiale ’0= 2 rad.s-1.
1- Quelle est la nature de mouvement du mobile.
2- Donner les expressions de sa vitesse angulaire ’ et de son élongation angulaire en fonction du temps.
3- a- Montrer que ce mouvement comporte deux phases.
b-Déterminer le nombre de tours effectué par le mobile pendant la première phase du mouvement.
4- Calculer à la date t1
a- La vitesse angulaire ’1 ainsi que la vitesse linéaire du mobile.
b- l’accélération normale et l’accélération tangentielle du mobile. Déduire la valeur de son accélération
linéaire.
5- A partir de la date t1 , le mouvement du mobile M est circulaire uniforme à la vitesse angulaire ’1.
Calculer :
a- La période de ce mouvement. Déduire sa fréquence.
b- Montrer que l’accélération linéaire d’un mouvement circulaire uniforme est égale à l’accélération nrmale.
Exercice n° : 2 ( 4 pts )
Un point matériel, animé d’un mouvement rectiligne sinusoïdal, se déplace sur
un segment AB=20 cm La période du mouvement est To=2 s , A l’instant de date t=o s, le mobile
part du point A d’abscisse xA=-10 cm sans vitesse initiale (voir figure)
1- Etablir la loi horaire du mouvement x(t).
2- Déduire l’expression de la vitesse V(t) du mobile en fonction du temps.
3- A un instant t1,le mobile passe pour la première fois par la position d’équilibre avec une
vitesse V1. Déterminer
a) la date t1
Physique ( 13 points )
A
B
x(m)
x’
O
i
0,1
-0,1
Mobile à t=0

3
b) la valeur de V1.
Trouver une relation entre l’accélération du mobile a(t) et son abscisse x(t).
Exercice n° : 3 ( 3 pts )
Un pendule est constitué d’un fil OA inextensible de masse négligeable de longueur l=1m auquel
est fixé en A une bille B ponctuelle de masse m=80 g. Le pendule est suspendu par son extrémité O
au plafond d’une voiture voir figure.
1) La voiture est animée d’un mouvement rectiligne uniforme.
a- Représenter les forces exercées sur la bille.
b- En appliquant la relation fondamentale de la dynamique à la bille B montrer que le pendule
reste vertical.
2) La voiture est animée d’un mouvement rectiligne uniformément accéléré d’accélération
a=1,5 m.s-2. ( voir figure ci-dessous)
a-En appliquant la relation fondamentale de la dynamique montrer que le pendule ne reste plus vertical.
b-Représenter les forces exercées sur la bille.
4- c-Projeter la relation fondamentale de la dynamique sur le système d’axes (Ax, Ay) puis
déterminer l’angle que fait le fil avec la verticale.
x
x’
B
1
/
3
100%