Hémidesmosome

1
Le cytosquelette
Généralités
I) Les microfilaments ou filaments d'actine
1) Caractéristiques
2) Régulation de la polymérisation
2.1) Polymérisation in vitro
2.2) Protéines intervenant sur la polymérisation in vivo
3) Rôle du filament d'actine
3.1) Formation des jonctions stables
3.2) Les microvillosités
3.3) Mobilité celllulaire
3.3.1) Mise en évidence des fibres d'actine
3.3.2) Contrôle du cycle polymérisation / dépolymérisation
3.3.3) Mouvements induits par la polyactine
4) Pathologie
II) Les myosines
1) Les myosines conventionnelles
2) Les myosines non conventionnelles
3) Exemples d'interactions actine – myosine
3.1) Phénomènes de contraction liés aux myosines conventionnelles
3.2) Phénomènes de contraction liés aux myosines non conventionnelles
III) Les microtubules
1) Caractéristiques
2) Molécules interférant avec les microtubules
3) Les moteurs moléculaires
3.1) Les kinésines
3.1.1) Les kinésines classiques
3.1.2) Les autres kinésines
3.2) Les dynéines
4) Distribution des microtubules dans la cellule
4.1) Structure du centrosome
4.2) Rôle du centrosome
4.3) Formation du monocil
4.4) Les cils vibratiles des cellules ciliées
IV) Les filaments intermédiaires
1) Structure
2) Molécules constituant les filaments intermédiaires
2.1) Les cytokératines
2.2) La vimentine
2.3) Les neurofilaments
3) Rôles des filaments intermédiaires
3.1) Les desmosomes
3.2) Les hémidesmosomes

2
Généralités
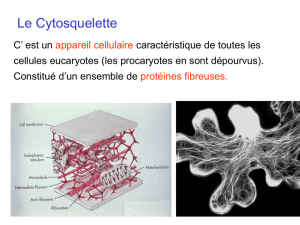
- C’est un ensemble de structures filamenteuses présentes dans le cytoplasme, il va avoir des
rôles important dans la physiologie cellulaire.
- Il intervient dans le maintient de la forme de la cellule mais ausssi dans les déplacements
cellulaires, dans la signalisation, dans le transport de certaines molécules, dans le transport
des vésicules et de certains organites.
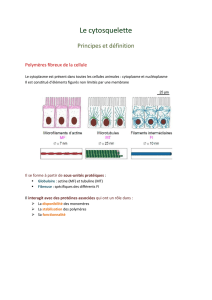
- Il en existe trois sortes : - les microfilaments d'actine de 6à7 nm de diamètre
- les microtubules de 25 nm de diamètre
- les filaments intermédiaires de 8 à 10nm de diamètre
I) Les microfilaments ou filaments d'actine
1) Caractéristiques
- Les microfilaments ont un diamètre de 6 à 7 nm.
- Il existe trois formes d'actine : l'actine dans les cellules musculaires mais il existe aussi
d’autre isoformes qui sont les actines et dans les autres cellules.
- Elle représente 20% de la masse totale du muscle dans les cellules musculaire.
- L'actine se présente sous forme d'une protéine globulaire, l'actine G qui est le monomère de
l'actine filamenteuse elle a la forme d’une cacahuète avec un site de fixation de l’ATP, elle est
donc polarisée
- Les molécules d'actine G s'associent pour former deux brins qui s'enroulent l'un autour de
l'autre, constituant l'actine F, l’actine G étant polarisée, le brin l’est aussi.
DESSIN
- La molécule d'actine présente une extrémité +, où la polymérisation est rapide et une
extrémité – où la polymérisation est 5 à 10 fois plus lente.
-Pour observer ces microfilaments d’actine on a pu utiliser deux méthodes :
- Immunocytochimie avec anticorps dirigés contre les isoformes présents dans la cellule
- Test cytochimique sur interaction basée entre l’actine et la myosine.
2) Régulation de la polymérisation
2.1) In vitro
- La polymérisation in vitro nécessite l'action d'une actine G ATPase et d'ion Mg2+.
- L'ATP se fixe à l'actine G et permet sa polymérisation au filament d'actine F existant.
L’actine fixe de l’atp donc en présence d’actine G d’ATP et de mg2+ on observe la création
d’un filament. L’actine ayant fixée l’ATP va s’associer aux deux extrémités du filament mais
avec une affinité plus grande pour l’extrémité + du filament. Progressivement l’ATP va être
hydrolysé en ADP et l’actine va se dissocier du filament.
DESSIN
actine G + ATP actine G – ATP actine G – ADP + Pi
On distingue une extrémité barbelée (+) et une extrémité pointue (-)
On peut interférer avec la formation des filaments avec des substances d’origine fongique qui
va perturber la dynamique :

3
- cytochalasine : qui va se fixer à l’extrémité + et empêcher la polymérisation du filament.
- La phalloïdine qui empêche la polymérisation
2.2) In vivo
Dans la cellule, l'actine est associée à de nombreuses protéines et c'est cette association qui
régule la quantité de filament.
Protéines de séquestration de monomères
Thymosine et Profiline
- Ce sont des facteurs responsables de la régulation de la quantité d'actine F et donc de la
concentration en actine dans certaines régions données du cytoplasme.
- Si on augmente la concentration en séquestrine il y aura peu de filaments créés de novo mais
ils permettent néanmoins la mobilisation rapide de l’actine pour l’élongation.
- L'association de ces protéines empêche la polymérisation et permet de conserver une réserve
d'actine G disponible dans le cytoplasme.
Protéines de coiffe
- Les microfilaments sont stabilisés par leurs extrémités, ce qui permet un contrôle de la
longueur des molécules d'actine F.
- Selon le type cellulaire, elles peuvent s'associer à l'extrémité + et stabiliser le filament
(exemple de Cap Z) ou l'extrémité – (exemple de la tropomoduline).
Protéines favorisant la polymérisation :
Les profilines favorisent l’échange ADP -> ATP
Protéines de nucléation :
Il y a 2exemples :
- Facteur de nucléation et facteur le stimulant (ARP 2/3 et N-WAS) :
Il va y avoir formation de filaments s’attachant à un prééxistant
Ainsi il y aura formation de réseau de filaments branchés
DESSIN
Cette réaction n’est pas spontannée et nécessite un facteur de nucléation
- Formines : elles se lient à l’actine et permettent la formation d’un filament, ici le
facteur avance vers l’extrémité + lors de la constitution du filament, il y aura alors
formation d’un filament linéaire
Facteurs d’élongation :
Il s’agit de protéines nécessaires pour empêcher les protéines de coiffe d’arrêter la croissance
des filaments :
- Formines
Dessin :

4
Protéines d'association : faisceaux et réseaux (assamblage de filaments)
- Elles constituent des ponts entre les microfilaments par l'intermédiaire de deux zones
d'ancrage.
- Elles permettent la constitution de différents types de faisceaux selon les protéines :
- des faisceaux serrés (microvillosités)
- des faisceaux plus larges (cellules musculaires).
- Les espaces entre les microfilaments sont plus ou moins importants en fonction de la
longueur de la protéine : la villine et la fimbrine sont des protéines de pontages courtes, l'
actinine est longue.
DESSIN
- La structure des réseaux est beaucoup plus large et plus souple que celle des faisceaux.
- Cette structure est responsable de l'aspect de gel du cytoplasme.
La formation de faisceaux est due à la filamine, qui crée un réseau tridimensionnel dans le
cytoplasme et donne un aspect de gel.
DESSIN
Protéines d'attache à la membrane cytoplasmique : ancrage
- Elles constituent le réseau sous cortical ou cortex de la cellule en permettant l'ancrage de
l'actine au niveau du cortex cellulaire.
- Exemple de la spectrine des globules rouges et de la dystrophine des cellules musculaires
striées.
- Les techniques de marquages en immunochimie permettent de révéler la présence de ces
protéines dans le réseau sous cortical.
- Elle solidarise le réseau de filaments d’actine avec la membrane, lors d’anomalies
génétiques on fera un test diagnostic pour la dystrophie de Duschene, il n’y aura pas de
marquage autour de la cellule.
Dessin :
Protéines de coupure
- Elles clivent les microfilaments en petits fragments ce qui transforme la structure de gel en
structure de solution semi-liquide (transition gel sol) : gelsoline, séverine, fragemine.
Substances exogènes
Ce sont des protéines fongiques :

5
- La cytochalasine démantèle le cytosquelette en s'attachant à l'extrémité + du filament et
empêche la polymérisation.
- La phalloïdine maintient la forme polymérisée en bloquant la dépolymérisation.
3) Rôle du filament d'actine
3.1) Formation des jonctions stables
- Les microfilaments participent à la formation des jonctions stables : de type zonula
adhérens.
Au ME :
- La jonction se fait grâce à une liaison homotypique des cadhérines en présence de Ca2+,
ainsi que de protéines d’attache membranaires, ces cadhérines sont reliées aux microfilaments
d’actine par un ensemble de protéines d’attaches
- La jonction entre les cadhérines et le cytosquelette se fait par l'intermédiaire des caténines.
En coupe :
Les caténines jouent un double rôle :
- Elles interviennent dans l’attache de l’actine à la membrane
- Elles interviennent dans un rôle de molécule de signalisation
3.2) Les microvillosités des entérocytes au pôle apical
- La microvillosité est une structure en doigt de gant que l'on trouve entre autre au niveau de
la membrane apicale des cellules intestinales.
- On distingue une striation au pôle apical de la cellule, un test au PAS est positif et révèle la
présence de glycocalix de surface membranaire.
- C'est une expansion de la membrane contenant 20 à 30 filaments d'actine associés en
faisceaux.
- Ces filaments sont reliés entre eux par la villine et la fimbrine.
- L'extrémité + est noyée dans une coiffe protéique, dans la partie haute de la microvillosité.
- L'extrémité – des filaments plonge dans le cortex cellulaire : c'est le réseau terminal.
- Au niveau de leurs faces latérales, les filaments interagissent avec la membrane
cytoplasmique par l'intermédiaire d'une petite protéine motrice, la myosine de type I associée
à la calmoduline.
DESSIN
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%