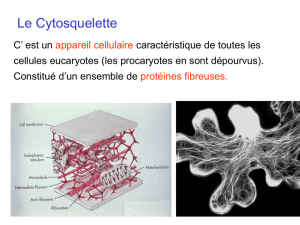
Le Cytosquelette

TUTORAT DE SANTE DE
MONTPELLIER-NIMES
Stage pré-universitaire
2011-2012

Ensemble de structures filamenteuses ou tubulaires à
l’intérieur d’une cellule ayant pour fonction
principale de maintenir la forme de la cellule
Le Cytosquelette
CYTO - SQUELETTE : le squelette de la cellule

Structure de base :
Monomères
(sous unité)
Protofilaments Elément du cytosquelette
(un os de la cellule)
Liaison longitudinale (zone de fragilité)
Liaison latérale
décalage
Le décalage permet de renforcer les zones de fragilité
Zone de fragilité

3 éléments le constitue :
Présent en périphérie du noyau

Monomère (SU) = Actine
2 protofilaments
Monomère (SU) = dimère de tubuline
13 protofilaments
Monomère (SU) = Tétramère
8 protofilaments
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%








![BC P1 chap 2 cytosque#B316D.ppt [Lecture seule]](http://s1.studylibfr.com/store/data/004916234_1-40884ce69084ca8e76492344fb5743d8-300x300.png)
