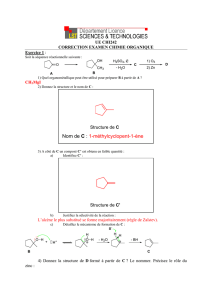
GROUPE s
publicité

Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
Qu’est ce que la chimie en PCEM1 ?
1. Objectifs de la matière
Etudier la structure de l’atome, des molécules et les réactions de chimie organique.
C’est une matière qui allient apprentissage, compréhension et réflexion (+++).
2. Les cours à la faculté
Pr Chap assure les cours magistraux. Les TD sont organisés par d’autres professeurs
(QCM)
Livres possibles : Traité de chimie organique ou le Paul Arnaud (le cours du Pr. Chap
est extrêmement complet, ne pas perdre un temps inconsidéré pour aller chercher des
informations ailleurs, tout est dans le cours !)
Support : Toutes les diapositives des cours magistraux sont fournies dans des
polycopiés. Conseil pratique : découper les diapositives et les coller au fur et à mesure
de l’avancement du cours.
3. Modalités de contrôle de connaissances
15 QCM en 1H, peu de QCM de cours purs, beaucoup d’exercices où les notions vues
en cours sont indispensables.
Les sujets sont parfois longs, il faut être sûr de soi et méthodique face à un exercice,
surtout ne pas paniquer.
Importance de l’entraînement en TD qui montre le raisonnement à faire sur des
exercices types.
4. Le programme
Atomistique : étude des atomes, de leurs compositions, de leurs configurations, de
leurs classifications, leurs interactions et leurs assemblages formant des molécules.
Chimie organique générale : c’est la chimie du carbone, étude des structures de
composés organiques, leurs nomenclatures, leurs formules, leurs représentations et
leurs réactivités.
Chimie organique descriptive : études des réactions entre les différentes fonctions.
5. Comment travailler sa chimie ?
La prise de note en cours : Le cours est projeté sous forme de diapositives. Les
commentaires du Pr. Chap sont d’une importance cruciale. S’il y a bien un cours où il
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
1/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
faut comprendre ce que l’on prend en note, c’est la chimie !! Surtout ne pas reprendre
en note ce qui est projeté, c’est de la perte de temps. Captez les paroles du professeur :
s’il dit qu’il n’y a rien à retenir :ne pas retenir, s’il dit qu’il faut apprendre par cœur,
apprendre par cœur … Le professeur Chap fait ce qu’il dit !
L’apprentissage des cours : Apprendre son cours au jour le jour (+++), prendre le
moins de retard possible. En effet le fait d’apprendre son cours le jour même (groupe
du matin) ou le lendemain permet de se souvenir du cours en lui-même, donc
l’apprentissage ne commence pas de zéro. Avoir 15 jours de retard signifie n’avoir
plus aucun souvenir du cours en question. De plus avoir acquis les notions du cours
précédent permet de mieux aborder le cours magistral, en effet les cours de chimie
suivent une progression logique et il est inconcevable d’aborder des notions sans
avoir acquis ce qui a été précédemment abordé (contrairement à d’autres matières où
les chapitres peuvent ne rien à voir les uns avec les autres).
L’entraînement aux QCM : la base de données la plus précieuse se trouve dans les
annales (seulement janvier 2007 en chimie) et dans les QCM proposés en TD.
Conseil pratique : garder le concours de 2007 sous la main et ne le faire qu’en période
de révisions. En effet c’est le seul sujet de type concours élaboré par le Pr. Chap et il
serait dommage de l’aborder sans pouvoir le faire en condition de simulation de type
concours.
Présence en TD, en effet les exercices ne sont que sommairement abordé dans le cours
magistral, les enseignements dirigés sont faits pour s’entraîner. Conseil pratique :
préparer les TD à l’avance en faisant les QCM car le rythme des TD est élevé. Ne pas
hésiter à poser des questions aux enseignants, ils sont très compétents.
6. Expérience personnelle des tuteurs en chimie.
Atomistique, qu’est ce qu’un atome ?
1. Définitions
* L’atome est constitué d'un noyau composé de protons et de neutrons (formant les nucléons)
autour desquels gravitent des électrons :
. les protons possèdent une charge q = +1 : ils sont positif
. les neutrons (comme leur nom l’indique) sont neutres : q = 0
. le champ électronique périphérique est composé d’électrons chargés négativement
q = -1
Il faut noter que :
- la masse du neutron et celle du proton sont quasiment identiques
- l’électron a une masse environ 2000 fois inférieure à celle d’un nucléon (1836)
- tout atome est électriquement neutre, c'est-à-dire qu’il possède autant de protons que
d’électrons. Si les charges ne sont pas égalisées, on parle d’ions.
Ex : Cl- est un anion ; Na+ est un cation ; Cl et Na sont des atomes.
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
2/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
* Le nucléide est l’espèce atomique définie par : AZX
avec : A = nombre de masse = nombre de nucléons
Z = numéro atomique = nombre de protons (ou d’électrons)
A – z = nombre de neutrons
* L’élément est défini par : ZX . C’est l'ensemble des atomes qui possède le même nombre
de protons dans leur noyau.
* Les isotopes d’un même élément sont les nucléides ayant Z identique mais A différents.
Ex : Hydrogène
1
1
H
Deutérium
2
1
H
Tritium
3
1
H
Remarque : Les propriétés physiques d’un atome découlent de son noyau alors que les
propriétés chimiques d’un atome découlent de sa couche électronique la plus périphérique
également appelée couche de valence. Les isotopes d’un même élément possèdent donc les
mêmes propriétés chimiques mais diffèrent par leurs propriétés physiques.
Ex : 3H
14
C
32
P
131
I sont des isotopes radioactifs.
2. Quantifications
* La mole (mol) est l'unité physique et chimique de quantité de matière. La mole correspond à
la quantité de matière d'un système contenant autant de particules individuelles (atomes,
molécules ou ions) qu'il y a d'atomes dans 12 g de carbone 12C.
Ce nombre est le nombre d’Avogadro NA = 6,022•1023
Millimole (mmol)
Micromole (mmol)
Nanomole (mmol)
Picomole (mmol)
Femtomole (mmol)
Attomole (mmol)
1mmol = 10-3 mol
1umol = 10-6 mol
1nmol = 10-9 mol
1pmol = 10-12 mol
1fmol = 10-15 mol
1amol = 10-18 mol
6,022•1020 Atomes
6,022•1017 Atomes
6,022•1014 Atomes
6,022•1011 Atomes
6,022•108 Atomes
6,022•105 Atomes
* Le molaire (M) est l'unité de concentration utilisée : 1 M = 1 mol/l
Ex : 1 mM = 10-3 M = 6,022•1020 Atomes/l = 6,022•1017 Atomes/ml
* L’unité de masse atomique (u.m.a.) est définie comme 1/12 de la masse d'un atome du
nucléide 12C, sachant qu’une mole de 12C pèse 12g.
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
3/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
Donc un atome de 12C a une masse de 12 u.m.a. et si on prend NA de 12C, on aura une masse
de 12 g. Une u.m.a. vaut approximativement 1,66054 × 10-27 kg (valeur à ne pas retenir).
Par conséquent : 1 u.m.a X NA = 1 g
* La masse atomique moyenne d’un élément est la masse moyenne de cet élément en u.m.a.
en prenant compte de l’abondance de ses différents isotopes. Il faut retenir que la masse
moyenne atomique d’un élément est différente du nombre de masse (même si extrêmement
proche).
Structure de l’atome
1. Les orbitales atomiques :
Les électrons gravitent autour du noyau de l’atome, formant ainsi des couches
électroniques. Contrairement à ce que l’on pourrait penser, on ne considère pas que les
électrons gravitent autour du noyau sur une orbite (comme la terre gravite autour du soleil),
on considère qu’ils gravitent de façon indescriptible autour du noyau.
Par conséquent, il est impossible de connaître la position exacte de l’électron autour du
noyau mais il est possible de déterminer un volume dans lequel la probabilité de présence de
l’élection est de plus de 95% : l’orbitale atomique.
Remarque : Une orbitale va pouvoir contenir au maximum deux électrons (cf les nombres
quantiques) ; ainsi, plus l’atome contiendra d’électrons, plus il y aura d’orbitales.
2. Les nombres quantiques :
Pour définir une orbitale atomique, on utilise 3 nombres quantiques : on dit que l’orbitale est
définie par {n ; l ; m}.
1. Le nombre quantique principal ou n
- définit le niveau d’énergie de l’orbitale
Par correspondance avec ce qui a été vu au lycée, on peut associer la couche K ( la plus
interne ) au nombre quantique n = 1, L au nombre n = 2, M au nombre n = 3, etc …
- n est un nombre entier et non nul n ≥ 1
2. Le nombre quantique secondaire ou l
- définit la forme de l’orbitale
- l est un nombre entier défini tel que 0 ≤ ℓ ≤ n-1
A chaque valeur de l, on associe une lettre qui caractérise la forme de l’orbitale :
- ℓ = 0 on parle d’une orbitale de type s
- ℓ = 1 on parle d’une orbitale de type p
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
4/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
- ℓ = 2 on parle d’une orbitale de type d
- ℓ = 3 on parle d’une orbitale de type f
3. Le nombre quantique magnétique ou m
- définit l’orientation de l’orbitale
- m est un nombre entier défini tel que -ℓ ≤ m ≤ +ℓ
Exemples___________________________________________________________________
.n=1
D’où l ne peut prendre que la valeur 0 ( 0 ≤ ℓ ≤ n-1 )
D’où m ne peut prendre lui aussi que la valeur 0 ( -ℓ ≤ m ≤ +ℓ )
ainsi, au niveau d’énergie 1, il existe 1 orbitale de type s définie par les nombres
quantiques {1 ; 0 ; 0}.
.n=2
D’où ℓ peut prendre les valeurs 0 et 1
D’où m peut prendre les valeurs 0 si ℓ = 0
-1 ; 0 ; 1 si ℓ = 1
ainsi, au niveau d’énergie 2, il existe :
1 orbitale s définie par les nombres quantiques {2 ; 0 ; 0}
3 orbitales p définie par les nombres quantiques {2 ; 1 ; -1}, {2 ; 1 ; 0} et {2 ; 1 ; 1}
soit au total 4 orbitales.
EXERCICE _________________________________________________________________
Faire la même chose pour n = 3 et n = 4.
___________________________________________________________________________
Formes des orbitales atomiques :
a. orbitales de type s : leur volume est celui d’une sphère centrée sur le noyau de
l’atome. Ces orbitales présentent donc une symétrie sphérique.
http://www.monografias.com/trabajos/estruatomica/estruatomica.shtml
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
5/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
b. orbitales de type p : chacune des orbitales p est composée de deux lobes orientés
sur un même axe. Chacune de ces orbitales présente donc une symétrie axiale.
http://www.monografias.com/trabajos/estruatomica/estruatomica.shtml
Pour chaque valeur de n (excepté n = 1 ), donc pour chaque niveau à partir de n = 2, il
existe 3 orbitales p :
http://www.eis.uva.es/~qgintro/atom/tutorial-11.html
Perpendiculairement à l’axe qui définit l’orbitale, on trouve le plan nodal, où la
probabilité de trouver l’électron est nulle.
http://wps.prenhall.com/wps/media/objects/439/449969/Media_Portfolio/ch05.html
c. orbitales de type d : forme complexe, il en existe 5 par niveau à partir de n = 3
d. orbitales de type f : forme complexe, il en existe 7 par niveau à partir de n = 4
3. Configuration des atomes polyélectroniques :
Pour connaître la configuration électronique d’un atome, il faut connaître les règles de
remplissage des orbitales ; elles sont au nombre de 3 :
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
6/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
a. Principe d’exclusion de Pauli :
2 électrons d’un même atome ne peuvent pas avoir leurs 4 nombres quantiques
identiques.
Or, 2 électrons placés dans une même orbitale ont obligatoirement leurs 3 premiers nombres
quantiques {n ; ℓ ; m} identiques.
C’est pourquoi on introduit un 4ème nombre quantique : le nombre quantique de spin ou s.
Ce nombre renseigne sur le comportement de l’électron dans le champ magnétique externe.
Il ne peut prendre que 2 valeurs : ±½
À retenir :
une orbitale est définie par 3 nombres quantiques {n ; ℓ ; m}
un électron est défini par 4 nombres quantiques {n ; ℓ ; m ; s}
une orbitale contient au maximum 2 électrons, de spins opposés.
Pour représenter schématiquement les orbitales, on utilise des cases quantiques ainsi que des
flèches pour représenter les électrons qui s’y trouvent (les flèches sont de sens opposés pour
schématiser les spins opposés des électrons).
case vide =
orbitale vacante
orbitale contenant
1 e célibataire
orbitale contenant
2 e appariés
b. Principe de stabilité :
A l’état fondamental (c’est à dire non excité), un atome est toujours à son niveau
énergétique le plus bas.
Ainsi, pour remplir les orbitales avec les électrons, on commencera par la couche la plus
interne ( la plus proche du noyau ) c’est à dire celle dont l’énergie est la plus faible, en allant
vers les couches les plus externes, les plus énergétiques.
On dit que l’on remplit les orbitales par ordre croissant d’énergie.
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
7/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
Pour cela, on utilise la règle de Klechkowski qui ordonne les orbitales selon leur niveau
énergétique :
Ordre :
1s > 2s > 2p > 3s > 3p >
4s > 3d > 4p > 5s > 4d >
5p > 6s > 4f > 5d > 6p >
7s > 5f > 6d > 7p > …
http://fr.wikipedia.org/wiki/Klechkowski
Ainsi, sachant que l’on peut mettre au maximum 2 électrons par orbitale, et qu’il existe, pour
les niveaux correspondants, 1orbitale s, 3orbitales p, 5orbitales d et 7orbitales f, on obtient un
ordre de remplissage tel que :
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6…
c. Règle de Hund :
Aussi appelée règle du spin maximal.
Pour des orbitales ayant la même énergie donc ayant les mêmes nombres quantiques n
et ℓ, les électrons se répartissent avec un nombre maximum de spins parallèles.
En fait, cela signifie que par exemple pour remplir des orbitales de type p :
ici, on a rempli entièrement la
1ère orbitale avant les autres
2 électrons de spins parallèles
ici, on a rempli en respectant
la règle de Hund
3 électrons de spins parallèles
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
8/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
Remarque : attention, la règle de Hund ne concerne que les orbitales ayant la même énergie ;
par exemple, le bore (Z = 5) possède 5 électrons, sa structure électronique est donc 1s²2s1p²
1s
;
2s
2p
Nous n’avons pas le droit d’appliquer la
règle de Hund entre les orbitales 2s et 2p afin
d’avoir 3 électrons à spins parallèles
car les orbitales 2s et 2p n’ont pas le même
niveau d’énergie.
! EXCEPTIONS : il existe 2 cas particuliers qui ne répondent pas à la règle de Hund :
(pour des raisons de stabilité )
ns2[…](n+1)s2nd4
devient
ns2[…](n+1)s1nd5
ns2[…](n+1)s2nd9
devient
ns2[…](n+1)s1nd10
Exemple____________________________________________________________________
Donner la structure électronique du cobalt ( Z = 27 ).
le cobalt a 27 électrons, on remplit donc les orbitales par ordre croissant d’énergie, en
respectant la règle de Hund et on obtient : 1s22s22p63s23p64s23d7
1s
2s
2p
3s
3p
4s
3d
! si l’on remplit les orbitales par ordre croissant d’énergie, lorsque que l’on donne la
configuration d’un atome, on note les orbitales de la plus interne à la plus externe !
Ainsi pour notre exemple, on doit noter comme configuration : 1s22s22p63s23p63d74s2
1s ; 2s
2p
; 3s
3p
3d
; 4s
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
9/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
EXERCICE__________________________________________________________________
Donner la structure électronique des éléments suivants :
C (Z = 6)
Ne (Z = 10)
Cu (Z = 29)
___________________________________________________________________________
À noter : nous nous intéresserons aux électrons les plus externes de l’atome, encore appelés
électrons de valence ; ce sont eux qui donneront les propriétés chimiques à l’atome en
permettant les liaisons avec d’autres atomes.
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
10/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
Classification périodique des éléments
Mendeleïev a classé les éléments dans un tableau qui respecte l’ordre des niveaux d’énergie
de Klechkowski ; il est composé de 7 lignes = 7 périodes
18 colonnes = 18 familles d’éléments
Chaque case du tableau correspond à un élément.
Les éléments qui figurent sur une même ligne possèdent le même nombre de couches
électroniques ( par exemple, 1 pour l’hydrogène et l’hélium ).
Ceux qui figurent sur une même colonne ont le même nombre d’électrons sur leur couche
externe ( par exemple, 1 électron externe pour l’hydrogène et le lithium ), ils présentent donc
des propriétés similaires, c’est pourquoi on parle de familles d’éléments.
Période
Configurations des éléments de la période
Nb d’éléments
de la période
N° atomique du dernier
élément de la période
1
2
3
4
5
6
7
1s2
2s22p6
3s23p6
4s23d104p6
5s24d105p6
6s24f145d106p6
7s25f146d107p6
2
8
8
18
18
32
32
2
10
18
36
54
86
118
1. Les groupes d’éléments :
En remplissant le tableau, on a formé des groupes d’éléments dont les électrons les plus
externes sont situés dans des orbitales de même nature :
- groupe s : H, Li, Be, Na, Mg, K, Ca, …
- groupe p : He (exception), B, C, N, O, …
- groupe d : Sc, Ti, V, Cr, Mn, …
- groupe f = cas particuliers des lantamides et des actinines : pour les périodes 6 et 7,
nous savons qu’il y a l’apparition des orbitales f. Cependant, le tableau ne contient que
18 colonnes, et non 32 comme il en faudrait. C’est pourquoi les éléments dont les
électrons de la couche externe se trouvent dans des orbitales de type f sont rassemblés
à l’extérieur du tableau ( cf les 2 lignes en bas du tableau ) sauf pour 2 d’entre eux qui
constituent des exceptions :
le lanthane La ( Z = 57 ) devrait avoir une configuration électronique telle
que : 1s2 […] 5p66s24f1 mais possède à la place : 1s2 […] 5p66s25d1
Il est alors placé dans la première colonne du groupe d.
Les éléments suivants ( de Z = 58 à Z = 81 ) respectent eux les règles de
remplissage et appartiennent alors au groupe f : ce sont les lanthanides.
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
11/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
l’actinium Ac ( Z = 89 ) de même possède une configuration électronique
telle que : 1s2 […] 6p67s26d1 ( au lieu de 5f1 ) et appartient donc lui aussi au
groupe d.
Les éléments suivants ( de Z = 90 à Z = 103 ) respectent eux les règles de
remplissage et appartiennent alors au groupe f : ce sont les actinides.
cf. Classification périodique des éléments : les groupes.
2. Les familles d’éléments :
Comme nous l’avons vu, une colonne correspond à une famille d’éléments, aux propriétés
chimiques similaires. Nous devons retenir certaines familles :
- les alcalins = colonne 1 : leur configuration électronique se termine par ns1
ATTENTION l’hydrogène ( Z = 1 ) n’en fait pas partie.
-
les alcalino – terreux = colonne 2 : leur configuration électronique se termine par
ns2
-
les gaz rares = colonne 18 ( présentent l’inertie chimique la plus forte ) : leur
configuration électronique se termine par np6
-
les halogènes = colonne 17 : leur configuration électronique se termine par np5
-
les métaux de transition = colonnes 3 à 12 : attention, il existe 2 versions sur la
définition d’un métal de transition :
a. c’est un élément qui appartient au groupe d : ici, la colonne 12 appartient aux
éléments de transition
b. c’est un élément qui possède des électrons dans une orbitale d ou f incomplète :
ici, la colonne 12 n’est pas comprise dans cette famille
cf. Classification périodique des éléments : les familles.
___________________________________________________________________________
Comment connaître le groupe, la famille et la période d’un élément dans la classification
en fonction de son numéro atomique ?
En fait, on veut connaître sa position exacte dans le tableau de Mendeleïev.
Exemple : Iode ( Z = 53 ).
Nous connaissons le nombre maximal d’électrons pour chaque période :
n = 1 2 Ainsi, le dernier élément de cette période a un Z = 2
n=28
‘’
Z = 2+8 = 10
n=38
‘’
Z = 2+8+8 = 18
n = 4 18
‘’
Z = 2+8+8+18 = 36
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
12/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
n = 5 18
‘’
Z = 36+18 = 54
L’Iode est donc placé dans la 5ème période (5ème ligne de la classification) et dans la 17ème
colonne (36 + 17 = 53 ) ; il appartient donc à la famille des halogènes.
Chimie Organique Générale
La chimie organique est une branche de la chimie qui concerne l’étude et la description de
molécules essentiellement composé de Carbone 126C (on l’appelle également chimie du
carbone) : ce sont les composés organiques. Les autres éléments les plus abondant sont H, O,
N.
La chimie organique est entre autre la chimie du vivant, que l’on oppose à la chimie minérale.
1. Formules brutes, formules semi développés et formules topologiques.
Molécule
Butane
Pentan-1-ol
Pentan-2-ol
Formule
Brute
C4H10
C5H12O
C5H12O
Formule Plane
H H H H
| | | |
H-C-C-C-C-H
| | | |
H H H H
H
|
O H H H H
| | | | |
H-C-C-C-C-C-H
| | | | |
H H H H H
H
|
H O H H H
| | | | |
H-C-C-C-C-C-H
| | | | |
H H H H H
Formule semi développée
Formule
Topologique
CH3-CH2-CH2-CH3
où
CH3-(CH2)2-CH3
CH3-CH2-CH2-CH2-CH2OH
CH3-CHOH-CH2-CH2-CH3
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
13/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
2. Chaînes linéaires aliphatiques & leurs radicaux
Chaînes linéaires aliphatiques
CH4
CH3-CH3
CH3-CH2-CH3
CH3-(CH2)2-CH3
CH3-(CH2)3-CH3
CH3-(CH2)4-CH3
CH3-(CH2)5-CH3
CH3-(CH2)6-CH3
CH3-(CH2)7-CH3
CH3-(CH2)8-CH3
CH3-(CH2)9-CH3
CH3-(CH2)10-CH3
CH3-(CH2)18-CH3
CH3-(CH2)19-CH3
CH3-(CH2)20-CH3
CH3-(CH2)22-CH3
Groupes alkyles
Radicaux (chaîne
carboné)
Methyl
Ethyl
Propyl
Butyle
Pentyle
Hexyle
Heptyle
Octyle
Nonyl
Décyle
Undécyl
Dodécyle
Méthane
Ethane
Propane
Butane
Pentane
Hexane
Heptane
Octane
Nonane
Décane
Undécane
Dodécane
Eicosane
Heinecosane
Docosane
Tetracosane
3. Dénomination des carbones
Un carbone primaire est lié à un seul autre carbone (et donc à 3 autres substituants).
Un carbone secondaire est lié à 2 autres carbones (et donc à 2 autres substituants).
Un carbone tertiaire est lié à 3 autres carbones (et donc à un seul substituants).
Un carbone quaternaire n’est lié qu’à des carbones.
Ex :
CH3
H3C
C
CH
CH3
CH3
CH2
CH3
4. Quelques radicaux fréquemment rencontrés …
Methyl
H3C
R
Ethyl
H3C
CH2
Vinyl
R H2C
CH
Propyl
R H3C
CH2 CH2
R
Isopropyle (iPr)
H3C
CH
R
H3C
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
14/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
Butyle primaire (nBu)
H3C CH2
CH2
CH2
R
Butyle secondaire
(sBu)
H3C CH2
CH
Butyle Tertiaire
(tBu)
CH3
R
H3C
H3C
C
R
Isobutyle (iBu)
H3C
CH
CH2
H3C
CH3
5. Les principales classes fonctionnelles
Une fonction est un groupement d’atomes que l’on rencontre dans les molécules. Toutes les
molécules qui possèdent ce même groupement vont avoir des propriétés chimiques
semblables.
Alcanes : molécules saturées (sans double ou triple liaison) ne comportant que des
atomes de carbone et d’hydrogène.
H3C
CH3
ethane
Préfixe : Aucun
Suffixe : -ane
Alcènes : Molécules insaturées ne comportant que des atomes de carbone et
d’hydrogène
H3C
CH
CH2
Propyl-1-ène
Préfixe : Aucun
Suffixe : -ène
Remarque : pour la triple liaison on parle d’alcyne (suffixe –yne).
Dérivés halogénés : molécules comportant un atome de la famille des halogène (avant
dernière colonne de la classification : F, Cl, Br, I, At) les halogènes sont aussi
représentés par la lettre X
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
15/21
R
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
H3C
X
H3C
Cl
Préfixe : Fluoro, Bromo, Chloro ….
Suffixe : JAMAIS
Les amines : Présence de dérivés de NH3 sur une chaîne carbonée (attention l’azote
ne doit pas établir de double liaison)
Amine Primaire
Amine Secondaire
R
H3C
CH2
NH2
NH
CH2
Amine Tertiaire
CH3
CH3
H3C
N
Amine Quaternaire
CH3
CH3
+
H3C
N
CH3
CH3
Préfixe : aminoSuffixe : -amine
Alcools : présence du groupement OH sur un carbone (il est à noter que ce carbone ne
doit pas établir de double liaison avec un autre élément)
Alcool Primaire
R
CH2
Alcool Secondaire
CH3
OH
HC
Alcool Tertiaire
CH3
OH
H3C
CH3
C
OH
CH3
Préfixe : hydroxySuffixe : -ol
Les aldéhydes et cétones :
Fonction
Aldéhydes
R
C
R
O
H
Radicaux
Préfixe
Cétones
R
O
formyl-
oxo- ou céto-
-al
-one
Suffixe
C
Les nitriles :
R
C
N
Préfixe : cyano Suffixe : -nitrileLes Amides :
O
R
C
NH2
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
16/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
Préfixe : amidoSuffixe : -aminde
R
Les acides carboxyliques :
C
OH
O
Préfixe : carboxy
Suffixe : -oïque (avec ‘acide’ devant)
TABLEAU RECAPITULATIF ET ORDRE HIERARCHIQUE
Groupement
Formule
Préfixe / non prioritaire Suffixe / prioritaire
Acide
R-COOH
carboxy-
-oïque
Amide
R-CONH2
amido-
-amide
Nitrile
R-CN
cyano-
-nitrile
Aldéhyde
R-CHO
formyl-
-al
Cétone
R-CO-R
oxo- ou céto-
-one
Alcool
R-OH
hydroxy-
-ol
Amine
R-NHE
amino-
-amine
Halogénure
F- ; Cl- ; Br- ; I-
fluoro- ….
JAMAIS
Double Liaison
-ène
Triple Liaison
-yne
L’ordre hiérarchique correspond à l’ordre de priorité à utiliser lors de la nomenclature. Si dans
une molécule on retrouve 2 fonctions différentes, celle placée le plus haut dans le tableau sera
prioritaire (il faut donc apprendre le tableau dans l’ordre !!!).
Par exemple, l’acide est prioritaire à l’alcool, l’amide est prioritaire au nitrile ….
6. Les règles de nomenclature.
Il faut trouver la chaîne carbonée la plus longue qui :
o passe par la fonction prioritaire
o englobe le maximum de double ou triple liaison
o possède le maximum de substituant
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
17/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
On numérote la chaîne carbonée en donnant à la fonction principale le plus petit indice
possible. La fonction principale sera nommée en suffixe.
Remarque : si la fonction principale est : acide, amide ou aldéhyde, étant donnée que
ces fonctions ne se trouve qu’en bout de chaîne carboné uniquement, elles seront
automatiquement numérotée ‘1’.
Les liaisons multiples sont toujours données en suffixe, avant la fonction principale (la
double liaison est prioritaire sur la triple). En absence de fonction principale (alcène &
alcyne) la double ou triple liaison reçoit l’indice le plus petit.
Il faut classer les substituant par ordre alphabétique, ils sont notés en préfixes. En
absence de fonction principale et de liaisons multiples (alcane), les substituant
prennent l’indice le plus petit.
Conseil pratique : seul l’entraînement permet de maîtriser la nomenclature, il ne sert à rien de
l’apprendre bêtement par cœur, c’est un mécanisme à acquérir.
7. Exemples
H3C CH2 CH
H3C
CH2 CH2
CH
CH3
CH3
H3C CH2
CH2
CH2
CH2
CH3
CH2 CH CH
CH3
Br
CH3
CH2
CH
CH2
CH2
CH3
H3C
CH
OH
CH2
CH3
C
CH2
CH2
CH2 HC
H2C
CH CH2 CH3
CH2 CH3 CH2
CH3
H3C
CH
H3C
CH2
CH2 CH3
CH3
HC
O
CH
CH3
H3C
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
C
CH2
OH
18/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
H
OH
CH
H3C
C
CH2
CH
CH2
O
CH3
8. Notions d’isomérie
Deux molécules ayant même formule brute mais des formules développées ou semi
développées différentes sont des isomères.
Ex : CH3-CH2-CH2-COOH & CH3-CHOH-CH2-CHO sont C4H8O2
Il y a 3 types d’isomères de constitution :
Isomères de fonction : possède la même formule brute mais des fonctions différentes
(même exemple que ci-dessus).
Isomères de squelette : possède la même formule brute mais des chaînes carbonées
de longueurs différentes.
Ex : butane & methylpropane
Isomères de position : possède la même formule brute et les mêmes fonctions
disposés à des endroits différents.
Ex : butan-1-ol & butan-2-ol
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
19/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
CLASSIFICATION PERIODIQUE DES ELEMENTS : LES GROUPES
1
1
2
3
4
5
6
7
H
3Li
11Na
19K
37Rb
55Cs
87Fr
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
F
17Cl
35Br
53I
85At
117.
He
10Ne
18Ar
36Kr
54Xe
86Rn
118Uuo
1
2
Be
12Mg
20Ca 21Sc 22Ti
23V
24Cr 25Mn 26Fe
27Co
38Sr
39Y
40Zr 41Nb 42Mo 43Tc 44Ru 45Rh
56Ba 57La 72Hf 73Ta
74W
75Re 76Os
77Ir
88Ra 89Ac 104Rf 105Db 106Sg 107Bh 108Hs 109Mt
4
1
2
Ce
90Th
Pr
91Pa
58
59
GROUPE s
3
Nd
92U
60
4
Pm
93Np
61
B
13Al
28Ni
29Cu
30Zn
31Ga
46Pd
47Ag
48Cd
49In
78Pt
79Au
80Hg
81Tl
110Uun 111Uuu 112Uub
113.
5
5
6
7
Sm
94Pu
Eu
95Am
Gd
96Cm
62
63
GROUPE p
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
64
8
9
Tb
97Bk
65
Dy
98Cf
66
10
Ho
99Es
67
C
14Si
32Ge
50Sn
82Pb
114Uuq
6
11
N
15P
33As
51Sb
83Bi
115.
O
16S
34Se
52Te
84Po
116Uuh
12
13
14
Yb
102No
Lu
103Lr
7
Er 69Tm
100Fm 101Md
68
8
70
9
71
GROUPE d
GROUPE f
éléments ou métaux
de transition
lanthanides et
actinides
20/21
Tutorat Associatif Toulousain - Pré-Rentrée Découverte Purpan 2007-2008
CLASSIFICATION PERIODIQUE DES ELEMENTS : LES FAMILLES
1
1
2
3
4
5
6
7
H
3Li
11Na
19K
37Rb
55Cs
87Fr
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
F
17Cl
35Br
53I
85At
117.
He
10Ne
18Ar
36Kr
54Xe
86Rn
118Uuo
1
2
Be
12Mg
20Ca 21Sc 22Ti
23V
24Cr 25Mn 26Fe
27Co
38Sr
39Y
40Zr 41Nb 42Mo 43Tc 44Ru 45Rh
56Ba 57La 72Hf 73Ta
74W
75Re 76Os
77Ir
88Ra 89Ac 104Rf 105Db 106Sg 107Bh 108Hs 109Mt
4
1
2
Ce
90Th
Pr
91Pa
58
alcalins
59
3
Nd
92U
60
4
Pm
93Np
61
B
13Al
28Ni
29Cu
30Zn
31Ga
46Pd
47Ag
48Cd
49In
78Pt
79Au
80Hg
81Tl
110Uun 111Uuu 112Uub
113.
5
5
6
7
Sm
94Pu
Eu
95Am
Gd
96Cm
62
63
alcalino –
terreux
Tous Droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la duplication, la vente, la diffusion partielle ou totale de ce polycopié sont interdites
64
8
9
Tb
97Bk
65
Dy
98Cf
66
10
Ho
99Es
67
gaz rares
21/21
C
14Si
32Ge
50Sn
82Pb
114Uuq
6
11
N
15P
33As
51Sb
83Bi
115.
O
16S
34Se
52Te
84Po
116Uuh
12
13
14
Yb
102No
Lu
103Lr
7
Er 69Tm
100Fm 101Md
68
8
70
9
71
halogènes