discussions - African Index Medicus

Journal de la Société de Biologie Clinique
page 54
Journal de la Société de Biologie Clinique, 2005; N° 009 : 54-60
ASPECTS MORPHOLOGIQUES DE L’EFFET DE L’HYDROXYANISOL BU-
TYLE SUR L’HYPERPLASIE THYROIDIENNE CHEZ LA SOURIS ICR
LALEYE A. et DARBOUX R. B.
Unité de Biologie Humaine, Faculté des Sciences de la Santé, Cotonou, Bénin ; 01 BP188 Cotonou,
Bénin Tél 00229 2138 41 90, Fax 00 229 21 38 09 38 ; e mail : cytogen@intnet.bj ou laleyec@yahoo.fr
RESUME
Ce travail avait pour objet d'étudier, en utilisant une approche morphologique l'effet du BHA sur l'hy-
perplasie thyroïdienne induite chez la souris ICR par un régime carencé en iode et l'administration de
PTU ou de perchlorate.
Nous avons observé, que le BHA a un effet antigoitrigène chez les souris traitées au LID et PTU; il
induit une réduction du volume relatif de l'épithélium, une réaccumulation du colloïde, une réduction
de la prolifération cellulaire et une réduction de la vasodilatation
Par ailleurs, le BHA induirait une augmentation de l'interstitium non vasculaire pour une raison qu'il
reste à élucider.
La confrontation de nos observations avec certains aspects de la physiologie thyroïdienne nous fait
évoquer deux hypothèses pour expliquer l'action vasodilatation du BHA sur la cellule thyroïdienne,
une inhibition de la sécrétion de TSH par l'hypophyse ou une résistance de la glande à la TSH.
D’autres études fonctionnelles devront élucider ce point.
Mots-clés : goitrigenèse, hydroxyanisol butylé, antioxydant
SUMMARY
The aim of this work was to study, using morphological approaches, effects of BHA on thyroid hyper-
plasia induced in ICR mice by a lown iodide diet and PTU or perchlorate administration.
We observed, that BHA has a antigoitrogene effect in the mice treated with LID and PTU; it induces a
reduction of the relative volume of the epithelium, a accumulation of colloid, a reduction of the cellular
proliferation and of the vasodilatation. In addition, BHA would induce an increase in nonvascular inter-
stitium for a reason which it remains to elucidate.
The confrontation of our observations with certain aspects of thyroid physiology makes us bring up two
assumptions to explain the action vasodilatation of BHA on the thyroid cell, an inhibition of TSH secre-
tion by the pituitary gland or a resistance of gland to the TSH. Other functional studies will have to
elucidate this point.
Key-words : goitrigenesis, butylated hydroxyanisol, antioxidant
INTRODUCTION
Le goitre hyperplasique, élargissement de la
glande thyroïde, est un véritable problème de
santé publique dans nos régions où l’apport
iodé journalier est inférieur à 50µg. Il se carac-
térise par des modifications morphologiques et
fonctionnelles de la glande. On assiste non
seulement à une hyperplasie et une hypertro-
phie des cellules folliculaires mais la proliféra-
tion des cellules endothéliales et la vasodilata-
tion constituent la modification thyroïdienne la
plus précoce (1). La quantité de collagène est
aussi accrue et les septa conjonctifs épaissis ;
la glande peut alors doubler son poids. Cette
carence iodée induit l’activation de la pompe à
iodure d’où accroissement de la captation de
l’iode par la glande. C’est le résultat d’une
stimulation importante par la TSH secrétée en
grande quantité. Elle s’accompagne d’une
diminution de la fixation de l’iode, une augmen-
tation de la production de T3 aux dépens de la
T4 qui chute suite à une synthèse préféren-
tielle de T3 et à une accélération de la conver-
sion de T4 en T3 (2, 3).
Le goitre hyperplasique est expérimentalement
induit par l’administration de drogues antithy-
roïdiennes qui bloquent le transport de l’iode
ou son oxydation et son organification.
L’iodation de la thyroglobuline est catalysée
par la thyroperoxydase (TPO) et suppose
l’intervention de radicaux libres. Au cours de
cette goitrigenèse expérimentale, la TSH se-
crétée en grande quantité exagère la produc-
tion d’eau oxygénée (H2O2) par dismutation de
l’anion superoxyde, ce qui génère une produc-
tion excédentaire de radicaux libres (4).
Il importe pour nous de comprendre
l’interférence possible d’un antioxydant lors de
l’installation expérimentale du goitre.

Journal de la Société de Biologie Clinique
page 55
Journal de la Société de Biologie Clinique, 2005; N° 009 : 54-60
L’objet du présent travail est d’étudier les effets
de l’administration du BHA, antioxydant syn-
thétique utilisé dans la conservation des huiles,
graisses et aliments, sur l’hyperplasie thy-
roïdienne. Notre approche ici est essentielle-
ment morphologique et comprend la descrip-
tion histologique, la morphométrie des diffé-
rents composants glandulaires et la quantifica-
tion de la prolifération cellulaire dans des
goitres induits chez des souris ICR et sou-
mises à du BHA.
MATERIEL ET METHODES
1- Animaux et traitements
Des souris ICR (Institue für Zuchthygiene,
Zurich, Suisse) mâles âgées de 8 à 10 se-
maines, sont réparties en 6 groupes de 6 ani-
maux. Les groupes I et II reçoivent une nourri-
ture standard (U.A.R., Villemoisson-sur-orge,
France), fournissant environ 1,85µg d’iode par
jour et de l’eau potable pendant toute la durée
de l’expérience. Dans les groupes III et IV,
l’hyperplasie thyroïdienne est induite par un
régime carencé réduisant l’apport à 0,1µg
d’iode par jour (LID, Low Iodine Diet ; Reming-
ton, Animalabo, Bruxelles, Belgique) et par
l’administration d’un goitrigène, le 6-n-propyl-2-
thouracyl (PTU ; Sigma, St Louis, USA) qui
empêche l’organification ; l’eau potable est
remplacée par de l’eau distillée. Dans les
groupes V et VI, l’hyperplasie thyroïdienne est
induite par le LID et par l’administration de
perchlorate qui bloque le transport de l’iodure ;
le perchlorate est dissout dans l’eau distillée à
la dose de 1%. Les groupes II, IV et VI reçoi-
vent par ailleurs en plus, mélangé à leur nourri-
ture, du BHA (Sigma, St Louis, USA) à raison
de 1%. Tous ces traitements sont maintenus
pendant 12 jours. Par ailleurs au 12ème jour, et
2 heures avant d’être sacrifié, chaque animal
reçoit du bromodéoxyuridine (BrdU, Boehrin-
ger, Mannheim, Allemagne) à la dose de
50mg/kg..
2- Morphologie et morphométrie
Sous anesthésie par injection intrapéritonéale
de 15 mg de thiopental sodique dilué dans
0,3ml de sérum physiologique, (Penthotal ;
Abbott, Ottignies-Louvin-La-Neuve, Belgique),
le bloc thyroïde-trachée est réséqué, les lobes
thyroïdiens sont soigneusement libérés sous
loupe binoculaires et pesés. Ils sont ensuite
fixés au Bouin-Allen pendant 18 à 72 heures,
avec un fragment d’intestin qui servira de con-
trôle de l’incorporation du BrdU. Les lobes
ainsi fixés subiront les manipulations histolo-
giques subséquentes pour la confection de
coupes histologiques de 5µm d’épaisseur et
colorées à l’hémalun-éosine-safran.
Après avoir décrit l’image histologique de fa-
çon qualitative, il est procédé à l’analyse mor-
phométrique sur deux lames par animal afin
d’étudier les volumes relatifs du colloïde, de
l’épithélium et de l’interstitium. Cette analyse
morphométrique est réalisée par comptage par
points sur un microscope à sondages Wild. Le
volume relatif de chaque constituant A (VVA)
est donnée par la formule :
Nombre de points tombant sur A
VVA= --------------------------------------------------
Nombre total de points comptés.
Pour plus de facilité, VVA est exprimé en pour-
cent. Le nombre de points comptés par coupe
varie de 380 à 2000. Les chiffres par animal
sont obtenus en faisant la somme des chiffres
des deux coupes. On calcule alors la moyenne
et l’erreur standard par groupe expérimental.
3- Immunohistochimie
Les cellules en phase S du cycle cellulaire
ayant incorporé du BrdU sont identifiées en
utilisant la technique d’immunoperoxydase
indirecte par la méthode d’avidine-biotine
complexe ou ABC (Hsu, 1981). Dans cette
technique, le premier anticorps est un anti-
corps monoclonal antiBrdU d’origine murine, le
deuxième est une immunoglobuline de chèvre
antisouris liée à la biotine et la troisième
couche est faite de strepavidinine couplée à la
peroxydase. Les coupes sont ensuite colorées
à l’hématoxyline de Harris et montées dans de
l’Entelan. Comme contrôle positifs des coupes
de duodénum provenant des mêmes animaux
et qui contiennent un grand nombre de cellules
en phase S sont utilisées. Comme contrôles
négatifs, il s’agit de thyroïdes hyperplasiées de
souris n’ayant pas reçu de BrdU avant le sacri-
fice. Des contrôles de spécificité sont faits en
omettant le premier anticorps.
Sur deux coupes ainsi marquées par animal,
on procède au comptage du nombre de cel-
lules épithéliales ou interstitielles (vasculaires
ou non) marquées et non marquées. Pour
chaque groupe, l’indice de prolifération (IA )
des cellules épithéliales et des cellules intersti-
tielles en est déduit par la formule :
Cellules A marquées
IA =-----------------------------
Total de cellules A
Pour plus de facilité, IA est exprimé en %o. Les
chiffres par animal sont obtenus en faisant la
somme des chiffres des deux coupes. On cal-
cule alors la moyenne et l’erreur standard par
groupe expérimental

Journal de la Société de Biologie Clinique
page 56
Journal de la Société de Biologie Clinique, 2005; N° 009 : 54-60
4. Analyses statistiques
Pour les analyses statistiques, les différences
significatives entre les 6 groupes expérimen-
taux ont été recherchées en appliquant une
analyse de variance à un facteur (ANOVA), en
prenant les animaux comme unités expérimen-
tales (n=6). Les effets purs des traitements
hyperplasiants et du BHA ont été comparés
par une analyse de variance à deux facteurs
(modèle 3 x 2) : A0= pas d’hyperplasie ; A1=
PTU ; A2= Perchlorate ; B0= pas de BHA ; B1=
BHA.
RESULTATS
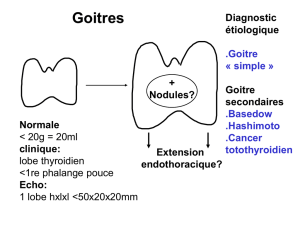
1. Poids relatif de la thyroïde (Fig. 1a)
Les variations du poids relatif de la thyroïde
des souris suivant les groupes sont résumées
à la figure 1a.
L'analyse de variance à deux facteurs montre
qu'il y a un effet lié au groupe (p=0.0001) mais
qu'il n'y a pas d'effet lié au traitement
(p=0,626), ni d'effet lié à l'interaction entre
traitement et groupes (p=0,988).
2. Morphologie quantitative (Fig. 1b, 1c ; 1d
et 1e)
L’étude comparative des volumes relatifs de
l’épithélium thyroïdien, du colloïde, des vais-
seaux et de l’interstitium non vasculaire est
consignée dans la figure 1.
L'analyse de variances à deux facteurs montre
que pour :
- le volume relatif de l'épithélium, il n'y a pas
d'effet lié au traitement (p= 0,84) mais il y a un
effet lié au groupe (p = 0,0001) et un effet lié à
l'interaction entre groupes et traitement (p =
0,0011);
- le volume relatif du colloïde, il y a un effet lié
au groupe (p = 0,001), un effet lié au traite-
ment (p=0,025) et un effet lié à l'interaction
entre groupes et traitement (p = 0,011);
- le volume relatif des vaisseaux, il n'y a pas
d'effet lié au traitement (p = 0,53) mais il y a un
effet lié au groupe et à l'interaction entre
groupes et traitement (p = 0, 0001);
- le volume relatif de l'interstitium non vascu-
laire, il n'y a pas d'effet lié au groupe (p=0,799)
mais qu'il y a un effet lié au traitement (p
=0,0019) et à l'interaction entre traitement et
groupes (p = 0,0001).
3. Morphologie qualitative
Les aspects histologiques de la thyroïde de
souris contrôle et de souris soumises aux diffé-
rents traitements antithyroïdiens (PTU ou per-
chlorate) avec ou non adjonction de BHA sont
décrits à la figure 3.
4. Prolifération cellulaire
Les résultats de l’étude de la prolifération épi-
théliale et interstitielle sont résumés à la fi-
gure3.
L'analyse de variances à deux facteurs montre
qu'il y a aussi bien pour la prolifération épithé-
liale qu’interstitielle un effet lié au groupe, un
effet lié au traitement et un effet lié à l'interac-
tion entre traitement et groupes.
DISCUSSIONS
Au cours de nos expériences, le goitre obtenu
par un régime LID et l'administration de PTU
correspond à celui décrit par d'autres (6, 7).
L'hyperplasie est importante et marquée par
une augmentation du poids de la glande, une
résorption massive du colloïde, une hyperpla-
sie épithéliale et le développement des vais-
seaux. Le traitement au perchlorate est beau-
coup moins efficace. En effet, après 12 jours,
le poids de la glande est faiblement augmenté
et le colloïde est bien conservé dans les folli-
cules. Si l'hyperplasie des cellules thy-
roïdiennes est particulièrement importante,
comme le montre l'indice de prolifération, l'hy-
pertrophie cellulaire est faible. Par contre, la
vascularisation est tout aussi développée que
dans les goitres obtenus avec le PTU. Ceci se
comprend aisément dans la goitrigenèse expé-
rimentale ; en effet, le développement de la
vascularisation précède les modifications ma-
jeures du tissu glandulaire (8).
Les doses de BHA administrées aux animaux
dans la plupart des expériences sont extrê-
mement élevées comparées à celle de 0,5
mg/kg de poids corporel recommandées par
l’OMS dans la conservation des aliments. (9).
La dose de 1% de BHA dans la nourriture ap-
pliquée au cours de nos expériences et qui
correspond à 2 g/kg de poids corporel est tout
aussi très élevée. D’après Altman et Grunow
(10), le BHA n'a pas d'effet lorsqu'il est admi-
nistré pendant 90 jours à la dose de 0,125%.
L'hyperplasie de la muqueuse digestive qu'il
induit à la dose de 2% est plus ou moins sé-
vère selon la durée d'administration et parfai-
tement réversible à l'arrêt du traitement. Pour
Moch (11), chez le rat F344, seule une admi-
nistration pendant au moins deux ans pro-
voque des hyperplasies à la dose de 0,5% et
des papillomes ou des carcinomes gastriques
à la dose de 2%. Selon le même auteur, l'ad-
ministration de 1 à 1,3 % de BHA à des chiens
pendant 180 jours ne produit aucune lésion
histologique du tractus digestif.
Par ailleurs, nos animaux traités au BHA mai-
grissent. Cette perte de poids pourrait être liée
à un effet anorexigène du BHA à forte dose.

Journal de la Société de Biologie Clinique
page 57
Journal de la Société de Biologie Clinique, 2005; N° 009 : 54-60
Un tel effet a été rapporté par plusieurs au-
teurs (12, 13) qui suggèrent par ailleurs une
susceptibilité différente au BHA selon la
souche et selon l’âge de l’animal.
Nos expériences nous font observer deux ef-
fets du BHA au cours de la goitrigenèse expé-
rimentale.
1) Une augmentation de l'interstitium non
vasculaire déjà remarquable chez les souris
contrôles et plus accentuée encore dans les
thyroïdes des animaux goitreux. Pour une
raison que nous ne pouvons expliquer, elle est
particulièrement intense lorsque le goitre est
débutant et induit par le perchlorate. Cet effet
du BHA sur l'interstitium non vasculaire reste
encore à élucider. S'agit-il d'une fibrose, d'un
oedème interstitiel ou d'une modification de la
substance fondamentale ? Dans l'état actuel
de nos travaux nous ne saurions y répondre.
2) Un effet vasodilatation surtout lorsque
l'hyperplasie est importante suite à l'utilisation
du PTU. Il existe un faisceau d'arguments
morphologiques qui le démontrent : la réduc-
tion du volume relatif de l'épithélium, de la
prolifération cellulaire et la faible vasodilatation
dans les glandes des animaux soumis à la fois
au régime hyperplasiant et au BHA. Cet effet
vasodilatation serait moins marqué chez les
souris sous perchlorate probablement parce
que le goitre induit de cette manière n'est que
débutant.
Dans la goitrigenèse, les antithyroïdiens du
groupe des thiourés inhibent l'iodation par
compétition avec les résidus tyrosyls de la
thyroglobuline pour l'iode oxydé et donc rédui-
sent la biosynthèse des hormones thy-
roïdiennes (14). Cette chute du taux des hor-
mones thyroïdiennes circulantes a pour con-
séquence une sécrétion accrue de la TSH
hypophysaire et sans doute d'autres facteurs.
A court terme, la TSH stimule par la voie de
l'adénylate cyclase, diverses étapes de la bio-
synthèse et de la sécrétion des hormones
thyroïdiennes (15). A long terme, elle induit la
prolifération cellulaire.
Le BHA est un composé phénolique; les phé-
nols sont efficacement oxydés par les peroxy-
dases (16). Dans une thyroïde normale, le
composé 1 de la TPO est pourvu de deux
équivalents d'oxydation qui permettent l'ioda-
tion de la thyroglobuline par oxydation de I- en
IO- (I+) qui réagit avec un résidu tyrosyl. et le
couplage par prise successive d'un électron à
deux résidus iodotyrosyl qui fusionnent. Le
BHA pourrait alors prendre un des deux équi-
valents d'oxydation de la TPO et empêcher
ainsi l'iodation de la thyroglobuline. Le BHA,
converti en radical phénoxyl, pourrait régéné-
rer la molécule oxydante par réduction ou
s'oxyder en une quinone stable.
Ceci aggraverait la baisse du taux des hor-
mones thyroïdiennes circulantes déjà provo-
quée par les antithyroïdiens. On devrait alors
s'attendre à un effet aggravant du goitre par le
BHA. Mais nous avons plutôt observé chez
nos souris un effet vasodilatation Cette obser-
vation suggère deux hypothèses :
- Le BHA inhiberait la sécrétion de TSH par les
cellules hypophysaires. Ceci pourrait se faire
par action directe sur les membranes biolo-
giques. (13). Une conséquence possible de
cette action du BHA sur les membranes serait
l'inhibition de l'endocytose et en particulier de
l'endocytose massive de la thyroglobuline qui
se produit au cours de l'hyperplasie. L'observa-
tion chez nos animaux d'une accumulation de
colloïde qui devient plus coloré avec des cel-
lules épithéliales de plus petite taille le sug-
gère. Cette observation a été également faite
fortuitement par Jeong et collaborateur, 2004
(13) alors qu’ils étudiaient les effets du BHA
sur le développement et les fonctions du sys-
tème reproducteur chez le rat.
- Le BHA entraînerait une résistance de la
glande à la TSH qui serait par ailleurs sécrétée
normalement. Il pourrait agir au niveau du
récepteur. Ceci est corroboré par plusieurs
travaux récents qui signalent une interaction
avec les récepteurs aux hormones notamment
les récepteurs thyroïdiens de manière dose
dépendante, conduisant à une situation
d’hypothyroïdie (17, 18). Ceci expliquerait
d'emblée son effet vasodilatation par blocage
de la cascade AMPc dépendante et de la voie
des phosphoinositides.
Il serait donc utile de pouvoir faire une étude
fonctionnelle, dosant les hormones thy-
roïdiennes T3 et T4, la PBI et la TSH circu-
lante. La souris se prêtant mal au dosage de la
TSH, il faudrait utiliser des rats ou tout autre
modèle animal adéquat.
CONCLUSION
Au total, le présent travail , utilisant une approche morphologique, a étudié les effets d’un antioxydant
phénolique, le BHA sur l'hyperplasie thyroïdienne induite par un régime carencé en iode et l'adminis-
tration de deux antithyroïdiens le PTU ou le perchlorate.
Nous avons observé, que le BHA avait un effet vasodilatation chez les souris traitées au LID et PTU;
le BHA induit une réduction du volume relatif de l'épithélium, une réaccumulation du colloïde, une
réduction de la prolifération cellulaire et une réduction de la vasodilatation

Journal de la Société de biologie Clinique
page 58
Journal de la Société de Biologie Clinique, 2005; N° 009 : 54-60
Par ailleurs, le BHA induirait une augmentation de l'interstitium non vasculaire pour une raison qu'il
reste à élucider.
La confrontation de nos observations avec certains aspects de la physiologie thyroïdienne nous fait
émettre deux hypothèses pour expliquer l'action vasodilatation du BHA sur la cellule thyroïdienne, une
inhibition de la sécrétion de TSH par l'hypophyse ou une résistance de la glande à la TSH. D’autres
études fonctionnelles devront élucider ce point.
Figure 1 : Etude morphométrique
Fig 1a : Poids relatifs de thyroïdes par groupe expérimental
Fig 1b : Volume relatif de l’épithélium thyroïdien par groupe
expérimental
Fig 1c : Volume relatif du colloïde par groupe expérimental
Fig 1d : Volume relatif des vaisseaux par groupe expérimental
Fig 1e : Volume relatif de l’interstitium non vasculaire par groupe
expérimental
Légendes
Groupe I : Contrôle
Groupe II : Contrôle plus BHA 1%
Groupe III : LID plus PTU 0,25%
Groupe IV : LID plus PTU 0,25% plus BHA 1%
Groupe V: Perchlorate 1%
Groupe VI: Perchlorate 1% plus BHA 1%
 6
6
 7
7
1
/
7
100%