1999orga

1 / 2
Chimie organique session 1999
ÉTUDE D'UNE STRUCTURE
Un composé organique A contient (en masse) 72,4 % de carbone, 13,8 % d'hydrogène et 13,8 % d'oxygène.
Sa masse molaire est 116 g.mol-1.
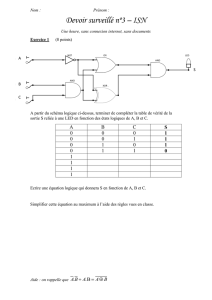
1. Déterminer la formule brute de A.
2. Le spectre IR du composé A présente une large bande d'absorption vers 3400 cm-1. Quelle est la fonction
présente dans A ?
3. Détermination de la structure de A.
On dispose des renseignements suivants :
* A ne réagit pas avec le dichromate de potassium en milieu acide
* la déshydratation de A conduit majoritairement à B ; l'ozonolyse de B, suivie d'une hydrolyse en milieu
réducteur, donne deux composés C et D
* C et D donnent un précipité jaune avec la 2,4-DNPH
* C réduit la liqueur de Fehling et comporte une chaîne carbonée linéaire de 4 carbones
* D ne réagit pas avec la liqueur de Fehling et donne un précipité jaune avec le diiode en milieu basique
3.1. A l'aide des informations précédentes, donner les formules et les noms des composés C, D, B et A, en
expliquant le raisonnement suivi.
3.2.a . Écrire l'équation bilan de la déshydratation de A, préciser les conditions opératoires.
3.2.b. Lors de la déshydratation, il se forme aussi un composé B', isomère de B. Donner la formule de B'.
Quelle règle permet de justifier la prépondérance de B par rapport à B' ?
3.3. Quel produit organique obtient-on lors de la réduction de la liqueur de Fehling par C ?
3.4. Écrire l'équation bilan de la réaction de D avec le diiode en milieu basique.
4. Action du bromure de méthylmagnésium sur C.
C réagit avec le bromure de méthytmagnésium : on obtient le composé E. Le mélange obtenu est hydrolysé à
froid en milieu acide, on obtient F.
4.1. Écrire l'équation bilan de la réaction du bromure de méthylmagnésium avec C, conduisant à E. Préciser
les conditions opératoires.
4.2. Donner la formule et le nom du composé F.
Données : Masses molaires atomiques, en g.mol-1
H: 1,0 O : 16,0 C :12,0

2 / 2
SYNTHÈSE DE L'HÉLIANTHINE
L'hélianthine est un colorant azoïque ; les produits nécessaires à sa synthèse sont les suivants :
-Acide sulfanilique (acide 4-aminobenzènesulfonique) N,N-diméthylaniline
On utilisera, dans les équations bilans, les formules semi-développées.
1. Synthèse de l'acide sulfanilique.
1.1. On veut obtenir le nitrobenzène à partir du benzène.
1.l.a. Préciser les conditions opératoires et écrire l'équation bilan de la réaction.
1.1.b. Donner la nature de l'espèce électrophile.
1.2. Le nitrobenzène est réduit en milieu acide chlorhydrique par le fer. On obtient alors la forme
protonée de l'aniline, le passage en milieu basique du milieu réactionnel en fin de réaction permet de
récupérer l'aniline.
Écrire l'équation bilan de la réaction de réduction en milieu acide, sachant que le fer est oxydé en
Fe2+.
1.3. L'aniline réagit avec le chlorure d'éthanoyle (ou d'acétyle) : on obtient l'amide G. La
sulfonation de G conduit majoritairement à H ; l'hydrolyse de H conduit à l'acide sulfanilique I (voir
tableau ci-dessus).
1.3.a. Écrire les équations bilans pour les trois réactions évoquées ci-dessus.
1.3.b. Pourquoi est-il impossible d'obtenir l'acide sulfanilique par sulfonation directe de
l'aniline ?
1.3.c. Quel produit minoritaire H', isomère de H, obtient-on également lors de la sulfonation
de G ? Justifier la formation de ces deux produits.
1.3.d. L'hydrolyse en milieu basique de H conduit à la forme basique I' de l'acide sulfanilique
: écrire la formule de I'.
2. Passage à l'hélianthine
2.1. La diazotation de I conduit à un ion diazonium J : indiquer les conditions opératoires et écrire
l'équation bilan de la réaction.
2.2. J réagit avec la N,N-diméthylaniline. On obtient l'hélianthine.
2.2.a. Écrire l'équation bilan de la réaction.
2.2.b Quelle est ici l'espèce électrophile ?
SO3HNH2
N
CH3
CH3
1
/
2
100%