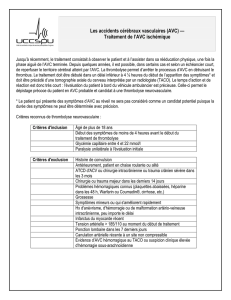
Traitement de l`AVC en phase aiguë

Traitement de l’AVC en phase aiguë
Article de R. Sztajzel M. Reichhart P. Michel J. Bogousslavsky
L’objectif de cette revue est de faire le point sur le traitement de l’AVC en phase aiguë. Les
principales études portant sur la thrombolyse intraveineuse et intra-artérielle sont discutées, de
même que les résultats d’études récentes sur l’utilisation des antagonistes des récepteurs
plaquettaires IIb/IIIa en tant qu’agent fibrinolytique. Nous discuterons également les données
sur l’effet potentiel des ultrasons sur la thrombolyse. Enfin seront aussi énoncées les
principales mesures à prendre afin d’éviter les complications médicales et neurologiques
survenant durant la phase aiguë de l’AVC.
Introduction
L'accident vasculaire cérébral constitue la troisième cause de mortalité après les maladies
cardiovasculaires et les pathologies cancéreuses. Il est aussi la première cause d'invalidité
acquise de l'adulte de plus de 65 ans. Grâce à une amélioration de la prise en charge des AVC
due en grande partie à la constitution dans certains pays d'unités vasculaires spécialisées et
aussi grâce à un meilleur contrôle des facteurs de risque, nous assistons depuis plusieurs
années à un déclin de la mortalité. Cette dernière, toutefois, ne s'accompagne pas d'une
diminution de l'incidence qui aura au contraire encore tendance à croître ces prochaines
années. Par conséquent, la nécessité d'un traitement efficace pouvant être administré dans la
phase aiguë est devenue impérative. Depuis environ une dizaine d'années, un grand nombre
d'études randomisées à large échelle ont été réalisées portant sur différentes stratégies de
traitement. Ces essais cliniques incluent outre les agents thrombolytiques, administrés par
voie intraveineuse, intra-artérielle ou combinée, des traitements à base de puissants
antiplaquettaires avec effet thrombolytique potentiel tels les antagonistes des récepteurs
IIb/IIIa, des interventions visant à lyser ou à extraire mécaniquement le thrombus responsable
de l'AVC et enfin l'utilisation des ultrasons pour leur effet synergique lors de thrombolyse. Le
but de notre exposé est de passer en revue ces différentes modalités de traitement, d'en
discuter les résultats et de proposer un certain nombre de recommandations.
Thrombolyse intraveineuse
En 1996 sont publiés les résultats de l'étude nord-américaine NINDS (National Institute of
Neurological Disorders and Stroke) qui démontrent un bénéfice fonctionnel de la thrombolyse
intraveineuse par t-PA lors d'AVC sylvien aigu de moins de 3 heures.1-4 La dose de t-PA
utilisée dans ces études était de 0,9 mg/kg administrée durant une heure avec un bolus de 10%
de la dose totale (tableau 1). Les patients traités quittent en général l'hôpital plus tôt et sont
moins susceptibles de nécessiter une réhabilitation prolongée.

En ce qui concerne l'âge des patients, une analyse récente de l'étude NINDS, réalisée par
Fagan et collaborateurs, a permis de montrer que toutes les catégories d'âge bénéficient de
cette thérapie, y compris les patients de plus de 80 ans. De même, ces auteurs ont pu
démontrer que dans l'étude NINDS, la thrombolyse apportait un gain sur le plan du pronostic
fonctionnel à tous les types d'AVC, et, en particulier aux AVC lacunaires.5
Trois autres grandes études randomisées de thrombolyse intraveineuse ont été réalisées. Deux
études (ECASS I et II) ont évalué la sécurité ainsi que l'efficacité du t-PA chez des patients
traités de 0 à 6 heures.6,7 Une autre étude (ATLANTIS) a principalement analysé les patients
traités entre 3 et 5 heures.8 Toutes ces études ont utilisé la dose de 0,9 mg/kg jusqu'à une dose
maximale de 90 mg, à l'exception de l'étude ECASS I qui a utilisé la dose 1,1 mg/kg jusqu'à
une dose totale de 100 mg de t-PA. Aucune de ces trois études, toutefois, n'a montré de
différence significative en ce qui concerne le pronostic fonctionnel à trois mois entre les
patients traités par t-PA et ceux traités par placebo, malgré une tendance en faveur du groupe
thrombolysé.
Le risque majeur de la thrombolyse est celui de l'hémorragie. Dans l'étude NINDS, une
complication hémorragique symptomatique est survenue dans 6,4% des cas des patients
traités par t-PA et dans 0,6% des cas de placebo (p < 0,001). Toutefois, il n'y avait pas de
différence significative du point de vue de la mortalité à 90 jours.1 Les complications
hémorragiques étaient par ailleurs semblables dans les études ECASS I, II et ATLANTIS,
mais pas supérieures à celles observées dans l'étude NINDS.1,6-8 Dans l'étude NINDS, les
patients avec un déficit neurologique très sévère à l'admission, une hypodensité ou un effet de
masse visible sur le CT-scan avaient plus tendance à développer une complication
hémorragique après thrombolyse ; soulignons, néanmoins, que les patients avec déficit sévère
avaient aussi plus de chances d'avoir un pronostic favorable à trois mois s'ils étaient traités par
rt-PA que par placebo. Une analyse récente effectuée par Demchuk et coll.,9 regroupant 1205
patients collectés dans 56 centres différents et appliquant un protocole semblable à celui de
l'étude NINDS, montre que les principaux facteurs associés à une complication hémorragique
après thrombolyse sont la présence d'un diabète (OR 3,87, IC 95% de 1,73 à 8,69), la prise
d'antiagrégants plaquettaires (OR 3,6, IC 95% de 1,26 à 10,64) ainsi que la présence de signes

ischémiques précoces sur le CT-scan initial, en particulier lorsqu'il existe un œdème
impliquant plus d'un tiers du territoire de l'artère cérébrale moyenne (OR 6,7, IC 95% 2,12 à
21,01).
Hacke et coll. a mis en évidence dans une méta-analyse regroupant les études NINDS,
ECASS I et II et ATLANTIS, l'importance du facteur «temps».10 Dans son étude, il a en effet
pu démontrer que plus le délai augmente entre le début des symptômes et le début du
traitement, plus l'efficacité thérapeutique diminue et le risque d'hémorragie augmente. Ainsi,
le bénéfice du traitement diminue de 50% passé le délai des premières 90 minutes, et la
chance d'avoir un pronostic favorable à trois mois est réduite d'un facteur de 2,8 à 1,4.
Thrombolyse intra-artérielle
Il existe seulement deux études sur la thrombolyse intra-artérielle dans le territoire antérieur,
les études PROACT I et II..11,12 Les résultats de ces deux études montrent que l'utilisation de
prourokinase dans un délai de trois à six heures améliore le pronostic des patients à 90 jours
de manière significative. Au total, sept patients doivent être traités pour prévenir un décès ou
une dépendance. Le taux de complications hémorragiques plus élevé (10,2%)
comparativement à celui des études NINDS (6,4%), ECASS II (8,8%) ou ATLANTIS (7,2%)
peut s'expliquer du moins en partie par le fait que la sévérité initiale de l'AVC était plus
importante dans l'étude PROACT II (NIHSS de 17) que dans les études NINDS (NIHSS de
14) ou ECASS II (NIHSS de 11). Bien que le taux de recanalisation soit plus élevé avec la
lyse intra-artérielle (66%) qu'avec la lyse intraveineuse (environ 50%), et que les AVC plus
sévères bénéficient vraisemblablement plus d'une approche intra-artérielle qu'intraveineuse,
cette modalité thérapeutique reste pour l'instant limitée à quelques centres qui disposent d'un
service de neuroradiologie interventionnelle 24 heures sur 24 et 7 jours sur 7. Une autre
limitation de la thrombolyse intra-artérielle réside aussi dans le délai d'initiation du traitement.
Dans l'étude PROACT II, le temps moyen depuis le début des symptômes jusqu'au début du
traitement était de 5 h 30, alors que dans l'étude NINDS ce délai n'était que de 1 h 30..
Thrombolyse intra-artérielle lors d'occlusion du tronc basilaire
Malgré l'absence d'études randomisées, plusieurs séries suggèrent un bénéfice en faveur de la
thrombolyse par voie intra-artérielle dans cette situation grevée d'une mortalité supérieure à
80%. Dans une étude portant sur 44 patients, la mortalité est clairement dépendante du taux de
recanalisation : 46% en présence d'une reperméabilisation contre 92% en l'absence de
recanalisation.13 Dans une autre étude portant sur neuf patients, la thrombolyse intra-artérielle
a permis un recanalisation dans 78% des cas. A noter que dans cette série, la thrombolyse a
été effectuée avec succès jusqu'à un délai de 13 heures après le début des symptômes, ce qui
suggère une fenêtre thérapeutique vraisemblablement plus longue que dans le territoire
sylvien.14 De ce fait, face au décours dévastateur de l'occlusion du tronc basilaire, les résultats
obtenus avec la thrombolyse intra-artérielle indiquent que ce traitement peut être bénéfique
jusqu'à un délai dans tous les cas de 12 heures.

Thrombolyse combinée intra-artérielle et intraveineuse
Très peu d'études combinant cette double approche ont été réalisées. L'étude EMS Bridging
trial (Emergency management of stroke), réalisée en 1999 a inclus 34 patients, 17 dans le
groupe intraveineux/intra-artériel et 17 dans le groupe placebo/intra-artériel.15 Le temps
moyen de la lyse intraveineuse était de 2 h 30 et celui de la lyse intra-artérielle de 4 h 10. La
dose administrée était de 0,6 mg/kg en perfusion continue avec un bolus de 10-20% jusqu'à
une dose maximale de 60 mg. La perfusion était stoppée dès le début de l'artériographie et le
restant de la dose administré par voie intra-artérielle jusqu'à une dose maximale de 90 mg. Sur
le plan fonctionnel, il n'y avait pas de différence significative entre les deux groupes à 10 et à
90 jours, bien que le taux de recanalisation était supérieur dans le groupe combiné (p = 0,05).
Dans une autre étude, IMS (interventional management of stroke study), non randomisée et
incluant cette fois-ci au total 80 patients avec un score NIHSS moyen de 18, le pronostic
fonctionnel à trois mois était comparable à celui du groupe traité par t-PA dans l'étude NINDS
où le score NIHSS moyen était de 14.16 A noter aussi que le taux de complications
hémorragiques était de 6,3% et donc également très proche de celui de l'étude NINDS. Il faut
souligner que la thrombolyse combinée permettrait d'utiliser à la fois le facteur «temps»
associé à la rapidité d'administration de la thrombolyse intraveineuse ainsi que les taux de
recanalisation plus élevés que l'on connaît avec la thrombolyse intra-artérielle. Toutefois, au
vu des données actuelles et en l'absence d'études réalisées à plus large échelle, la thrombolyse
combinée ne peut pas être recommandée comme un traitement de routine et ne devrait être
réalisée que dans le cadre d'un protocole.
Lyse mécanique du thrombus
L'utilisation de méthodes mécaniques de lyse du thrombus (microcathéter) comme traitement
adjuvant à la thrombolyse a été rapportée récemment dans plusieurs études pilotes. Qureshi et
coll.17 ont observé un taux de recanalisation de 84% chez dix-neuf patients traités par
thrombolyse intra-artérielle suivie d'une lyse mécanique. Dans une autre étude, rétrospective,
incluant 32 patients, une lyse mécanique a été réalisée après thrombolyse intraveineuse (3
patients), intra-artérielle (6 patients) ou combinée (22 patients), et a permis une recanalisation
immédiate chez 38% des patients ainsi qu'une recanalisation finale chez 75% des patients.18
L'évolution clinique favorable a pu être documentée chez 19 patients (59%) et les
complications hémorragiques symptomatiques étaient présentes chez trois (9,4%) d'entre eux.
Ces techniques pourraient potentiellement raccourcir le délai de restauration du flux sanguin,
ce qui représente un facteur pronostique important pour le succès de la thrombolyse.
Antagonistes des récepteurs plaquettaires IIb/IIIa dans le traitement de l'avc aigu
Le bénéfice des antagonistes des glycoprotéines plaquettaires IIb/IIIa a été bien démontré
dans le traitement du syndrome coronarien et a ainsi également ouvert la voie à son utilisation
dans le cadre de l'AVC aigu. L'étude (non publiée) Abciximab in Emergent Stroke Treatment
Trial (AbESTT) a inclus 400 patients avec un AVC aigu, traités dans un délai de 3 à 6 heures
soit avec l'abciximab (0-25 mg/kg et 125 mg/kg/min durant 12 heures), soit avec un placebo.19
Les résultats montrent qu'après trois mois, les patients traités par abciximab ont plus de
chances d'avoir un déficit neurologique mineur ou nul sur l'échelle modifiée de Rankin (mRS

0-1) que le groupe contrôle (48,5 versus 40%). De même, la mortalité était moindre dans le
groupe traité par abciximab que dans le groupe placebo. Le traitement avec l'abciximab
n'induisait pas plus de complications hémorragiques que le groupe contrôle (3,6% versus
1,0%) ; la fréquence des hémorragies fatales ainsi que celles des transformations
hémorragiques asymptomatiques étant par ailleurs semblables dans les deux groupes.
Thrombolyse intraveineuse potentialisée par les ultrasons
Il a été démontré dans les modèles expérimentaux que les ultrasons facilitent l'activité des
agents fibrinolytiques déjà quelques minutes après leur exposition au thrombus et au sang
contenant le t-PA. Le mécanisme sous-jacent à cet effet de potentialisation inclut outre une
amélioration du transport du médicament, une altération réversible de la structure de la fibrine
ainsi qu'une augmentation de la liaison du t-PA à la fibrine.20 La fréquence optimale avec
laquelle les ultrasons devraient être administrés n'est toutefois pas établie. Les fréquences
basses (< 0,5 MKh) ont certainement un effet thrombolytique important, cependant, ces
fréquences basses ont été associées dans divers essais à un taux élevé de complications
hémorragiques.21 Dans une étude récente,22 Alexandrov et coll. ont traité par t-PA
intraveineux 126 patients. Parmi ceux-ci, 63 reçoivent en plus un traitement continu par
ultrasons avec un Doppler transcrânien de 2 MHz de fréquence. Les autres 63 patients
constituent le groupe contrôle. Une hémorragie cérébrale symptomatique a été documentée
chez trois patients de chaque groupe. Une recanalisation complète ou une récupération
clinique deux heures après l'administration de la thrombolyse a pu être observée chez 31
patients (49%) traités par ultrasons et chez 19 patients (30%) appartenant au groupe contrôle
(p = 0,03). A 24 heures, 24 patients (44%) traités par ultrasons et 21 patients (40%) du groupe
contrôle présentent une récupération neurologique importante (p = 0,7). A trois mois, 22 des
53 patients (42%) traités par ultrasons et 14 des 49 (29%) appartenant au groupe contrôle ont
un pronostic favorable avec une valeur entre 0 et 1 sur l'échelle modifiée de Rankin (p = 0,2).
Ainsi, en comparaison avec le groupe placebo, le traitement continu avec les ultrasons durant
la thrombolyse augmente de manière significative le taux de recanalisation. Ce bénéfice se
traduit sur le plan clinique par une tendance, quoique non significative, à avoir un déficit
neurologique mineur ou nul à trois mois.
Traitement antithrombotique lorsque le délai de la thrombolyse est dépassé
Deux larges études ont permis de démontrer que l'administration d'aspirine (entre 160 et 300
mg) durant les premières 48 heures permettait une réduction du taux de récidive précoce
d'AVC ainsi qu'une diminution de la mortalité à quatre semaines. Pour 1000 traités par
aspirine, sept récidives seront évitées lorsque l'administration du traitement se fait rapidement
après le début des symptômes.23,24 L'efficacité et la «sécurité» du clopidogrel ou de la
combinaison d'aspirine-clopidogrel ou aspirine-dipyridamole ne sont pas connues lors de la
phase aiguë de l'AVC. Le clopidogrel a l'inconvénient de n'être actif qu'après quelques jours
seulement, à moins qu'une dose de charge ne soit administrée à raison de 300 mg.. Or, c'est
précisément cette dose de charge qui pourrait induire une complication hémorragique.
L'utilisation de la combinaison aspirine-clopidogrel ne peut être recommandée à l'heure
actuelle durant la phase aiguë, également en raison des risques de transformation
hémorragique.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%