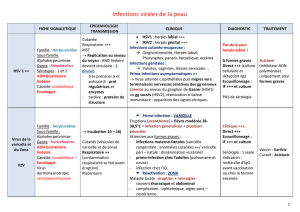
Lettre bimensuelle 5..

Le but de SIDABLOG est d’exposer, par le biais de lettres d’informations bimensuelles accessibles à tous,
le contenu d’articles scientifiques récemment publiés dans les plus importantes revues internationales.
Vers un modèle de la capside
A l’intérieur des virus, on trouve un compartiment conique qui renferme le génome appelé la
capside. Il est formé d’environ 250 composés de forme hexagonale (hexamères) et de 12 de forme
pentagonale (pentamères) permettant de fermer la structure à chaque extrémité : 5 à l’extrémité la plus
étroite, 7 à l’extrémité la plus large. On connaît aujourd’hui la structure de chacun de ces composants et
on peut ainsi modéliser la capside dans son ensemble.
Des chercheurs viennent en effet de décrypter la structure de ces composants. Ils ont identifié, il y
a deux ans, la structure des hexamères et les différentes liaisons de ces éléments au sein de la capside. Ces
dernières révèlent le rôle important de l’interface intramoléculaire dans la stabilisation de l’édifice
1
. La
structure générale de la capside se présente néanmoins comme une mosaïque. En effet, chaque hexamère
se présente comme « une fleur sans bouton » contenant 6 protéines de capside (CA), « ses pétales ».
Chaque protéine est constituée quant à elle de 2 domaines, les domaines C-terminal (CTD) et N-terminal
(NTD), reliés entre eux par une boucle flexible.
Jusqu’alors, la structure globale de la capside ne pouvait être déterminée sans connaitre les
pentamères. Récemment, selon la même méthode, ces chercheurs se sont concentrés sur la structure
spatiale des pentamères. Ils ont ainsi découvert que les assemblages des hexamères et des pentamères sont
quasiment équivalents. Ils nécessitent ensuite un réarrangement minutieux pour se lier au sein de la
capside. Ils ont également montré qu’il faut deux types de rotation entre les corps « rigides » de cette
capside pour permettre ce réarrangement. Cet assemblage semble contrôlé par des interactions
électrostatiques.
1
Voir lettre SIDABLOG n°19.
Lettre bimensuelle n°51 (16-31 janvier 2011)

Alors qu’il n’est pas encore possible d’obtenir directement la structure de la capside virale, on
peut la modéliser à partir de la connaissance de ses éléments. La capside serait ainsi composée de 1056
protéines CA et présenterait un changement de courbure continu grâce aux flexions des interfaces NTD-
CTD. On pense que les pentamères accentuent les changements de courbure de certaines zones.
Atomic-level modelling of the HIV capsid. Pornillos O, Ganser-Pornillos BK, Yeager M. Nature. 2011 Jan
20;469(7330):424-7.
A la recherche d’un vaccin protecteur
La découverte d’un vaccin protégeant efficacement contre l’infection par le VIH reste depuis
longtemps l’un des principaux objectifs des chercheurs. Cependant, très peu de vaccins ont été testés chez
l’homme en raison des difficultés de mise en place des essais à grande échelle. A ce jour, un seul a
montré un effet de protection partielle
2
. Des chercheurs du National Institut of Health
3
proposent
aujourd’hui une approche séquentielle et plus rationnelle de conduite des essais vaccinaux.
Pour de nombreuses maladies infectieuses, des personnes guérissent naturellement par des voies
immunitaires spécifiques et sont ainsi protégées de toute réinfection ultérieure. Ceci permet normalement
de définir des voies pour le développement d’un vaccin efficace, mais pour le VIH, on ne parvient pas à
faire de même.
De nombreuses études tentent tout de même de définir un corrélat immunitaire d’une protection
pouvant aider à établir si un vaccin serait efficace pour un essai clinique sur l’homme. La connaissance de
la réponse immunitaire protectrice est nécessaire car de nombreux vaccins candidats ont été réalisés de
façon empirique, sans connaître réellement les mécanismes biologiques de protection.
Les observations faites par les chercheurs présentent aussi des limites. Chez les personnes
exposées mais non infectées, on ne comprend toujours pas les mécanismes de protection. A côté, des
facteurs génétiques déjà identifiés, on pense qu’une immunité non spécifique locale, au niveau des
muqueuses, pourrait expliquer ces observations sans que l’on en comprenne les mécanismes pour les
transposer à un vaccin. Aussi, différentes équipes étudient les patients appelés « contrôleurs élites » qui
sont infectés mais qui contrôlent l’infection et ne développent aucun symptôme
4
. Néanmoins, les
mécanismes immunologiques permettent simplement de contrôler le virus mais ne sont pas efficaces pour
prévenir l’infection.
Les essais traditionnels sont réalisés sur un grand nombre de patients et sur une longue durée afin
que le nombre de personnes qui se seraient infectées puissent être suffisamment important pour que les
effets protecteurs se révèlent. Il est donc aisé d’imaginer que la mesure d’une réaction immunitaire, en
réponse au vaccin, peu de temps après le début de l’essai, serait nécessaire pour rationaliser la recherche
vaccinale. Il faudrait donc une technique à la fois nouvelle et meilleure.
Ces scientifiques pensent que la recherche vaccinale doit passer par une approche adaptative des
essais cliniques. Si en cours d’essais, on peut mesurer rapidement une réponse immunitaire, on peut alors
traiter de nouveaux patients, en tenant compte des observations, et obtenir au fur et à mesure une cohorte
suffisamment importante. Cela permettrait d’augmenter la probabilité d’observer une résistance, même
partielle, de l’organisme à l’infection.
Ces chercheurs envisagent donc les essais cliniques comme un moyen de définir une réaction
immunitaire anti-VIH, même partielle, et non comme l’occasion de développer un produit vaccinal
immédiat. Ils doivent être successifs en tenant compte à chaque étape des résultats obtenus pour améliorer
progressivement l’effet protecteur d’un vaccin.
2
Voir les lettres d’actualités de SIDABLOG : Peut-être un vaccin ? Un vaccin anti-VIH ? Restons prudents.
3
Institution gouvernementale des États-Unis qui s'occupe de la recherche médicale et biomédicale.
4
Voir lettre SIDABLOG n°11.
1
/
3
100%