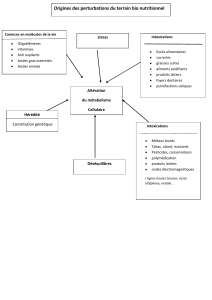
Nettoyage de métaux à l`aide de nettoyants acides

Numéro de série: PRD 2004/09 Mai 2004
Nettoyage de métaux à l’aide de nettoyants acides
Comme mentionné dans le Bulletin Technique précédent, les nettoyants acides sont employés pour
l’enlèvement de matières organiques, tels dépôts calcaires, rouille etc… Ces nettoyants acides s’utilisent
également pour le décapage de l’acier inox. Le type d’acide utilisé est fonction de la surface et du type de
pollution. Dans ce Bulletin Technique nous approfondirons la théorie relative aux applications des différents
types de nettoyants acides qui font partie du programme de livraison du groupe Vecom.
Degré d’acidité ou pH
Une molécule particulière est la molécule (H2O). On ferait mieux de l’écrire comme H-OH.
Une molécule eau se décompose en deux particules électriques chargées (ions) H+ et OH-. La particule
positive (ion-H+) est la partie acide, la particule négative (ion-OH) est la partie alcaline ou basique. Il y a
exactement le même nombre des deux parties dans l’eau pure. La solution est donc électriquement neutre.
La valeur pH est donc définie comme logarithme négatif de la concentration des ions H+.
Dans l’eau pure sur chaque 10.000.000 molécules, seulement une molécule se décompose, ou bien une
partie de 0,0000001 (10-7). L’eau pure a donc un pH de 7. Dans un acide avec pH de 3 la concentration en
ions H+ est donc de 10-3. Sur chaque 1.000 molécules d’eau un ion H+ sera présent.
Les valeurs-pH de matières connues sont:
Acide dans une batterie 0
Acide gastrique 1
Acide citrique 2
Vinaigre 2,5
Cola 3,6
Vin 3,9
Jus de tomate 4
Café noir 5
Lait 6,5
Eau pure 7,0
Sang 7,4
Eau de mer 8,5
Solution soude 8,7
Shampooing 9,8
Ammoniac ménager 11
Eau de Javel 12,5
Choix du type d’acide
En fonction de la surface à nettoyer et le type et degré de pollution, le type
d’acide et les additifs éventuels seront choisis. En règle générale les acides forts
tels acide chlorhydrique HCl), acide nitrique (HNO3), acide sulfurique (H2SO4) et
dans une moindre mesure l’acide phosphorique (H3PO4) ne seront pas appliqués
tel quel sur les métaux légers comme alu, zinc, cuivre et nickel. Ces métaux sont
dissous dans un milieu très acide et libèrent du gaz hydrogène qui en
combinaison avec l’oxygène (dans l’air) forme un mélange très explosif.
L’addition d’inhibiteurs de corrosion, souvent des amines organiques complexes
donne la solution. Des acides forts s’utilisent pour le nettoyage industriel..
Des acides faibles comme acide citrique, acide formique et acide sulphamique peuvent être
utilisés sur les métaux comme alu, zinc, cuivre et nickel. Ces métaux sont également
attaqués mais moins violemment et les acides sont plus agréable à l’emploi. Voilà pourquoi
on utilise ces acides faibles pour le nettoyage dans le secteur institutionnel.
Bulletin Technique
A
cide
Neutre Base
A
cide fort
A
cide faible Base faible Base fort

Pag. 2 – TB PRD 2004/09
Quelques réactions de métaux et acides
Les propriétés d’un acide peuvent servir pour l’enlèvement de pollutions spécifiques tels rouille (oxydes de
fer). Cette réaction transforme l’oxyde de fer dans un ion fer et de l’eau..
Fe2O3 + 6 H+ Æ 2 Fe3+ + 3 H2O
rouille acide ion fer eau
Ceci a comme désavantage que outre la réaction ci-dessus l’acide provoque aussi une réaction avec la
surface métallique même. Cette réaction provoque une attaque (corrosion). Lors de réaction de l’acide avec
un métal, du gaz hydrogène se forme, ce qui provoquera des bulles de gaz visibles à la surface. Ce gaz
hydrogène réagit également avec le métal, on l’appèle fragilité hydrogène.
Fe + 2H+ Æ Fe2+ + H2 (↑)
fer acide ion fer gaz hydrogène
La réaction néfaste complémentaire d’un acide peut être amadouée par l’ajoute d’inhibiteurs de décapage à
la solution acide. Des inhibiteurs sont souvent composés d’azote organique et/ou de combinaisons
sulfuriques avec des matières tensio-actives. Ceux-ci améliorent le mouillage de la surface, d’où une attaque
plus uniforme ce qui évite la corrosion locale..
L’action de l’inhibiteur consiste à former un film très fin sur la surface métallique.
Du fait que la surface métallique est légèrement chargée, les matières polaires
organiques (inhibiteurs) sont attirées et forment la couche protectrice.
Malheureusement les inhibiteurs sont spécifiques pour le type d’acide, Chaque
inhibiteur ne protège pas chaque métal. Il s’agit d’utiliser l’inhibiteur approprié à
l’acide en question.
Aperçu des nettoyants acides
Vecom a des produits a base de différents acides et inhibiteurs. Dans le tableau ci-dessous nous indiquons
les directives d’utilisation pour les métaux en question.
Acier Inox Alum. Zinc Inhibiteur Dégraissage Application
Cetemax San + + + +/- + + Nettoyant sanitaire pour entretien journalier
Cetemax San Plus + + + - + + Nettoyant sanitaire pour entretien périodique
Descalant F / BA-S + + - - + - Poudre pour le nettoyage de systèmes réfrigérants
Descalant HD / BA-30 + - - - + - Pollution forte (chaudières vapeur)
Descalant NF / BA-S Extra + + + + + - Poudre pour nettoyage systèmes réfrigérants métalliq.
Descalant NF-Liquid / BA-70 + + + + + - Détartrant acide doux liquide. Sûr pour alu
Descalant Tankclean + + - - - + Enlèvement ciment, sûr pour alu
Vecosan Brightner GTM + + ± - - ++ Nettoyant pour alu ravagé
Vecosan Plus + + + - - +++ Dégraissage alu avant peinture
Vecosan Rustcleaner + + + - - +- Enlèvement rouille et tartre
Vecosan Metal Cleaner + + + - - ++ Nettoyant alu, inox, acier et cuivre, exempt d’HF
Vecosan Super + + ± - - + Nettoyant alu, inox et acier
Vecosan Tankbrightner - + + - - + Lustrant pour alu
Vecosan TTC-101 + + ± - - ++ Enlèvement de pollution atmosphérique tenace
Vecosan TTC-204 + + ± - - + Enlèvement de rayures de rouille, exempt d’HF
Vecosan TTC-Foam + + ± - - ++ Comme Vecosan TTC-101, sans vapeurs acides
Vecosan TTC-S + + ± - - + Surtout en combinaison avec nettoyant alcalins
Vecosan Vlakkenbeits + + + - - +++ Traitement en suite de l’acier inox
Auteurs: ing. T. van Os (Chef Laboratoire) & ing. J.P. Lange (Research & Development)
Reactions et/ou questions: e-mail: tb@vecom.nl
1
/
2
100%