correction DS CIII+PII

1S DEVOIR SURVEILLE CIII et PII
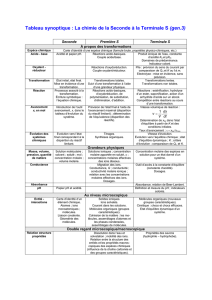
Exercice I
1. Ecrire la formule chimique et indiquer le nom des solides ioniques constitués des ions suivants :
a) Br- et K+ b) Al3+ et F- c) S2- et Na+
2. Recopier et compléter les équations de dissolution suivantes :
a) AgNO3 (s) …….. + …… b) K2CrO4 (s) …… + CrO42-(aq) c) Na2SO4 (s) …… + ……
3. Que signifie (aq) écrit à côté des ions obtenus ?
4. Quel type d’interaction est responsable de la cohésion des solides ioniques ?
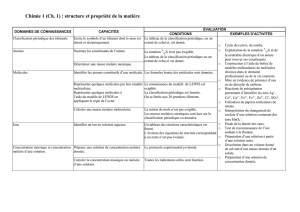
Exercice II
Données : en g.mol-1 : M(Ca) = 40,1 ; M(Cl) = 35,5
1. On dissout m1 = 3,47 g de chlorure de calcium (CaCl2 (s)) dans V1 = 250 mL d’eau distillée.
a) Montrer que la concentration molaire en soluté apporté de la solution S1 obtenue est C1 = 1,25.10-1 mol.L-1.
b) Ecrire l’équation de dissolution du soluté CaCl2 (s) dans l’eau.
c) Calculer la concentration molaire effective des deux ions présents dans la solution S1. Détailler les calculs.
2. On dispose d’un volume V2 = 50,0 mL d’une solution S2 de chlorure de sodium (Na+(aq) + Cl-(aq)) de concentration
molaire en soluté apporté C2 = 1,05.10-1 mol.L-1.
a) Ecrire l’équation de dissolution du chlorure de sodium dans l’eau.
b) En déduire la concentration molaire effective des ions présents dans la solution S2.

3. On mélange les solutions S1 et S2.
a) Calculer la concentration molaire effective des ions présents dans le mélange. Détailler les calculs.
b) Vérifier que : [Na+] + 2×[Ca2+] = [Cl-]. Interpréter.
4. On prélève un volume V = 20,0 mL de la solution S2 que l’on dilue pour obtenir un volume V3 = 250 mL.
a) Calculer la concentration molaire effective des ions présents dans la nouvelle solution S3.
Plusieurs méthodes sont possibles dont une très rapide ….
b) Indiquer la verrerie nécessaire pour effectuer cette dilution.
Exercice III
Le document ci-contre est un enregistrement du mouvement des
points A et B d’un solide indéformable. Entre chaque pointé, il
s’écoule une durée = 40 ms.
1. Calculer la vitesse moyenne vA du point A entre les dates t0
et t6. Convertir cette vitesse en km.h-1.
2. Calculer la vitesse instantanée vA(t3) du point A à la date t3.
3. Représenter le vecteur vitesse du point A à la date t3.
Choisir judicieusement votre échelle …
4. Qualifier le mouvement du point A (trajectoire et vitesse). Justifier soigneusement votre réponse.

5. Qualifier le mouvement du solide. Justifier votre réponse.
En déduire la vitesse moyenne du point B entre les dates t0 et t6 et la vitesse instantanée du point B à la date t3.
Exercice IV
Le tambour d’une machine à laver a un cylindre de 46 cm de diamètre.
A l’essorage, il tourne autour de son axe fixe à 800 tr.min-1.
1. Déterminer la vitesse angulaire de rotation du tambour.
2. Calculer la vitesse d’un point de la périphérie du tambour.
3. Calculer la période de rotation du tambour.
1
/
3
100%