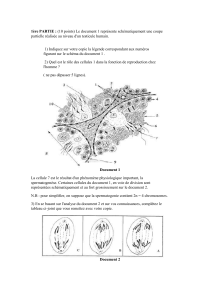
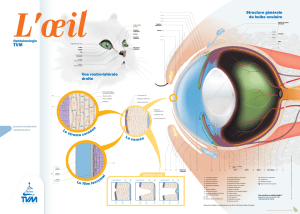
faculte de medecine henri warembourg la greffe endotheliale au

1
UNIVERSITE DU DROIT ET DE LA SANTE - LILLE 2
FACULTE DE MEDECINE HENRI WAREMBOURG
Année 2012
T H E S E P O U R L E D I P L O M E D ' E T A T
D E D O C T E U R E N M E D E C I NE
LA GREFFE ENDOTHELIALE AU CENTRE HOSPITALIER
REGIONAL ET UNIVERSITAIRE DE LILLE : RESULTATS ET
COMPLICATIONS CHEZ NOS 11 PREMIERS PATIENTS
Présentée et soutenue publiquement le 24 Octobre 2012
au Pôle Recherche de la Faculté
Par Caroline MOUTON
Jury
Président: Monsieur le Professeur Jean-François ROULAND
Assesseurs: Monsieur le Professeur Pierre LABALETTE
Monsieur le Professeur Claude-Alain MAURAGE
Monsieur le Docteur Nicolas FRANQUET
Directeur de Thèse: Monsieur le Professeur Jean-François ROULAND

7
SERMENT D’HIPPOCRATE
Je promets et je jure d’être fidèle aux lois de l’honneur et de la probité dans l’exercice
de la Médecine.
Je promets et je jure de conformer strictement ma conduite professionnelle aux
principes traditionnels.
Admis dans l’intérieur des maisons, mes yeux ne verront pas ce qui s’y passe, ma
langue taira les secrets qui me seront confiés, et mon état ne servira pas à
corrompre les mœurs, ni à favoriser le crime.
Je garderai le respect absolu de la vie humaine.
Même sous la menace, je n’admettrai pas de faire usage de mes connaissances
médicales contre les lois de l’humanité.
Respectueux et reconnaissant envers mes Maîtres, je rendrai à leurs enfants
l’instruction que j’ai reçue de leur Père.
Que les hommes m’accordent leur estime si je suis fidèle à mes promesses.
Que je sois couvert d’opprobre et méprisé de mes confrères si j’y manque.

8
SOMMAIRE
INTRODUCTION 11
1. ANATOMIE, PHYSIOLOGIE ET METHODES D’EXAMEN DE LA CORNEE 12
1.1 Anatomie 12
1.1.1 Généralités 12
1.1.2 Embryologie 12
1.1.3 L’épithélium 13
1.1.4 La couche de Bowman 18
1.1.5 Le stroma 19
1.1.6 La membrane de Descemet 21
1.1.7 L’endothélium 23
1.1.8 Innervation et nutrition de la cornée 25
1.2 Physiologie 26
1.2.1 Propriétés optiques 26
1.2.2 Contrôle des réactions inflammatoires et de l’angiogénèse 28
1.2.3 Barrières épithéliales et endothéliales 29
1.2.4 La cicatrisation cornéenne 30
1.2.5 L’innervation cornéenne 33
1.2.6 Apports nutritionnels et diffusion intraoculaire des molécules
pharmacologiques 35
1.3 Méthodes d’examen de la cornée 36
1.3.1 Examen biomicroscopique 36
1.3.2 La pachymétrie 38
1.3.3 La microscopie spéculaire 38
1.3.4 La microscopie confocale in vivo 39
1.3.5 La tomographie en cohérence optique du segment antérieur 41
1.3.6 Les autres méthodes d’examen 43
2. L’OEDEME DE CORNEE ET SES ETIOLOGIES ENDOTHELIALES 44
2.1 L’œdème de cornée 44
2.1.1 Physiopathologie de l’œdème cornéen 44
2.1.2 Symptomatologie de l’œdème cornéen 59
2.1.3 Etiologies de l’œdème cornéen 50
2.1.4 Traitement de l’œdème cornéen 52
2.2 Les étiologies endothéliales de l’œdème de cornée 54
2.2.1 Les causes traumatiques 55
2.2.2 Les causes dystrophiques 64

9
3. LES GREFFES DE CORNEE 80
3.1 La greffe de cornée en France 80
3.1.1 Législation française et agences de régulation 80
3.1.2 Les chiffres de la greffe de cornée en France 82
3.1.3 Techniques de prélèvement 83
3.1.4 Conservation des greffons cornéens 84
3.2 La kératoplastie transfixiante 90
3.2.1 Indications 90
3.2.2 Technique opératoire 90
3.2.3 Traitement postopératoire 92
3.2.4 Suivi du patient greffé 93
3.2.5 Complications 94
3.2.6 Résultats 99
3.3 La greffe endothéliale 100
3.3.1 Indications et principes 100
3.3.2 Contre-indications 101
3.3.3 Techniques chirurgicales 101
3.3.4 Résultats 108
3.3.5 Complications 110
4. PRESENTATION DE L’ETUDE 113
4.1 But de l’étude 113
4.2 Matériel et méthodes 113
4.2.1 Population 113
4.2.2 Technique chirurgicale 113
4.2.3 Suivi des patients et paramètres étudiés 114
4.3 Résultats 115
4.3.1 Présentation des cas 115
4.3.2 Présentations des résultats 142
5. DISCUSSION 150
CONCLUSION 161
ANNEXE 1 162
BIBLIOGRAPHIE 164

10
ABREVIATIONS
AV : Acuité visuelle
BMP : Bone Morphogenetic Protein
CLD : Compte Les Doigts
EGF: Epithelium Growth Factor
FGF: Fibroblast Growth Factor
D: Dioptrie
DLEK: Deep Lamellar Endothelial Keratoplasty
DSAEK: Descemet’s Stripping Automated Endothelial Keratoplasty
DSEK: Descemet’s Stripping Endothelial Keratoplasty
HGF: Hepatocyte Growth Factor
IL: Interleukine
IVCM: Microscopie Confocale In Vivo
KGF: Keratocyte Growth Factor
LAF: Lampe à fente
NGF: Nerve Growth Factor
OCT: Tomographie en Cohérence Optique
P: Parinaud
PAF: Platelet Activating Factor
PDGF: Platelet-Derived Growth Factor
PEDF: Pigment Epithelium-Derived Factor
PK: Penetrating Keratoplasty
SDF: Stromal Cell-Derived Factor
TGF: Tumor Growth Factor
TNF: Tumor Necrosis Factor
VEGF: Vascular Endothelial Growth Factor
VLMB: Voit La Main Bouger
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
1
/
167
100%