VALCAPA eT CMd de L`enfant

/!&,),$&"
1 2 + & 0 & " + + "
Fait clinique
Keywords
Anomalous origin of left
coronary artery from
pulmonary artery, Dilated
cardiomyopath, Child.
Mots-clés
Origine anormale de
l’artère coronaire gauche,
cardiomyopathie dilatée,
enfant.
.86:.<A@5.>#A.>1..@:.5.82> 696.!?..129.<A??..1.&.368
Service de cardiologie pédiatrique- hôpital La Rabta- Tunis-Tunisie
Su mm ar y
Anomalous origin of left coronary artery from the pulmonary artery (ALCAPA) is a rare congenital
malformation, most often revealed by severe dilated cardiomyopathy in infants and young children. We
report the case of a 5 year-old girl with dilated cardiomyopathy. The diagnosis of ALCAPA was suspec-
ted thanks to the electrocardiogram and Doppler echocardiography data. The child was successfully
operated on.
Ré su mé
Résumé :
La naissance d’une artère coronaire gauche à partir de l’artère pulmonaire(ALCAPA) est une malforma-
tion congénitale rare, révélée le plus souvent par une cardiomyopathie dilatée sévère chez le nourrisson
et le petit enfant. Nous rapportons le cas d’une fillette de 5 ans suivie pour cardiomyopathie dilatée, chez
qui le diagnostic d’ALCAPA a été suspecté sur les données de l’électrocardiogramme et de l’échocardio-
graphie Doppler. L’enfant a été opérée avec succès de cette malformation grave.
Anomalous origin of left coronary artery from pulmonary
artery, a rare etiology of dilated cardiomyopathy in children.
A case report and revue of literature.
Origine anormale de l’artère coronaire gauche à partir de
l’artère pulmonaire, une étiologie rare de cardiomyopathie
dilatée chez l’enfant. A propos d’un cas et revue de la littérature.
Correspondance
Docteur HAKIM Kaouthar
Service de Cardiologie pédiatrique de l'hôpital la Rabta
1007 Jebbari Tunis
Telephone: 0021671570955
Fax: 0021671570955
e-mail: [email protected]
.>16<9<462(A;6?62;;2*<9A:2"H2:2 (>6:2?@>2
67

* $( ! ""(
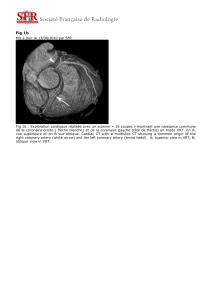
Figure 1 : Présence d’un aspect QR en latéral (DI, AVL, V5
et V6).
Figure 2 : Flux d’insuffisance mitrale avec aspect
hyperéchogène des piliers.
Figure 3 : Coronaire droite dilatée de naissance et de trajet
normaux
4eme Trimestre 2013
Cardiologie Tunisienne 68
IntroductIon
):G:BLL:G<>=xNG>:KMYK><HKHG:BK>@:N<A>UI:KMBK=>
Ex:KMYK> INEFHG:BK>) - K>IKXL>GM> NG> :GHF:EB>
<HKHG:BK> <HG@XGBM:E> K:K> +HG HIXKX> >EE> >LM
K:IB=>F>GM ?:M:E> =:GL E: IENI:KM =>L <:L "EE> >LM
K>LIHGL:;E> =xNG> <:K=BHFRHI:MAB> =BE:MX> BL<AXFBJN>
LXOYK><A>SEx>G?:GM)xXOHENMBHGLIHGM:GX>>LM@K:O>>G
=>AHKL=xNGMK:BM>F>GMIKX<H<>)>=XO>EHII>F>GM=>L
M><AGBJN>L <ABKNK@B<:E>L <HFF> E: KXBFIE:GM:MBHG
<HKHG:BK> : I>KFBL => MK:GL?HKF>K <HFIEYM>F>GM E>
IKHGHLMB<=><>MM>F:E?HKF:MBHGLHNEB@G:GME:GX<>LLBMX
=>LHG=XIBLM:@>=>O:GMMHNM><:K=BHFRHI:MAB>=BE:MX>
<A>SEx>G?:GM
oBserVAtIon
+>LMNG>?BEE>V@X>=>:GL:XMX:=K>LLX>:NL>KOB<>
=> <:K=BHEH@B> IX=B:MKBJN> IHNK ;BE:G =>
<:K=BHFRHI:MAB> =BE:MX> *! ): <:K=BHI:MAB> XM:BMM
<HGGN> =>INBL ExV@> => FHBL )x>Q:F>G <EBGBJN> :
FHGMKX NG> ARIHMKHIAB> U !0 NG KRMAF> <:K=B:JN>
KX@NEB>K U ;IF L:GL ;KNBM => @:EHI NG> M>GLBHG
:KMXKB>EE> U FF %@ NG LHN??E> LRLMHEBJN> =>
KX@NK@BM:MBHG U Ex:I>Q >M Ex:;L>G<> => LB@G>
=xBGLN??BL:G<> <:K=B:JN> )>L IHNEL IXKBIAXKBJN>L
XM:B>GMIKXL>GML>MLRFXMKBJN>L
)> ;BE:G ;BHEH@BJN> XM:BM GHKF:E >G ExH<<NKK>G<> E>L
;BE:GL MARKH]=B>G >M IAHLIAH<:E<BJN> ): K:=BH@K:IAB>
MAHK:<BJN> : FHGMKX NG> <:K=BHFX@:EB> :N =XI>GL =>L
<:OBMXL@:N<A>LNG:K<BG?XKB>NK@:N<A>:EEHG@X:LLH<BX
UNG=HN;E><HGMHNK=>ExHK>BEE>MM>@:N<A>:BGLBJNxNG>
K>=BLMKB;NMBHGO:L<NE:BK>O>KLE>LLHFF>ML
)xXE><MKH<:K=BH@K:FF> ?B@NK> Gd : H;C><MBOX NG
KRMAF>KX@NEB>KLBGNL:EU;IF>ME:IKXL>G<>=xHG=>L
.=:GLE>L=XKBO:MBHGLE:MXK:E>L!&:3)3>M3
ExX<AH<:K=BH@K:IAB> MK:GLMAHK:<BJN> HG : GHMX NG
:LI><M=><:K=BHFRHI:MAB>=BE:MX>=NO>GMKB<NE>@:N<A>
3$ :O>< NG 3$ MKYL =BE:MX >M @EH;:E>F>GM
ARIHDBGXMBJN> ): ?K:<MBHG =xXC><MBHG XM:BM >LMBFX> U
<>MM>=RL?HG<MBHGLRLMHEBJN>=N3$Lx:LLH<B:BMNG>
?NBM>FBMK:E>@K:=>&&&=x:EENK>HK@:GH?HG<MBHGG>EE>:O><
=>LIBEB>KLFBMK:NQ?B;KHLXLARI>KX<AH@YG>L?B@NK>Gd
&EGxR:O:BMI:L=xH;LM:<E>UExXC><MBHG=N3$
)x:KMYK> <HKHG:BK> =KHBM> =BE:MX> G:BLL:BM GHKF:E>F>GM
=NLBGNL<HKHG:BK>=KHBM?B@NK>Gd)>MKHG<<HKHG:BK>
@:N<A>L>F;E:BMG:BMK>=NMKHG<=>Ex:KMYK>INEFHG:BK>U
FF :N =>LLNL =>L LB@FH]=>L LHNL ?HKF> =xNG ?ENQ
KXMKH@K:=>?B@NK>Gd
BGLB E> =B:@GHLMB< => <HKHG:BK> @:N<A> :;>KK:GM>
G:BLL:GM => Ex:KMYK> INEFHG:BK> XM:BM ?HKM>F>GM
LNLI><MXBEL>K:BM<HG?BKFXI:KEx:G@BHL<:GG>K<HKHG:BK>
?B@NK>Gd

Hakim K. & al.
4eme Trimestre 2013
):I:MB>GM>:XMXMK:BMX>I:K=BNKXMBJN>LBGAB;BM>NKL=>
Ex>GSRF> => <HGO>KLBHG ;XM:;EHJN:GML >M :<B=>
L:EB<REBJN>U=HL>:GMB:@KX@:GM>
"EE> : ;XGX?B<BX =xNG> KXBFIE:GM:MBHG <HKHG:BK> LHNL
<BK<NE:MBHG >QMK:<HKIHK>EE> )>L LNBM>L HIXK:MHBK>L
XM:B>GMLBFIE>LL:GLK><HNKLUEx:LLBLM:G<>O>GMKB<NE:BK>
GBF:CHK:MBHG=>ExBL<AXFB>FRH<:K=BJN>)x>G?:GM:XMX
>QMN;X> E> =>NQBYF> CHNK IHLMHIXK:MHBK> >M LHKMB> =>
ExNGBMX=>LHBGLBGM>GLB?L:NYF>CHNKIHLMHIXK:MHBK>
)x" $IHLMHIXK:MHBK>XM:BMBG<A:G@X
)xX<AH<:K=BH@K:IAB> IHLMHIXK:MHBK> BFFX=B:M> :
FHGMKXNG>?HG<MBHG=NO>GMKB<NE>@:N<A>BG<A:G@X>>M
NG> ?NBM> FBMK:E> LM:;E> &E GxR :O:BM I:L => LB@G>
=xARI>KM>GLBHG:KMXKB>EE>INEFHG:BK>
)x>G?:GM >LM LHKMB> => ExA^IBM:E :N YF> CHNK IHLM
HIXK:MHBK> LHNL =BNKXMBJN> => Ex:GL> BGAB;BM>NK =>
Ex>GSRF>=><HGO>KLBHG>M:GMB:@KX@:GMIE:JN>MM:BK>
N=>KGB>K<HGMK^E>KX:EBLXUFHBL=>E:KXBFIE:GM:MBHG
<HKHG:BK> Ex>G?:GM >LM :LRFIMHF:MBJN> )x>Q:F>G
<:K=BHO:L<NE:BK> >LM L:GL I:KMB<NE:KBMX >G =>AHKL =xNG
LHN??E>:I>QB>G=>KX@NK@BM:MBHGFBMK:E>)x" $>LM
BG<A:G@X
)xX<AH<:K=BH@K:IAB>FHGMK>NGO>GMKB<NE>@:N<A>=BE:MX
:O>< ARIHDBGXLB> :IB<:E> >M L>IM:E> ): ?HG<MBHG
LRLMHEBJN> @EH;:E> O>GMKB<NE:BK> @:N<A> Lx>LM :FXEBHKX>
?K:<MBHG =xXC><MBHG U )xBGLN??BL:G<> FBMK:E> >LM
LM:;E>
dIscussIon
)>L :GHF:EB>L <HG@XGBM:E>L => G:BLL:G<> =>L :KMYK>L
<HKHG:BK>LLHGM IKXL>GM>L<A>S >GOBKHG U => E:
Figure 4 : Visualisation de l’artère coronaire aberrante naissant du tronc de l’artère pulmonaire (indiquée par la flèche) : A : en
bidimensionnel ; B : au Doppler couleur
Figure 5 : Naissance de l’artère coronaire (flèche) à partir du tronc de l’artère pulmonaire
4eme Trimestre 2013
Cardiologie Tunisienne 69

* $( ! ""(
4eme Trimestre 2013
Cardiologie Tunisienne 70
IHINE:MBHG-:KFB<>EE>L<BE:G:BLL:G<>=xNG>:KMYK>
<HKHG:BK> @:N<A> U I:KMBK => Ex:KMYK> INEFHG:BK>
K>IKXL>GM>NG>?HKF>>QMKZF>F>GMK:K>0HGBG<B=>G<>
>LM=>UG:BLL:G<>LOBO:GM>L"EE>
:XMX=X<KBM>>GIK>FB>KI:KKHHDL>G
"EE> >LM LHNO>GM K>LIHGL:;E> =xNG> <:K=BHI:MAB>
BL<AXFBJN>=:GLE>LIK>FB>KLFHBL=>OB>>GMK:BG:GMNG>
=RL?HG<MBHG =N O>GMKB<NE> @:N<A> NG> ?NBM> FBMK:E> >M
NG>BGLN??BL:G<><:K=B:JN><HG@>LMBO>+HGHIXKX>
>EE> >LM ?:M:E> =:GL G>N? <:L LNK =BQ =:GL NG =XE:B G>
=XI:LL:GMI:L:G
0: IARLBHI:MAHEH@B> : XMX ;B>G >QIEBJNX> I:K "=P:K=L
"G >??>M :N <HNKL => E: IXKBH=> GXHG:M:E> E>L
KXLBLM:G<>L >M E>L IK>LLBHGL INEFHG:BK>L XE>OX>L
I>KF>MM>GM =x:OHBK NG ?ENQ :GMXKH@K:=> L:MBL?:BL:GM =>
Ex:KMYK>INEFHG:BK>UE:<HKHG:BK>@:N<A>>M=><>?:BM
<>MM>F:E?HKF:MBHG>LMA:;BMN>EE>F>GM;B>GMHEXKX><A>S
E> GHNO>:NGX N=>EU => E: IXKBH=> GXHG:M:E> E:
;:BLL>=>LKXLBLM:G<>LINEFHG:BK>LLx:<<HFI:@G>=xNG>
=BFBGNMBHG=><>?ENQ:GMXKH@K:=>OHBK>=>LHGBGO>KLBHG
:O><NG?ENQKXMKH@K:=>:EE:GM=>E:<HKHG:BK>@:N<A>U
Ex:KMYK> INEFHG:BK> o <HKHG:KR LM>:E p ): I>K?NLBHG
FRH<:K=BJN> L> MKHNO> :BGLB MKB;NM:BK> => Ex:KMYK>
<HKHG:BK> =KHBM> JNB >LM =BE:MX> >M =N =>@KX =>
=XO>EHII>F>GM=>L<HEE:MXK:E>L
A>S E> GHNKKBLLHG E> M:;E>:N >LM <>ENB =xNG>
BGLN??BL:G<> <:K=B:JN> HN =xNG> <:K=BHFRHI:MAB>
=BE:MX>
)xBGLN??BL:G<> FBMK:E> LHNO>GM IKXL>GM> : NG> HKB@BG>
FBQM> HK@:GH?HG<MBHGG>EE> "G >??>M U E: =BE:M:MBHG
?HG<MBHGG>EE> => Ex:GG>:N Lx:CHNM>GM =>L EXLBHGL
BL<AXFBJN>L=>L<HK=:@>L>M=>L IBEB>KL@XGXK:GM<>MM>
?NBM> "EE> I>NM ?:BK> XOHJN>K U MHKM E> =B:@GHLMB< =x&*
<HG@XGBM:E> :O>< =BE:M:MBHG L><HG=:BK> =>L <:OBMXL
@:N<A>L
.N>EJN>LK:K>L<:LHGMXMX=X<KBML<A>SE>@K:G=>G?:GM
HN <A>S Ex:=NEM> >L ?HKF>L K>IKXL>GM>GM
NGBJN>F>GMU=>L<:L"EE>LLHGM>QIEBJNX>L
I:K NG HLMBNF <HKHG:BK> INEFHG:BK> K>LMKB<MB? >M NG>
<BK<NE:MBHG <HEE:MXK:E> :;HG=:GM> 1HNM>?HBL
ExXOHENMBHG>LMBFIKXOBLB;E>:O><KBLJN>=>LNKO>GN>=xNG
BG?:K<MNL=NFRH<:K=>HN=>FHKMLN;BM>I:KMKHN;E>L=N
KRMAF><:K=B:JN>
"M:GM NG> <:NL> <NK:;E> >M KXO>KLB;E> =>
<:K=BHFRHI:MAB> =BE:MX> E: G:BLL:G<> :GHKF:E> => E:
<HKHG:BK> @:N<A> U I:KMBK => Ex:KMYK> INEFHG:BK> =HBM
ZMK>XOHJNX>=>O:GMMHNM><:K=BHFRHI:MAB>=BE:MX> =>
Ex>G?:GM >KM:BGLXEXF>GMLHKB>GM>GMO>KL<>=B:@GHLMB<
+HNLIHNOHGL<BM>KE>L<KBMYK>LXE><MKBJN>L=>'HAGLKN=>
IKXL>GML=:GLGHMK>H;L>KO:MBHGJNB<HGLBLM>GM>G
NG>HG=>.IKH?HG=>FFIKHEHG@X> FL :O><
NG :LI><M ./ =:GL E>L =XKBO:MBHGL E:MXK:E>L >M JNB >LM
:;L>GM> =:GL E> M>KKBMHBK> BG?XKB>NK -HNK
ExX<AH<:K=BH@K:IAB> A:G@ >M EE:=: HGM XM:;EBL
JN:MK><KBMYK>L2GK:IIHKM=N=B:FYMK>=>E:<HKHG:BK>
LNK <>ENB => Ex:GG>:N :HKMBJN> NG>
ARI>KX<AH@XGB<BMX =>L IBEB>KL FBMK:NQ NG ?ENQ =HIIE>K
<HNE>NK>MINELXBGO>KLX>M<A>SE>@K:G=>G?:GMNG
?ENQ :;HG=:GM => A:NM> OXEH<BMX :N GBO>:N =N L>IMNF
BGM>KO>GMKB<NE:BK> MXFHB@G:GM =xNG> <BK<NE:MBHG
<HEE:MXK:E>BFIHKM:GM>
)xX<AH<:K=BH@K:IAB> <HNIEX> :N !HIIE>K >LM LN??BL:GM>
IHNK<HG?BKF>KE>=B:@GHLMB<=x) -JN:G=>EE>FHGMK>
<A>SNG>G?:GMIKXL>GM:GMNG><:K=BHFRHI:MAB>=BE:MX>
NG><HKHG:BK>=KHBM>=BE:MX>:LLH<BX>UNG>BGO>KLBHG=N
?ENQ=:GLE:<HKHG:BK>@:N<A>O>KLEx:KMYK>INEFHG:BK>:N
!HIIE>KINELX
!:GL E>L <:L Ha E> =B:@GHLMB< =x) - >LM LNLI><MX
=>O:GM NG> <:K=BHFRHI:MAB> =BE:MX> L:GL IHNOHBK ;B>G
OBLN:EBL>K E: F:E?HKF:MBHG U ExX<AH=HIIE>K =x:NMK>L
>QIEHK:MBHGL LxBFIHL>GM )> <HKHL<:GG>K Lx>LM
E:K@>F>GM LN;LMBMNX U Ex:G@BH@K:IAB> <HKHG:BK>
<HGO>GMBHGG>EE> >M <HGLMBMN> => GHL CHNKL NG FHR>G
=B:@GHLMB<L>GLB;E>>MI>NBGO:LB?
)> MK:BM>F>GM => Ex) - >LM <ABKNK@B<:E )xBG=B<:MBHG
HIXK:MHBK> =HBM ZMK> IHLX> =YL JN> E> =B:@GHLMB< >LM
<HG?BKFX >M E: KXI:K:MBHG =HBM ZMK> KX:EBLX> E> IENL
IKX<H<>F>GMIHLLB;E>-ENLB>NKLM><AGBJN>L<ABKNK@B<:E>L
HGM XMX =X<KBM>L ): KXBFIE:GM:MBHG =BK><M> => E:
<HKHG:BK> @:N<A> LNK Ex:HKM> IK:MBJNX> <A>S GHMK>
I:MB>GM>=>F>NK>E:M><AGBJN>E:IENLNMBEBLX>:O><E>L
F>BEE>NKL KXLNEM:ML ): M><AGBJN> => 1:D>N<AB JNB
<HGLBLM>U<HGG><M>KE:<HKHG:BK>@:N<A>:;>KK:GM>LNK
Ex:HKM> OB: NG MNGG>E BGMK:INEFHG:BK> >LM BG=BJNX> :NQ
<:LHaE:KXBFIE:GM:MBHG=BK><M>=>E:<HKHG:BK>@:N<A>
LNKEx:HKM>>LM=B??B<BE>=N?:BM=xNG>EHG@N>NKBG:=XJN:M>
=>Ex:KMYK><HKHG:BK>
):GX<>LLBMX=xNG@>LM>:LLH<BXLNKE:O:EO>FBMK:E>:XMX
EHG@M>FIL =BL<NMX> -ENLB>NKL XMN=>L HGM FHGMKX
JNx:IKYLKXBFIE:GM:MBHG<HKHG:BK>ExBGLN??BL:G<>FBMK:E>
K>LM> LM:;E> =:GL U =>L <:L >M JNxNG>
:FXEBHK:MBHG=x:NFHBGLNG@K:=>:XMXGHMX>=:GL
=>L<:L ><B>QIEBJN>Ex:MMBMN=><HGL>KO:MKB<>:=HIMX>
I:KE:IENI:KM=>LXJNBI>LJNBG><HGL>BEE>GM=>KXI:K>K
E: O:EO> JNx>G <:L => ?NBM> F:LLBO> >G IKXL>G<> =>
EXLBHGL BKKXO>KLB;E>L XOB=>GM>L HN LxBE >QBLM> NG
FX<:GBLF> GHG BL<AXFBJN> :LLH<BX "G >??>M E:
KXI:K:MBHG FBMK:E> <A>S Ex>G?:GM CN@X> =XEB<:M> >LM
LHNK<> => IKHEHG@:MBHG => E: =NKX> => E: <BK<NE:MBHG
>QMK:<HKIHK>EE> IHNO:GM GNBK> =:O:GM:@> U NG
O>GMKB<NE> @:N<A> =HGM E: ?HG<MBHG >LM =XCU :EMXKX>
): FHKM:EBMX IKX<H<> O:KB> L>EHG E>L LXKB>L => U
)>LIKBG<BI:E>L<:NL>L=>=X<YLXM:GM
E>L:KKARMAFB>LO>GMKB<NE:BK>L>ME>;:L=X;BM<:K=B:JN>
)>L ?:<M>NKL => KBLJN> => FHKM:EBMX IKX<H<> LHGM E:
=RL?HG<MBHG O>GMKB<NE:BK> @:N<A> IKXHIXK:MHBK> LXOYK>
:O>< NG> ?K:<MBHG =xXC><MBHG BG?XKB>NK> U >M E>
K><HNKLUExEx:LLBLM:G<>O>GMKB<NE:BK>FX<:GBJN>>GIHLM
HIXK:MHBK>):O:E>NKIKHGHLMBJN>=>E:LXOXKBMX=>Ex&*
IKXHIXK:MHBK>>LM<HGMKHO>KLX>
)>K><HNKLEx:LLBLM:G<>O>GMKB<NE:BK>>GIHLMHIXK:MHBK>

Hakim K. & al.
4eme Trimestre 2013
>LMGX<>LL:BK>=:GLU=>L<:LL>EHGE>LLXKB>L
)>L ?:<M>NKL IKX=B<MB?L => K><HNKL U Ex:LLBLM:G<>
O>GMKB<NE:BK> FX<:GBJN> >G IHLM HIXK:MHBK> LHGM E:
=RL?HG<MBHG 3$ IKXHIXK:MHBK> LXOYK> ExXM:M <EBGBJN>
<KBMBJN>IKXHIXK:MHBK>I:MB>GMLLHNLBGHMKHI>LIHLBMB?L
>ME:=NKX> IKHEHG@X> =>E:<BK<NE:MBHG >QMK:<HKIHK>EE>
): KX<NIXK:MBHG => E: ?HG<MBHG =N O>GMKB<NE> @:N<A>
:IKYL K>O:L<NE:KBL:MBHG >LM E: KY@E> "EE> >LM H;L>KOX>
=:GLNG=XE:BJNBO:KB>L>EHGExV@>HIXK:MHBK> >=XE:B
G>=XI:LL>I:LE>LFHBLLBE>F:E:=>>LMHIXKX:O:GM
ExV@>=xNG:G>MI>NM:EE>KE><:LX<AX:GMCNLJNxU:GL
-HNKGHMK>F:E:=>GHNLG>=BLIHLHGL I:L >G<HK> =xNG
K><NE LN??BL:GM +HNL IKX<HGBLHGL NG> LNKO>BEE:G<>
<EBGBJN> >M X<AH@K:IABJN> KX@NEBYK> IHNK XO:EN>K E:
?HG<MBHGO>GMKB<NE:BK>>MExXOHENMBHG=>E:?NBM>FBMK:E>
)>IKHGHLMB<UFHR>G>MEHG@M>KF>L>LM;HGF:BLBEK>LM>
<HG=BMBHGGXI:KE>KBLJN>=>FHKMLN;BM>I:KMKHN;E>L=N
KRMAF>BG<BM:GMUNG>LNKO>BEE:G<>K:IIKH<AX>I:K%HEM>K
KRMAFBJN> I:KMB<NEBYK>F>GM :N <HNKL => E: IXKBH=> =>
KX<NIXK:MBHG=>E:?HG<MBHGO>GMKB<NE:BK>@:N<A>
):LNKOB>U:GL=XI:LL>=:GLE:IENI:KM=>L
LXKB>L
!>L KXBGM>KO>GMBHGL U FHR>G >M U EHG@ M>KF> HGM XMX
K:IIHKMX>L=:GLU=>L<:L&ELx:@BM=:GL
E: IENI:KM =>L <:L => KXBGM>KO>GMBHGL IHNK BGLN??BL:G<>
FBMK:E>IENLK:K>F>GM=xNG>:G@BHIE:LMB><ABKNK@B<:E>=>
E:<HKHG:BK>@:N<A>KXBFIE:GMX>HN=xNGIHGM:@>:HKMH
<HKHG:BK>
conclusIon
):G:BLL:G<> :GHKF:E>=xNG> <HKHG:BK>@:N<A> UI:KMBK
=> Ex:KMYK> INEFHG:BK> >LM NG> <:NL> K:K> =>
<:K=BHFRHI:MAB> =BE:MX> <A>S Ex>G?:GM !N ?:BM => E:
KXO>KLB;BEBMX => E: <:K=BHFRHI:MAB> :IKYL MK:BM>F>GM
<ABKNK@B<:E>EE>=HBMZMK>LRLMXF:MBJN>F>GMXOHJNX>>M
K><A>K<AX> =:GL E> <:=K> =N ;BE:G XMBHEH@BJN>
)xX<AH<:K=BH@K:IAB>!HIIE>KI>KF>ME>IENLLHNO>GM=>
?:BK> E> =B:@GHLMB< !:GL E>L :NMK>L <:L <x>LM E>
<HKHL<:GG>K HN E: <HKHG:KH@K:IAB> JNB I>KF>MM>GM =>
K><HGG:BMK><>MM>:GHF:EB>):KXBFIE:GM:MBHG<HKHG:BK>
=BK><M> LNK Ex:HKM> >LM E: M><AGBJN> => KX?XK>G<> 2G
@>LM> LNK E: O:EO> FBMK:E> Gx>LM BG=BJNX JNx>G <:L =>
?NBM>F:LLBO>HN LxBE >QBLM>NG>:NMK><:NL> :LLH<BX> U
Ex&* )> IKHGHLMB< EHBGM:BG >LM LHNO>GM ;HG F:BL NG>
LNKO>BEE:G<> <EBGBJN> X<AH@K:IABJN> >M KRMAFBJN> >LM
BG=BLI>GL:;E>
reFerences
:LM>G:=:/'HG:L/*:R>KL'">M:E HKHG:KR:KM>KB>L
:GHF:EB>L :K=B:< LNK@>KR H? MA> G>HG:M> :G= BG?:GM
-ABE:=>EIAB:-0:NG=>KLs
!:OBL' ><<ABG#'-HKMF:G**:CHK<HKHG:KR:KM>KR
:GHF:EB>L BG I>=B:MKB< IHINE:MBHG &G<B=>G<> :G= <EBGB<:E
BFIHKM:G<>'F HEE :K=BHE
KHHDL%1PH<:L>LH?:G:;GHKF:E<HKHG:KR:KM>KRH?MA>
A>:KM :KBLBG@ ?KHF MA> INEFHG:KR :KM>KR PBMA LHF>
K>F:KDL NIHG MA> >??><M H? MABL :GHF:ER BG IKH=N<BG@
<BK<HB= =BE:MBHG H? MA> O>LL>EL':G:M-ARLBHE
!:AE>$#B:G>")BG=;>K@%)) -:IHLLB;E>K>:LHG
?HKFBMK:EBGLN??B<B>G<R:G=A>:KM?:BENK>BGRHNG@I:MB>GML
0<:G= :K=BHO:L<'
4>LL>EAH>?M%#:P<>MM'0'HAGLHGGHF:EHNLHKB@BGH?
MA> E>?M <HKHG:KR :KM>KR ?KHF MA> INEFHG:KR MKNGD &ML
<EBGB<:ELI><MKNFI:MAHEH@R:G=IARLBHI:MAHEH@R;:L>=HG
:K>OB>PH?<:L>LPBMAL>O>G?NKMA>K<:L>L BK<NE:MBHG
$:RGHK '4 (:BL>K )/ (KHG &) :G= :E HKHG:KR :KM>KR
:GHF:EB>L BG <ABE=K>G *:LM>KR H? <:K=BHMAHK:<B< LNK@>KR
-ABE:=>EIAB:-)BIIBG<HMMs/:O>G
"=P:K=L '" 1A> =BK><MBHG H? ;EHH= ?EHP BG <HKHG:KR
:KM>KB>L :KBLBG@ ?KHF MA> INEFHG:KR MKNGD BK<NE:MBHG
/:F[K>S 0 NKB NKB -' :E=>KHG<HEF>GKH ' >M :E
,NM<HF>L H? HKHG:KR />BFIE:GM:MBHG ?HK HKK><MBHG H?
GHF:EHNL,KB@BGH?)>?M HKHG:KRKM>KR#KHF-NEFHG:KR
KM>KR/>O"LI :K=BHE
*HH=B>,0#R?>!$BEE >M:EGHF:EHNLHKB@BGH?MA>
E>?M <HKHG:KR :KM>KR ?KHF MA> INEFHG:KR :KM>KR E:G=
4ABM> s$:KE:G= LRG=KHF> BG :=NEM I:MB>GML EHG@ M>KF
?HEEHPNI:?M>KLNK@>KRF%>:KM'
#K:IB>K'*)><E>KJ#H=BGH*>M:E*:EB@G:GMO>GMKB<NE:K
:KKARMAFB:L K>O>:EBG@ :GHF:EHNL HKB@BG H? MA> E>?M
<HKHG:KR:KM>KR?KHFMA>INEFHG:KR:KM>KRBGMPH:=NEML
"NK'<:K=BHMAHK:<0NK@
3BLDBG0>EA:LL>G-:K>=>L>M:EGHF:EHNLHKB@BGH?
MA>E>?M<HKHG:KR:KM>KR?KHFMA>INEFHG:KR:KM>KRK>IHKM
H? :G:=NEMPBMAO>GMKB<NE:K?B;KBEE:MBHG:LMA>IK>L>GMBG@
LRFIMHFF%>:KM'
&@:(%HKB(*:MLNFNK:1>M:EGHF:EHNLHKB@BGH?MA>
E>?M<HKHG:KR:KM>KR?KHFINEFHG:KR:KM>KRBG:R>:KHE=
PHF:G IK>L>GMBG@ O>GMKB<NE:K M:<AR<:K=B: ?KHF :GM>KH
L>IM:EL<:K'IG BK<'
E>QB*>LDBLAOBEB 3 >K@>K # 4>G@ 3 >M :E GHF:EHNL
HKB@BG H? MA> E>?M <HKHG:KR :KM>KR ?KHF MA> INEFHG:KR
:KM>KRBG:=NEML' :K=0NK@
'HAGLKN=> ->GR ' ><<ABG # >M :E !B??>K>G<B:MBG@
:GHF:EHNLE>?MF:BG<HKHG:KR:KM>KRHKB@BG:MBG@?KHFMA>
INEFHG:KR:KM>KRBGBG?:GML ?KHFFRH<:K=BMBL:G==BE:M>=
<:K=BHFRHI:MA;R>E><MKH<:K=BH@K:FF' :K=BHE
A:G@ -(/ EE:=: 3 "E><MKH<:K=BH@K:IAB< :G=
4eme Trimestre 2013
Cardiologie Tunisienne 71
 6
6
1
/
6
100%