Document

Les molécules et
les solutions
Chapitre 2


Exemple de molécule
Mg(NO3)2

La règle de l’octet (révision)
•Règle chimique simple qui énonce que les
atomes tendent à se combiner de façon à avoir
huit électrons dans leur couche de valence ce
qui leur donne la même structure électronique
qu'un gaz inerte.

Définitions: les ions
•Atomes qui portent une charge électrique à la suite de la
perte ou du gain d’un ou de plusieurs électrons.
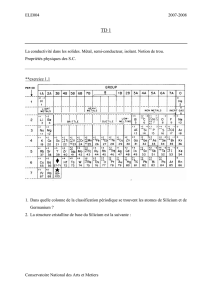
•Vérifions grâce au tableau périodique ou page 41 volume.
Ion qui a perdu un électron = ion positif
Cation
Ion qui gagne un électron = ion négatif
Anion
•Définition: les ions polyatomiques: groupe de deux
atomes ou plus chimiquement liées et portant une charge
électriques à la suite de perte ou de gain d’électron(s)
Voir page 44 volume: à savoir par
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%