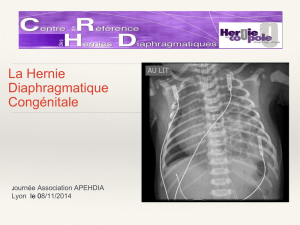
Ease the stress of managing ARDS

Ease the stress of
managing ARDS
Traduction de : Jacobs, M. (2005). Ease the stress of managing ARDS,
Nursing made Incredibly Easy!, 3(1), 6-18
À plusieurs égards, le syndrome de détresse respiratoire aigüe est
encore un mystère aujourd’hui. Aucun traitement n’est véritablement
efficace, et le taux de mortalité reste élevé. Ainsi, votre identification
précoce des signes et symptômes de son apparition peut faire toute la
différence pour la survie de votre patient. Voici un aperçu de ce que
vous devriez savoir au sujet de ce syndrome.
Le syndrome de détresse respiratoire aigue (SDRA) a été découvert
durant la guerre du Vietnam, vers la fin des années 1960. Les médecins
se demandaient pourquoi de jeunes hommes, blessés mais autrement
en bonne santé, développaient soudainement un ensemble de
symptômes multi-systémiques qui commençaient de façon inexpliquée
par une détresse respiratoire sévère. Plus de 50 ans plus tard, le SDRA
reste un casse-tête, malgré les efforts pour le définir et l’expliquer, et le
taux de mortalité est pratiquement le même qu’en 1960 : entre 55 et
70% lorsque le SDRA est secondaire à un sepsis, et entre 35 et 45%
lorsqu’il survient suite { un trauma.
Le jeu des noms
Dans les dernières années, le SDRA a changé de nom plusieurs fois :
choc pulmonaire, wet lung, poumon du Vietnam, syndrome de détresse
respiratoire post-traumatique, et poumon de reperfusion. Peu importe
le nom, il est une menace pour la vie. On définit aujourd’hui le SDRA
comme un syndrome aigu multi systémique provoqué par un
évènement non traumatique (comme le sepsis) ou par toute forme de
trauma mineur ou majeur, et qui entraîne une détresse respiratoire
aigüe. Les conditions qui mènent au SDRA peuvent être définies comme
primaires (directes) ou secondaires (indirectes) (voir encadré Quelle
insulte!). L’œdème pulmonaire en l’absence d’insuffisance cardiaque
gauche est la signature du SDRA.
Certaines conditions préexistantes comme fumer, avoir une maladie
pulmonaire chronique, ou souffrir d’alcoolisme chronique, augmente le
risque de développer un SDRA de façon significative. Il est donc plus
fréquent chez les personnes de 65 ans et plus, mais le fait d’être un
homme ou une femme n’a aucune incidence. Maintenant que le SDRA
est défini, voyons sa pathophysiologie.
Une question de fuite…
Le SDRA débute par une phase dite exudative qui correspond à
l’altération de la perméabilité de la membrane alvéolocapillaire. Des
médiateurs immunitaires et inflammatoires endommagent les parois
des capillaires pulmonaires, ce qui entraîne trois évènements.
Premièrement, les lésions endothéliales augmentent la perméabilité
capillaire, ce qui provoque une fuite des liquides et de certaines
molécules (médiateurs chimiques immunitaires et inflammatoires,
protéines, globules rouges, etc) de l’espace intra vasculaire { l’espace
interstitiel. Ces molécules endommageront davantage la membrane des
capillaires. Deuxièmement, le mince écart qui sépare normalement la
membrane capillaire de la membrane alvéolaire s’agrandit en raison de
la fuite de liquides dans l’espace interstitiel. Cela diminue l’efficacité
des échanges gazeux, particulièrement celui de l’oxygène (O₂). En effet,
le dioxyde de carbone (CO₂) diffuse plus facilement à travers la
membrane alvéolocapillaire œdématiée parce qu’il est hydrosoluble,
contrairement { l’O₂. Troisièmement, cette accumulation de liquide
interstitiel crée une pression sur les parois alvéolaires, qui s’affaissent.
L’atélectasie (ou affaissement des alvéoles) amène une diminution de
la surface disponible pour les échanges gazeux.
Ces deux derniers évènements provoquent un shunt intrapulmonaire.
Physiologiquement, le sang veineux désoxygéné s’amène dans les
capillaires pulmonaires pour être réoxygéné par les échanges gazeux
pulmonaires. Il y a un shunt intrapulmonaire lorsque ce sang
désoxygéné ne réussit pas à être réoxygéné. Il retourne ainsi dans le
cœur gauche pour être pompé dans la circulation systémique. Ce sang
artériel hypoxémique (hypoxémie = diminution de l’oxygène dans le
sang) ne réussira pas à combler les besoins en oxygène des tissus, ce
qui provoquera éventuellement de l’hypoxie (hypoxie = diminution de
l’oxygène cellulaire) et une atteinte multi organique.
Quelle insulte !
Insultes primaires pouvant causer un SDRA
Aspiration du contenu gastrique
Pneumonie (souvent bilatérale)
Embolie graisseuse
Quasi-noyade (augmentation du risque développer un SDRA si
eau salée)
Toxicité à l’oxygène
Ventilation mécanique prolongée
Brûlures étendues
Trauma thoracique (contusion pulmonaire)
Radiothérapie thoracique
Intoxication par inhalation (fumée, ammoniaque, pesticides, etc)
Insultes secondaires pouvant causer un SDRA
Chirurgie cardiaque importante
Anaphylaxie
Coagulation intravasculaire disséminée (CIVD)
Surdose médicamenteuse de narcotiques (héroïne, méthadone)
ou de sédatifs (barbituriques)
Éclampsie
Fractures des os longs
Transfusions sanguines multiples
Pancréatite
Sepsis
Traumas multiples (incluant autres que thoraciques)
Hypotension prolongée
Mais que verriez-vous cliniquement chez votre patient durant la phase
exudative? Il sera agité, nerveux, et il se plaindra de dyspnée. Vous
pourriez observer une tachypnée avec légère utilisation des muscles
accessoires, mais les bruits pourraient être normaux { l’auscultation. À
ce moment-ci, les résultats de gaz artériels révèleraient une légère
alcalose respiratoire, et une pression artérielle en O₂ (PaO₂) normale.
En effet, lorsque la membrane alvéolocapillaire commence à être
altérée au début de la phase exudative, la fréquence et l’amplitude
respiratoire va augmenter dans le but d’accroître la disponibilité de
l’oxygène dans les alvéoles (mécanisme de compensation). Cette
tachypnée permet au CO₂ d’être expulsé rapidement, et la pression
artérielle en CO₂ (PaCO₂) diminue (alcalose respiratoire). Rappelez-
vous : l’oxygène a plus de la difficulté que le CO₂ à diffuser à travers la
membrane alvéolocapillaire altérée puisqu’elle n’est pas hydrosoluble.
Ainsi, le pH et la PaCO₂ ne sont pas de bons indicateurs de la
progression de la phase exudative, contrairement à la PaO₂, qui va être
précocement influencée par la difficulté à faire des échanges gazeux
pulmonaires.
Pendant que l’espace interstitiel se remplit progressivement de liquide,
que les alvéoles s’affaissent et que le shunt intra pulmonaire s’installe,

la réaction immunitaire et inflammatoire initiale fait converger des
plaquettes et des facteurs de coagulation vers les capillaires
pulmonaires. Ces médiateurs vont s’agglutiner et créer des
microthrombus. D’autre part, la pression exercée par l’œdème
interstitiel commence à affecter aussi les capillaires pulmonaires,
créant une compression qui diminue la lumière des capillaires. Ces
deux évènements vont entraver le flot sanguin dans les capillaires.
Une situation compromettante
Alors que le SDRA progresse vers la phase dite proliférative, la
compliance des poumons diminue. Le tissu pulmonaire devient de plus
en plus rigide et fibrotique, en raison de l’œdème, et les pneumocytes
de type 2 cessent de fabriquer le surfactant. Le surfactant, une
lipoprotéine, est essentiel parce qu’il permet de maintenir en tout
temps l’ouverture des alvéoles, en diminuant la tension de surface
alvéolaire. L’absence de surfactant provoque une atélectasie massive et
les alvéoles affaissées ne peuvent plus participer aux échanges gazeux.
Cette situation provoque une hypoxémie réfractaire à
l’oxygénothérapie, puisque l’augmentation de l’apport en O₂
n’amènera aucune amélioration.
Sans surprise, une détresse respiratoire va s’installer. Vous observerez
une tachypnée et une utilisation accrue des muscles accessoires. Des
crépitants seront clairement audibles { l’auscultation, puisque le fluide
accumulé dans l’espace interstitiel se déplace maintenant vers
l’intérieur des alvéoles. Une altération de l’état mental et de l’état de
conscience sera observable, en lien avec l’hypoxie qui affecte le
cerveau : le patient agité deviendra somnolent, et son état d’éveil
progressera vers le coma.
En plus de l’hypoxémie (PaO₂ < 80 mmHg), les résultats des gaz
artériels vont montrer une augmentation de PaCO₂ (hypercapnie).
L’équilibre acido-basique évolue d’une alcalose respiratoire initiale à
une acidose respiratoire parce que l’œdème interstitiel accroit
progressivement la distance entre les capillaires et les alvéoles. La
difficulté à diffuser les gaz à travers la membrane affecte maintenant
aussi le CO₂, malgré la tachypnée.
Observez également les paramètres hémodynamiques. La pression
artérielle pulmonaire (PAP) est généralement élevée en SDRA.
Rappelez-vous, il y a diminution du flot sanguin dans les capillaires
pulmonaires { cause de la compression créé par l’œdème et { cause de
la formation de microthrombus. Le travail d’éjection du ventricule
droit (post-charge) est augmenté par cette résistance accrue. Par
contre, la pression artérielle pulmonaire occluse (PAPO) risque d’être
normale puisque cette pression reflète la précharge du cœur gauche. Le
SDRA n’est pas un problème de contractilité ventriculaire gauche, c’est
un problème de déséquilibre de ventilation/perfusion pulmonaire.
L’observation d’une PAPO normale confirme que l’œdème pulmonaire
ne résulte pas d’une défaillance du ventricule gauche.
Pas de fin heureuse
Si le SDRA progresse vers la phase fibrotique, l’issue est irréversible. À
ce moment, la fibrose s’est propagée { travers tout le tissu pulmonaire
et la diminution importante de la compliance amène un espace mort
pathologique étendu, qui s’ajoute au shunt intra pulmonaire déjà
existant. L’hypoxémie sévère provoque une hypoxie qui affecte tous les
organes et les tissus, et qui se conclue par l’apparition d’un syndrome
de dysfonction multi-organique.
La tachycardie compensatoire ne suffit plus à maintenir un débit
cardiaque suffisant et la pression artérielle baisse. Le patient aura la
peau froide, moite, et marbrée. Les taux d’enzymes hépatiques sériques
augmenteront et l’oligurie s’installera, parce que le foie et les reins
seront mal perfusés. Le décès sera attribuable { l’ensemble de ces
insuffisances organiques, plutôt qu’{ une défaillance respiratoire seule.
Le prix de la survie
La convalescence dure des semaines et souvent des mois. Un patient
qui survit à un SDRA souffre habituellement de séquelles à long terme
qui provoquent une altération chronique des échanges gazeux (p. ex.,
perte permanente de tissu pulmonaire, compliance pulmonaire réduite
et capacité vitale diminuée). Il peut développer une intolérance à
l’activité physique qui peut mener à une diminution permanente de la
capacité à faire ses AVQ et à participer à des activités sociales, en plus
de le rendre plus vulnérable aux infections respiratoires.
Signes et symptômes précoces
Votre identification des signes précoces de SDRA est cruciale pour
améliorer les chances de survie de votre patient. Voici certains signes
et symptômes précoces qui peuvent être observés :
Dyspnée rapidement progressive (c’est généralement la
préoccupation principale du patient)
Signes de détresse respiratoire :
o Tachypnée (avec hypocapnie et alcalose respiratoire au début)
o Tirage
o Utilisation des muscles accessoires
o Bruits respiratoires audibles
o Battements des ailes du nez
Hypotension
Diaphorèse
Des faits…
Chaque année aux États-Unis, près de 150 000 patients
développent un SDRA. Environ 50% de ceux-ci en
ressentent les premiers symptômes 24 heures après l’insulte
initiale (traumatique ou non). Les autres développent le
SDRA dans la semaine qui suit l’évènement initial.
Pour le médecin, les critères diagnostiques du SDRA sont les suivants :
Condition primaire bien identifiée (trauma mineur ou majeur,
infection, pancréatite, etc)
Infiltrats bilatéraux à la radiographie pulmonaire, qui progressent
rapidement vers le « poumon blanc »
Absence d’insuffisance cardiaque aiguë ou chronique, observée par
une PAPO normale ou basse
Ratio PaO₂/FiO₂ < 200 ou PaO₂ < 50 mmHg avec FiO₂ { 100%.
Voyons maintenant quels sont les traitements possibles.
Donner de l’oxygène… et bien plus
La plupart des patients en SDRA ont besoin d’une aide ventilatoire
mécanique, pour diminuer l’effort respiratoire, favoriser le repos et la
guérison des poumons, et améliorer les échanges gazeux. Les
indications de ventilation mécanique en SDRA incluent :
Tachypnée > 30/min
PaCO₂ > 45 mmHg
PaO₂ < 60 mmHg malgré l’augmentation de la FiO₂
Volume/minute > 12 à 15 L/min
Capacité vitale forcée < 20 mL/kg

Le bon et le moins bon
La pression expiratoire positive (PEP) est un atout majeur du
traitement par ventilation mécanique pour les patients en SDRA. La
PEP permet de garder les alvéoles ouvertes pendant tout le cycle
respiratoire. Elle est considérée essentielle dès que le patient nécessite
une FiO₂ > 50% pour maintenir une PaO₂ normale. La PEP a plusieurs
effets, négatifs et positifs, sur l’ensemble des systèmes mais l’effet le
plus notable se voit sur les systèmes pulmonaire et circulatoire.
Au niveau pulmonaire, la PEP diminue l’affaissement des alvéoles,
augmente la capacité vitale, améliore la compliance, diminue le shunt
intrapulmonaire et favorise le dégagement des petites voies
respiratoires. Mais cela vient aussi avec des conséquences néfastes: la
PEP peut causer une surdistension des alvéoles, et ainsi provoquer des
barotraumas (dommage au parenchyme pulmonaire en raison de
l’augmentation de la pression et du volume). Le risque et le nombre de
barotraumas augmentent avec la durée de l’usage de la PEP et de son
intensité, et les parois alvéolaires les plus vulnérables finissent par se
rompre. Sur le système cardiovasculaire, l’impact négatif de la PEP se
voit dans l’augmentation de la pression intrathoracique, qui, { partir
d’un certain degré, diminue le retour veineux. Elle créé aussi une
augmentation de pression sur le cœur durant la diastole, ce qui
empêche les chambres cardiaques de se remplir de façon optimale. Ces
deux conditions peuvent diminuer le débit cardiaque.
À la recherche de la bonne dose
Dans les dernières décennies, plusieurs avenues pharmacologiques ont
été tentées pour traiter le SDRA. Malheureusement, aucune ne s’est
avérée totalement efficace. Voici un aperçu des traitements
pharmacologiques qui sont tout de même utilisés, malgré leur succès
limité :
Antibiotiques : L’antibiothérapie ciblée (avec sensibilité
microbienne déterminée par résultat de culture) est utilisée pour
contrer le processus pathologique sous-jacent du SDRA secondaire à
un sepsis. L’antibiothérapie de départ doit être puissante et à large
spectre, puis spécifique au microorganisme en cause dès que les
résultats de culture sont connus.
Corticostéroïdes : L’usage des corticostéroïdes pour traiter le
SDRA est controversé, mais des résultats positifs ont été démontrés
dans quelques études. Les corticostéroïdes pourraient prévenir
l’agrégation des globules blancs dans les capillaires pulmonaires, et
ainsi réduire le phénomène de congestion vasculaire qui limite le flot
sanguin. Ils pourraient également favoriser la production de surfactant,
et rétablir la perméabilité normale de la membrane alvéolocapillaire.
Par contre, il est reconnu que les corticostéroïdes affectent le système
immunitaire, et cela peut être fatal pour les patients souffrant de SDRA.
Vasodilatateurs : Les vasodilatateurs, comme la nitroglycérine et le
nitroprussiate (Nipride), sont principalement utilisés pour gérer
l’hypertension pulmonaire associée au SDRA. Mais des inotropes,
comme la dopamine ou la dobutamine, devront alors être utilisés
conjointement aux vasodilatateurs pour maintenir la pression
artérielle systémique.
Bronchodilatateurs : L’albutérol (Proventil, Ventolin) et
l’aminophylline sont des bronchodilatateurs utilisés pour ouvrir les
voies respiratoires. Ils agissent en relaxant les muscles lisses de l’arbre
bronchique, mais ils n’ont aucune action sur les alvéoles.
Mucolytiques : L’acétylcystéine (Mucomyst) permet de liquéfier le
mucus, pour favoriser sa mobilisation et son expectoration.
Diurétiques : Le furosémide (Lasix) est un diurétique de l’anse qui
peut être utilisé pour diminuer l’œdème interstitiel et alvéolaire. En
diminuant le volume sanguin circulant, il diminue le retour veineux et
la congestion vasculaire pulmonaire. La diminution de la précharge
pourrait toutefois avoir un impact néfaste sur l’hémodynamie,
particulièrement en sepsis.
Colloïdes : Les colloïdes, comme l’albumine, peuvent mobiliser le
fluide interstitiel vers l’espace intravasculaire en augmentant la
pression oncotique dans les capillaires. Par contre, cela pourrait au
contraire faire augmenter l’œdème interstitiel puisque, en SDRA, la
perméabilité anormale de la membrane alvéolocapillaire va laisser
passer ces molécules dans l’espace interstitiel. Le liquide
supplémentaire sera alors attiré vers l’espace interstitiel dans le but de
rééquilibrer la pression oncotique interstitielle, créant ainsi plus
d’œdème. Pour cette raison, les colloïdes ne devraient être administrés
que lorsque la perméabilité normale de la membrane est rétablie.
Opioïdes, sédatifs et bloqueurs neuromusculaires : Les
patients sous ventilation mécanique peuvent nécessiter une sédation
pour maintenir une ventilation adéquate, spécialement si des efforts
respiratoires spontanés vont { l’encontre du mode ventilatoire
optimal : autrement dit, si le patient « combat » la ventilation
mécanique programmée. Les opioïdes et les benzodiazépines
augmentent le confort et diminuent l’effort respiratoire. Si la sédation
ne parvient pas à stopper les efforts respiratoires, un bloqueur
neuromusculaire est conseillé. La paralysie induite par ce type de
médicament va permettre d’augmenter l’efficacité de la ventilation
mécanique tout en diminuant la consommation en O₂ du patient.
Acide nitrique (NO) : Ce gaz agit comme un relaxant vasculaire
pulmonaire. Il réduit l’hypertension pulmonaire et améliore le ratio
ventilation/perfusion.
Prostaglandines E : L’usage de prostaglandines E est encore
expérimental en SDRA, mais quelques études ont montré qu’elles
pouvaient produire une vasodilatation et inhiber l’agrégation
plaquettaire. En sepsis, cette vasodilatation induite devra être contrée
par l’ajout de vasopresseurs.
Surfactant en aérosol : Les nouveau-nés prématurés souffrant de
détresse respiratoire reçoivent du surfactant en aérosol, mais ce
traitement s’est avéré inefficace dans les études faites chez l’adulte.
Ventilation liquide partielle (VLP) : Cette thérapie implique
une infusion graduelle de perfluorocarbones via le tube endotrachéal
du patient. Le perfluorocarbone est un liquide inerte, dense, qui permet
aux gaz (O₂ et CO₂) de diffuser plus librement. Ainsi, l’oxygène
distribué par la ventilation mécanique circule aisément à travers le
perfluorocarbone pour passer des alvéoles aux capillaires. L’avantage
de la VPL est d’augmenter la capacité résiduelle fonctionnelle :
l’exsudat alvéolaire, contenant les médiateurs inflammatoires, s’en
trouvera plus facilement délogé des voies respiratoires inférieures.
L’autre avantage est que le perfluorocarbone sert de PEP, en
maintenant l’ouverture des alvéoles durant toute la durée du cycle
respiratoire. Ce « PEP liquide » contrebalance l’atélectasie et améliore
le ratio ventilation/perfusion et la compliance pulmonaire. Le patient
chez qui l’on utilise ce traitement doit absolument être sous sédation,
sinon il aura l’impression de se noyer. Malgré que la VLP semble
prometteuse, elle n’a pas démontré une réduction de la mortalité
jusqu’{ maintenant.

Rôles de soutien
Comme la pharmacothérapie n’est pas d’une efficacité notable, les
interventions non-pharmacologiques ont un rôle très important en tant
que traitements de support. Voyons ce qui peut être fait.
Dégagement des voies respiratoires : Le dégagement des voies
respiratoires, assuré par le patient ou par succion trachéale, permet de
maintenir l’ouverture des voies respiratoires supérieures ainsi que des
alvéoles. Assurez-vous d’hyperoxygéner le patient sous ventilation
mécanique avant toute aspiratoire endotrachéale. L’hyperoxygénation,
avec une FiO₂ { 100% pendant 2 { 5 minutes, prévient l’hypoxémie.
Maximisez le temps de succion pour qu’il soit le plus court possible,
tout en ayant un nombre de passage du cathéter d’aspiration dans le
tube endotrachéal le plus petit possible, parce que tout débranchement
de la ventilation mécanique signifie un arrêt du PEP. Cet arrêt
transitoire, couplé { une diminution de la disponibilité de l’oxygène
durant l’aspiration, peut entraîner une désaturation qui peut se
maintenir plusieurs minutes après la fin de la succion, et cette
hypoxémie compromet le rétablissement du patient. Les systèmes clos
d’aspiration (p. ex., TrachCare) sont une aide précieuse pour éviter
cette situation. Ils permettent d’introduire le cathéter d’aspiration dans
le tube endotrachéal sans avoir à déconnecter le ventilateur, ainsi la
PEP ne s’interrompt pas durant la succion.
Tourner, tourner : La mobilisation fréquente du patient par des
rotations latérales continues est une façon efficace d’améliorer les
échanges gazeux. Elle évite aux régions des poumons d’être en position
dépendante durant une longue période de temps. On croit que cela
facilite le recrutement alvéolaire et améliore la capacité résiduelle
fonctionnelle. La position ventrale (prone position) est aussi une
intervention efficace. Cette position améliore l’oxygénation, et diminue
les risques de barotraumas et de toxicité { l’oxygène. Lorsque vous
placez votre patient en position ventrale, assurez-vous d’avoir
plusieurs personnes disponibles pour vous aider. Surveillez
étroitement la réponse du patient car il est fréquent qu’une instabilité
hémodynamique survienne. Soyez également attentifs à toute
désaturation en oxygène provoquée par la mobilisation. Le risque
d’extubation est aussi très présent.
Impact hémodynamique : Surveillez étroitement l’impact
hémodynamique des traitements, particulièrement la diminution du
débit cardiaque qui peut être la conséquence de la diminution du
retour veineux en raison de la PEP. Soyez alerte aux changements de
pression artérielle, { la diminution de la force du pouls, { l’altération de
l’état mental et de l’état de conscience, et { la diminution de la diurèse.
Au niveau des résultats de laboratoire, surveillez particulièrement le
taux d’hémoglobines (transport de l’oxygène) et des marqueurs
inflammatoires/infectieux comme les globules blancs.
Compter les calories : Ne sous-estimez pas l’importance du
soutien nutritionnel chez une personne en situation critique de santé
sous ventilation mécanique. Ces patients ont des besoins caloriques
élevés en raison de l’hyper métabolisme provoqué par la réaction
inflammatoire de l’organisme, et le processus de réparation/
régénération tissulaire. Si le tractus digestif est fonctionnel,
l’alimentation entérale est privilégiée. Sinon, une alimentation
parentérale doit être amorcée. La nutritionniste choisira probablement
un produit faible en carbohydrates. Les carbohydrates se transforment
en dioxyde de carbone (CO₂) et peuvent augmenter le taux de CO₂
sanguin, ce qui est contre-productif puisque le système respiratoire
cherche { diminuer l’excès de CO₂. La tendance actuelle est d’utiliser
des produits riches en acides gras polyinsaturés. On croit que ceux-ci
aident à la restauration de la perméabilité de la membrane
alvéolocapillaire, préviennent l’agrégation plaquettaire, et diminuent la
libération des médiateurs inflammatoires. Ils pourraient donc jouer un
rôle important pour diminuer la progression du SDRA.
Lavez vos mains! L’hygiène rigoureuse des mains (lavage des
mains, utilisation d’un agent lavage sans eau { base d’alcool) est la
seule intervention vraiment efficace dans le contrôle de la transmission
des infections nosocomiales, qui sont en hausse partout en Amérique
du Nord.
D’autres interventions d’hygiène et d’asepsie incluent :
Utilisation d’une technique stérile pour tous changements de
pansements, incluant ceux des lignes centrales, des accès veineux
et artériels périphériques, et de toute autre instrumentation
invasive.
Aspiration des sécrétions endotrachéales au besoin seulement,
selon votre évaluation clinique.
Soins bucco-dentaires fréquents pour prévenir l’accumulation de
bactéries favorisant la plaque dentaire. Ces bactéries se
transportent dans les voies respiratoires inférieures, causant la
pneumonie induite par ventilation mécanique (PAV). Des solutions
de rince-bouche et des brosses à dents adaptées au patient intubé
sont à utiliser pour assurer des soins de bouche efficaces.
Retirer dès que possible toute instrumentation invasive pour
diminuer les portes d’entrée aux pathogènes.
Quoi de neuf?
Les plus récents traitements pour le SDRA incluent un bas volume
inspiratoire, un PEP minimal, et l’hypercapnie permissive. Chez les
patients les plus critiques sous ventilation mécanique, un volume
inspiratoire entre 10 et 15 mL/kg est acceptable pour répondre aux
suppléments d’oxygénation demandé par l’hyper métabolisme. Mais
chez les patients souffrant de SDRA, on doit viser plus bas pour limiter
le risque de barotraumas, soit entre 5 et 8 mL/kg. La PEP doit être
entre 5 et 20 cmH₂O : plus haut, le risque de barotraumas devient trop
important, et plus bas, les alvéoles s’affaisseront par la perte de
fonction des pneumocytes. Quant { l’oxygénothérapie, on cherche
généralement à ne pas dépasser une FiO₂ de plus de 60% (0,6) afin de
prévenir la toxicité { l’oxygène. Par contre, il faut garder en tête que
l’objectif du traitement en SDRA n’est pas de maintenir la FiO₂ sous les
60%, mais bien de maintenir la PaO₂ > 60 mmHg et une SaO₂ > 90%,
avec la plus petite FiO₂ possible.
Restons aux aguets
Même si l’issue d’un SDRA est rarement sans séquelle, il importe
d’utiliser les interventions qui semblent les plus adéquates pour traiter
et soutenir le patient. Rappelez-vous que de nouveaux traitements sont
essayés, donc gardez vos connaissances et vos compétences cliniques à
jour. L’important reste d’identifier précocement les patients qui
présentent un SDRA pour leur donner les meilleures conditions de
survie possibles.

Que se passe-t-il dans l’alvéole?
Phase 1 : Les plaquettes et les médiateurs chimiques (histamine [H],
sérotonine [S], bradykinine [B]) s’agglutinent et réduisent le flot
sanguin aux poumons.
Phase 2 : Ces substances provoquent de l’inflammation au niveau de la
membrane alvéolocapillaire. Les dommages endothéliaux amènent une
augmentation de la perméabilité capillaire et les fluides passent de
l’espace intravasculaire à l’espace interstitiel. Il y a formation d’œdème
interstitiel.
Phase 3: L’augmentation de perméabilité capillaire permet aux
protéines, et autres molécules de fuir vers l’espace interstitiel, ce qui
modifie la pression osmotique et augmente davantage l’œdème
interstitiel.
Phase 4: La diminution du flot sanguin dans les capillaires
pulmonaires et la présence de fluides dans les alvéoles endommagent
les cellules productrices de surfactant (pneumocytes-2). Ce qui résulte
en un affaissement des alvéoles (atélectasie) qui compromet
gravement les échanges gazeux et la compliance pulmonaire.
Phase 5 : Les échanges gazeux pulmonaires sont gravement
compromis et la PaO2 diminue.
Phase 6 : Les échanges gazeux deviennent pratiquement impossibles à
faire. L’inflammation persistante provoque progressivement de la
fibrose dans le tissu pulmonaire.
1
/
5
100%