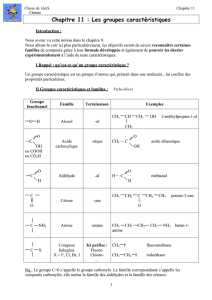
+1 - Cours de chimie générale

Chimie Organique
des processus biologiques

R Nom Codes pKa pKa pKa pI
(COOH) (NH3+) fct S/ R
H Glycine Gly G 2,3 9,6 - 6,0
Groupe alkyle
CH3Alanine Ala A 2,3 9,7 - 6,0
CH(CH3)2Valine Val V 2,3 9,6 - 6,0
CH2CH(CH3)2Leucine Leu L 2,4 9,6 - 6,0
CHCH2CH3Isoleucine Ile I 2,4 9,6 - 6,0
CH3
CH3- Phénylalanine Phe F 1,8 9,1 - 5,5
COOH*
HN HProline Pro P 2,0 10,6 - 6,3
CH2
Les S-2-aminoacides naturels les plus courants COO-
H3N H
R
+
Les AA essentiels sont soulignés, $ ctructure entière

R Nom Codes pKa pKa pKa pI
(COOH) (NH3+) fct S/ R
Avec fonction hydroxyle
CH2OH Sérine Ser S 2,2 9,2 - 5,7
CHOH (R) Thréonine Thr T 2,1 9,1 - 5,6
CH3
H2C- -OH Tyrosine Tyr Y 2,2 9,1 10,1 5,6
Avec fonction amino
O
CH2CNH2Asparagine Asn N 2,0 8,8 - 5,4
O
CH2CH2CNH2Glutamine Gln Q 2,2 9,1 - 5,7
CH2(CH2)3NH2Lysine Lys K 2,2 9,0 10,5 9,7
NH
(CH2)3NHCNH2 Arginine Arg R 2,2 9,0 12,5 10,8
Tryptophane Trp W 2,8 9,4 - 5,9
Histidine His H 1,8 9,2 6,1 7,6
CH3
HN
CH3
N
NH

R Nom Codes pKa pKa pKa pI
(COOH) (NH3+) fct S/ R
Avec fonction mercapto ou sulfure
CH2SH (R) Cystéine Cys C 2,0 10,3 8,2 5,1
CH2CH2SCH3Méthionine Met M 2,3 9,2 - 5,7
Avec fonction carboxylique
CH2COOH Acide aspartique Asp D 1,9 9,6 3,7 2,8
CH2CH2COOH Acide glutamique Glu E 2,2 9,7 4,3 3,2
pI = point isoélectrique, pH auquel l'ampleur de la protonation = à celle de la
déprotonation (moyenne arithmétiue des 2 pka de l'AA).
C'est au point isoélectrique que les molécules s'agrègent et que les protéines peuvent
cristalliser.

Groupe fonctionnel pKa ds résidu AA
dans chaîne latérale R (charge à pH 7)
Ac. carboxylique -CH2COOH 4,76
Asp, Glu (-1)
Ion imidazolium 6,95
His (~0)
Thiol -CH2SH10,3
Cys (~0)
Ion alkylammonium -(CH2)4NH3+ 10,66
Lys (+1)
+NH2
Guanidino -(CH2)3NHCNH212,5 Arg (+1)
Eau H2O 15,74
Alcool -CH2OH16,00
Tyr, Ser (0)
-CH2-Ph-OH
NN-H
H+
COO-
H3N H
R
+
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
1
/
52
100%