Olfaction chez les insectes I

Olfaction chez les insectes I
Christophe Pouzat
3 novembre 2004
Laboratoire de Physiologie Cérébrale, CNRS UMR 8118
UFR biomédicale de l’Université René Descartes
45, rue des Saints Pères, 75006 Paris
tel : 01 42 86 38 28
e-mail : christophe.pouzat@univ-paris5.fr
oueb :
http://www.biomedicale.univ-paris5.fr/physcerv/C_Pouzat.html
1

1 Olfaction et comportement
L’un des intérêts majeurs de l’étude de l’olfaction chez les insectes est l’abondance
des données établissant un lien clair entre olfaction et comportement. Le but de ce
premier cours va être, en quelque sorte, de vous convaincre que le système olfactif
des insectes constitue un formidable modèle pour le neuroéthologiste.
On peut ainsi étudier des questions un peu moins « triviales » que la distinction
entre Chanel n◦5 et premier cru classé de Bordeau...
Si on trouve aussi parfois qu’on entend trop parler (selon les gouts) : de biologie mo-
léculaire, de biochimie, d’électrophysiologie, de génétique, d’éthologie, d’anatomie,
voir même d’écologie ; nous allons voir que l’olfaction liée au comportement nous
permet de générer une image, je l’espère, équilibrée.
Avec les insectes nous allons voir aussi que nous sommes amenés à faire un échan-
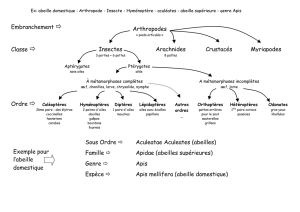
tillonage un peu plus exhaustif de l’Arche de Noé. Nous allons ainsi parler d’abeilles,
de bourdons, de nombreux papillons de nuits, de blattes, de mouches ce qui nous
changera des grands classiques que sont la souris et le rat (de laboratoire).
2

1.1 Conditionnement olfactif chez l’abeille domestique Apis
mellifera et d’autres insectes : extension du proboscis
FIG. 1 – Exemples de conditionnement (extension du proboscis) chez les insectes. En
haut une abeilles (Apis mellifera), au milieu un bourdon (Bombus terestris) en bas
le papillon du ver du cotonnier (Spodotera litoralis). Sources : haut et milieu [14],
bas [5].
3

On applique en fait un paradigme pavlovien (conditionnement associatif) classique
[13,23,9,15]. On cherche d’abord un stimulus qui déclenche une réponse compor-
tementale chez (presque) tous les individus de l’espèce : c’est le stimulus incondi-
tionnel. Dans le cas qui nous occupe, le contact entre les antennes et/ou la langue
(proboscis) de l’insecte avec une solution riche en sucrose déclenche chez tout in-
dividu “normal” la réponse d’extension du proboscis (proboscis extension response,
PER). On cherche ensuite un stimulus dont la présentation ne provoque aucune
réponse comportemetale typique, comme l’odeur de citron. Ce sera notre stimulus
conditionnel. On présente ensuite à l’animal l’odeur, avant de lui présenter la solu-
tion sucrée. Après quelques répétitions, l’animal commence à répondre à l’odeur en
tirant la langue, avant que la solution sucrée soit présentée. Chez Pavlov, le chien
salive en entendant la cloche avant de voir sa gamelle.
Lorsqu’on travaille “correctement” on effectue aussi un protocole d’ « association
inversée » (backward pairing) où la présentation d’une odeur différente suit la pré-
sentation de la solution sucrée. La présentation de cette autre odeur seule ne doit
alors pas déclencher de réponse comportementale. Le premier protocole est appelé
forward pairing en anglais. En d’autres termes on veut que l’animal apprenne que
le stimulus conditionnel lui permet de prédire l’arrivée du stimulus inconditionnel.
4

FIG. 2 – Schémas de forward et backward pairings. On remplace aussi parfois le
backward pairing par un unpaired stimulus, c’est-à-dire une odeur présentée seule
sans renforcement avec du sucrose. 5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
1
/
68
100%