Un même gène pour plusieurs protéines


4444
Un même gène pour
plusieurs protéines
FABIEN SCHWEIGHOFFER
Au cours de l’évolution, les mécanismes de la synthèse
des protéines se sont dotés d’un moyen d’offrir
aux cellules une diversité quasi infinie de protéines
à partir d’un nombre limité de gènes : l’épissage alternatif.
L’être humain et le chimpanzé, son plus proche cousin,
ont en commun 98,7 pour cent de leurs gènes. La diffé-
rence suffit-elle à expliquer leurs dissemblances tant mor-
phologiques que comportementales et cognitives?
L’équipe de Svante Pääbo, de l’Institut Max Planck, à Leip-
zig, en Allemagne, a montré que la distinction résulte surtout
de variations dans l’expression des gènes selon les organes:
très similaires dans des organes, tel le foie, ou dans le sang,
la quantité de protéines fabriquées par le cerveau humain
est notablement supérieure à celle que présente le cerveau
des autres primates. Nous devrions notre «supériorité» à une
expression génétique plus intense dans notre cerveau.
Ainsi, les génomes diffèrent peu, mais la façon dont les cel-
lules les utilisent varie, et ce, grâce à un mécanisme élaboré,
la synthèse protéique. Celle-ci consiste d’abord à transcrire
les gènes de l’ADN en ARN prémessagers, puis, après un
processus de maturation nommé épissage, à traduire ces ARN
devenus messagers en protéines. Ce mécanisme participe à
la diversité du monde vivant et a joué un rôle dans l’appa-
rition de l’être humain; de nombreux acteurs le contrôlent
et le guident dans l’accomplissement de sa tâche. Si la trans-
cription participe à la différence entre l’être humain et les
autres primates, la seconde étape de la synthèse protéique,
l’épissage, a joué un rôle dans la «supériorité» des mammi-
fères par rapport aux autres animaux.
En effet, un dogme de la génétique voulait que le nombre
de gènes diffère peu de celui des protéines fabriquées par les
cellules. Or, le dogme est tombé. En 2001, deux organisations
rivales ont séquencé le génome humain. Le résultat est sans
appel, et confirme ce que des études préalables avaient mon-
tré: le génome humain est constitué de 30 000 à 40 000 gènes
seulement, à peine trois fois plus qu’une mouche
(14000 gènes). Passée la surprise, il convenait d’expliquer
comment la complexité et surtout la diversité d’organisation
des tissus des mammifères s’accommodent d’un nombre
de gènes relativement proche de celui d’organismes moins
évolués. Un élément de réponse est apporté par la confron-
tation des informations issues des programmes de séquen-
çage des génomes avec les résultats des séquençages d’ARN
messagers: chez l’homme, le nombre d’ARN messagers est
supérieur à 100 000, soit environ trois fois plus que de
gènes. Ainsi chaque gène donne quelque trois ARN, chacun
donnant une protéine différente. On commence à entrevoir
d’où vient la différence entre la drosophile et l’homme!
C’est précisément ce que nous allons examiner. Après avoir
décrit les étapes qui mènent d’un gène à une protéine, nous
détaillerons les mécanismes et les rôles de l’épissage, dont
nous verrons qu’il existe un épissage constitutif – la matura-
tion proprement dite – et un épissage alternatif, à l’origine de
la diversité des ARN messagers produits à partir d’un même
gène, puis les conséquences pathologiques des dysfonction-
nements de cet épissage alternatif. Enfin, nous examinerons
pourquoi les biologistes fondent beaucoup d’espoir sur l’épis-
sage alternatif pour élucider le fonctionnement des cellules
et pour mettre au point de nouveaux médicaments.
Du gène aux ARN et de l’ARN aux protéines
Ainsi, au cours de l’évolution, une stratégie a été sélection-
née qui autorise la production de plusieurs ARN messagers
et, par conséquent, de plusieurs protéines, à partir d’un seul
gène: il s’agit de l’épissage, l’une des étapes clefs de l’ex-
pression génétique. Les ARN prémessagers, copiés de l’ADN,
sont une succession de régions codantes, les exons, qui sont
traduites en protéines, et de régions non codantes, les introns.
L’épissage constitutif consiste à éliminer ces derniers et à
juxtaposer les exons pour former un ARN messager mature
qui est ensuite traduit en une protéine par les ribosomes.
L’épissage alternatif multiplie les résultats de cette matura-
tion. En effet, tous les exons ne sont pas retenus pour former
l’ARN messager mature: pour au moins 60 pour cent des gènes
humains, l’épissage alternatif se superpose à l’épissage
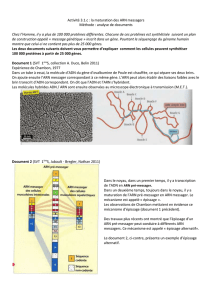
1. UNE CELLULE contient entre 30 000 et 40 000 gènes. Cependant,
elle fabrique au moins trois fois plus de protéines. L’ARN polymé-
rase copie le gène en un ARN prémessager composé d’exons codants
et d’introns non codants qui sont éliminés durant l’épissage
constitutif. Selon le contexte cellulaire, certains exons sont conser-
vés, d’autres sont éliminés et les exons restants sont juxtaposés :
c’est l’épissage alternatif. Au final, selon l’ARN messager obtenu,
un même gène code plusieurs protéines.
© POUR LA SCIENCE - N° 296 JUIN 2002
296 - SCHWEIGHOFFER 03/05 14/05/02 12:41 Page 44 cla Maquettistes:cla(Celine Lapert):296 PLS:Flashage 296:296- SCHWEIGHOFFER:

ADN
PORE NUCLÉAIRE
RIBOSOME
ARN MESSAGER 2
ARN MESSAGER 1
ARN PRÉMESSAGER
INTRON
EXCISÉ
ARN POLYMÉRASE
PROTÉINE 1
PROTÉINE 2
CYTOPLASME
NOYAU
ÉPISSAGE
ALTERNATIF
Delphine Bailly
296 - SCHWEIGHOFFER 03/05 14/05/02 12:41 Page 45 cla Maquettistes:cla(Celine Lapert):296 PLS:Flashage 296:296- SCHWEIGHOFFER:

constitutif et, selon le contexte cellulaire,
ajoute ou retire un exon pour former
l’ARN messager mature. Les multiples
protéines fabriquées à partir de ces ARN
messagers sont des isoformes protéiques.
Dans telle cellule, un gène donné
code une protéine, alors que dans une
autre cellule, ou dans la même à un
moment différent, le même gène code
une autre protéine, différant de la pre-
mière par une portion de sa séquence
en acides aminés. Ces deux protéines
peuvent avoir des fonctions différentes.
Par exemple, de nombreuses cellules
sécrètent de la fibronectine, une pro-
téine adhésive. Cependant, celle des
fibroblastes est dotée de domaines pro-
téiques grâce auxquels elle se fixe aux
cellules, alors que celle des cellules du
foie est dépourvue de ces domaines et
qu’elle est transportée par le sang.
Un destin de protéine
Le génome, c’est-à-dire le répertoire des
gènes d’un organisme dont le support
est l’ADN, donne naissance, via la trans-
cription, à un répertoire constitué d’ARN
nommé transcriptome. L’ADN est un
polymère de nucléotides (voir la figure 3),
des molécules constituées d’acide phos-
phorique, d’un sucre, le désoxyribose,
et d’une molécule nommée base azotée
dont les quatre principales sont l’adé-
nine, la thymine, la cytosine et la gua-
nine. L’adénine et la guanine, dérivées
de la purine, sont des bases puriques;
la thymine et la cytosine sont des bases
pyrimidiques. La protéine est codée par
les bases. L’ARN diffère par la nature du
sucre, le ribose, de ses nucléotides, et
par une base pyrimidique, l’uracile, qui
remplace la thymine. L’ADN et l’ARN
sont deux acides nucléiques orientés:
dans un nucléotide, l’acide phospho-
rique est lié à l’atome de carbone numé-
roté 5' de la molécule de sucre. Les
nucléotides s’associent par des liai-
sons ester de l’acide phosphorique d’un
nucléotide à l’atome de carbone 3' du
sucre du nucléotide suivant. Ainsi, un
brin d’ADN (ou un brin d’ARN) a une
extrémité 5' et une extrémité 3'.
Le transcriptome est composé de
deux catégories d’ARN: les précurseurs
des ARN messagers, ou ARN prémes-
sagers, et les ARN messagers matures.
Les ARN prémessagers sont des copies
quasi conformes des gènes. Ce sont
plus exactement des copies «en néga-
tif» de l’ADN, en raison des lois d’ap-
pariement des bases complémentaires.
En effet, lors de la synthèse protéique
(voir la figure 2), une enzyme, l’ARN
polymérase, parcourt le gène et
fabrique peu à peu l’ARN prémessager
en respectant les règles d’appariement
qui résultent de la structure des bases
azotées: aux bases adénine, thymine,
cytosine et guanine de l’ADN corres-
pondent respectivement les bases ura-
cile, adénine, guanine et cytosine de
l’ARN. Puis l’ARN prémessager est
transformé en un ARN messager lors
de l’épissage : l’épissage constitutif
enlève seulement les introns, alors que
l’épissage alternatif ôte parfois un ou
plusieurs exons.
Ainsi, certains gènes donnent nais-
sance à plusieurs versions d’ARN mes-
sagers matures, distincts par un ou
plusieurs exons, à l’origine de plu-
sieurs protéines différentes. Par
exemple, le gène neurexin (voir la
figure 4), qui code des protéines par-
ticipant à la formation des synapses,
peut être à l’origine de plus de
2 000 ARN messagers matures diffé-
rents. Le nombre de protéines diffé-
rentes codées par un même gène atteint
parfois plusieurs dizaines de mil-
liers. Le dogme «un gène, une pro-
téine» a vécu!
À l’instar de la transcription, où, par
exemple, une séquence d’ADN nom-
mée promoteur indique où l’ARN poly-
mérase se fixe, l’épissage est commandé
par des séquences d’ARN, présentes
dans les ARN prémessagers, et par de
nombreux édifices moléculaires com-
posés d’ARN et de protéines. Les pre-
miers indiquent aux seconds où ils
doivent se fixer. On dit que les premiers
agissent en cis (de l’intérieur de l’ARN
prémessager), alors que les seconds
agissent en trans (de l’extérieur).
Certaines séquences cis sont pré-
sentes aux jonctions entre les exons et
les introns, d’autres, nommées silen-
ceurs ou activateurs, influent à dis-
tance sur l’épissage. Nous verrons que
ces séquences qui agissent à distance
participent plus particulièrement à
l’épissage alternatif, alors que les
séquences qui marquent les extrémi-
tés des exons et des introns inter-
viennent dans les deux types
d’épissages. Ces dernières séquences
© POUR LA SCIENCE - N° 296 JUIN 2002
2. LA SYNTHÈSE DES PROTÉINES. Dans le
noyau d’une cellule, un gène (1) est transcrit
par une enzyme, l’ARN polymérase, en un ARN
prémessager (2), qui est une succession (3)
d’exons codants et d’introns non codants. Lors
de l’épissage (4), les introns sont éliminés et
les exons juxtaposés dans l’ARN messager
mature (5). Celui-ci sort du noyau et est tra-
duit par les ribosomes (6) en une protéine (7).
ARN POLYMÉRASE
ARN PRÉMESSAGER
ARN MESSAGER
MATURE
INTRON
ÉLIMINÉ
RIBOSOME
PROTÉINE
1
2
3
4
5
6
7
46
296 - SCHWEIGHOFFER 03/05 14/05/02 12:42 Page 46 cla Maquettistes:cla(Celine Lapert):296 PLS:Flashage 296:296- SCHWEIGHOFFER:

sont bien conservées à travers le règne
vivant et on les représente par des
séquences consensus où apparaissent
les bases communes: par exemple, un
intron commence toujours par une
guanine et un uracile. En revanche,
les séquences des silenceurs et des acti-
vateurs varient notablement et on ne
les identifie qu’au cas par cas.
La maturation des ARN prémessa-
gers met en jeu cinq petites particules
ribonucléoprotéiques nucléaires
(PRNpn), composées d’ARN et de pro-
téines, nommées U1, U2, U4, U5 et U6,
qui fonctionnent en synergie avec un
grand nombre d’autres protéines. Ces
complexes reconnaissent sur les ARN
prémessagers plusieurs endroits (voir
la figure 3): l’extrémité 5’ des introns,
constituée de quatre bases ; une
séquence de branchement, d’environ
dix bases, et un enchaînement de 14
bases pyrimidiques, la cytosine et l’ura-
cile, proches de l’extrémité 3’ (cet
enchaînement est parfois ponctué de
quelques bases puriques); enfin, l’ex-
trémité 3’ elle-même, longue de quatre
bases, qui marque la fin de l’intron.
Les intermédiaires de l’assemblage
des différents complexes sur les ARN
prémessagers ont été mis en évidence
et ont révélé les étapes de l’épissage
(voir l’encadré de la page 48). Peu à peu,
des molécules, dont les PRNpn U1, U2,
U4, U5 et U6, mais aussi des protéines
nommées SR, dotées d’un domaine
dit SR riche en acides aminés sérine et
arginine, se lient à l’ARN prémessager,
le replient, puis éliminent les introns.
Cette succession d’événements est le
propre de l’épissage constitutif. Com-
ment devient-il alternatif?
Les protéines du destin
Dans certains cas (voir l’encadré de la
page 49), notamment quand la séquence
de bases pyrimidiques est interrom-
pue par des bases puriques, la recon-
naissance d’un site d’épissage requiert
la fixation de protéines SR sur des
séquences activatrices d’épissage situées
dans les exons. Or, ces séquences sont
aussi la cible d’autres protéines, telles
les protéines PRNhn A1 qui influent sur
l’épissage: selon que les protéines SR
sont plus (ou moins) abondantes dans
le noyau que les protéines PRNhnA1, un
seul intron ou un exon flanqué de deux
introns, est éliminé.
La compétition entre les protéines
à domaine SR et les protéines PRNhn A1
est ainsi le facteur essentiel de l’épissage
alternatif. En amont, le fonctionnement
de ces protéines, et, par conséquent,
l’épissage alternatif lui-même, est com-
mandé par les différents chemins de
signalisation cellulaire où une molécule
messagère extracellulaire, entraîne, par
sa fixation à un récepteur membranaire,
une cascade de réactions intracellulaires.
Les chemins de signalisation cellu-
laire modifient notamment la phos-
phorylation (la fixation de groupes
acides phosphoriques) des protéines SR
et des protéines PRNhn. Par exemple, la
phosphorylation des protéines PRNhnA1
entraîne leur reconnaissance par des pro-
téines du cytoplasme qui les empêchent
de pénétrer dans le noyau où les pro-
téines SF2/ASF sont donc en excès rela-
tif. Puisqu’elles favorisent l’excision des
introns seuls, tous les exons sont conser-
vés. Toutefois, les différentes protéinesSR
sont également modifiées par des phos-
phorylations qui changent leur affi-
nité pour l’ARN.
L’épissage alternatif, par la diver-
sité qu’il offre, participe pour une grande
part à l’orientation du destin des cel-
lules, telles la mort cellulaire program-
mée, nommée apoptose, ou la
différenciation cellulaire. Ainsi, la
toxicité des céramides, des molécules
qui dérivent des lipides membranaires,
est reliée à une diminution de la phos-
phorylation des protéines SR qui
entraîne une modification de l’épissage
des ARN prémessagers des pro-
téinesBclx et de la caspase 9. Ces deux
protéines sont des facteurs essentiels de
l’apoptose: la première est une protéine
anti-apoptose ; la seconde est une
enzyme qui dégrade les protéines, une
sorte d’«exécuteur» présent en perma-
nence dans la cellule sous une forme
inactive. En l’absence de céramides,
les protéines codées empêchent l’apop-
tose, alors qu’en présence des compo-
sés toxiques, les nouvelles isoformes
protéiques résultant de la modifica-
tion de l’épissage participent directe-
ment à la mort cellulaire. Par exemple,
les nouvelles isoformes des caspases
sont actives et dégradent les protéines
des cellules qui meurent.
L’épissage alternatif est adapté aux
nécessités de la multiplicité des pro-
grammes de différenciation. Les spé-
cialisations cellulaires nécessaires à la
47
© POUR LA SCIENCE - N° 296 JUIN 2002
APyr.
EXON 1
EXON 2
5'
EXTRÉMITÉ 5'
DE L'INTRON
EXTRÉMITÉ 3'
DE L'EXON
EXTRÉMITÉ 3'
DE L'INTRON
SÉQUENCE ACTIVATRICE
DE L'ÉPISSAGE
EXTRÉMITÉ 5'
DE L'EXON 2
INTRON
SÉQUENCE DE
BRANCHEMENT
ENCHAÎNEMENT DE
BASES PYRIMIDIQUES
3'
G U A G
3. L’ARN PRÉMESSAGER est une succession de nucléotides (ci-contre),
composés d’une base azotée purique (adénine ou guanine) ou pyri-
midique (uracile ou cytosine), d’un sucre, le ribose, et d’acide
phosphorique qui les relie entre eux selon une direction 5’ vers 3’.
Cet enchaînement constitue une succession d’exons (ci-dessus,
en vert) et d’introns (en rouge). On distingue plusieurs régions
qui participent à l’épissage : les jonctions entre les exons et les
introns, où la guanine (G) et l’uracile (U) marquent le début des
introns (extrémité 5’) ; les jonctions entre les introns et les exons
où l’adénine (A) et la guanine (G) indiquent la fin des introns (extré-
mité 3’) ; enfin, dans chaque intron, une séquence de branchement,
reconnue par les molécules participant à l’épissage et qui contient tou-
jours une adénine (A) et un enchaînement de bases pyrimidiques (Pyr). Par
ailleurs, les exons contiennent aussi des séquences activatrices de l’épissage.
SUCRE
BASE PURIQUE BASE PYRIMIDIQUE
ATOME 5'
DU SUCRE
ATOME 3'
DU SUCRE
ACIDE
PHOSPHORIQUE
296 - SCHWEIGHOFFER 03/05 14/05/02 12:42 Page 47 cla Maquettistes:cla(Celine Lapert):296 PLS:Flashage 296:296- SCHWEIGHOFFER:
 6
6
 7
7
 8
8
 9
9
1
/
9
100%