1
:22 / 23
8
Examen normalisé
session mai 2023
3h
Coefficient
7
L’usage de la calculatrice scientifique non programmable est autorisé
CHIMIE (7 points)
:22 / 23
8
Chimie (7 points)
Physique-chimie
Option
2
Partie (1)/(3,5Pts )
L’aspirine est le médicament le plus consommé au monde. L’aspirine peut se
présenter sous de multiples formes (comprimés simples ou effervescents, poudre
soluble, etc...), chacune renfermant de l'acide acétylsalicylique de formule C9 H 8 O4 .
Par dissolution d'une masse m d'acide acétylsalicylique pur, on prépare un volume
V 500ml d'une solution aqueuse d'acide acétylsalicylique, notée ( S ) , de
3
PH 2 ,9 et de concentration molaire en soluté apporté : C A 6.10 mol .l
Dilution et dosage d’une solution d’acide acétylsalicylique de
formule
/ Préparation d’un ester
C9 H7 O4(
C9 H 8 O4( aq ) H 2O( l )
aq ) H 3O( aq )
H 3O 35 ,0 mS .m 2 .mol 1 et C 9 H7 O4
Diffraction de la lumière monochromatique et spectre
d’émission de l’ atome d’hydrogène.
Physique (2) :(2points)
Formation des noyaux du radon
par la désintégration
des noyaux du radium
Physique (3) :(5points)
Etude du dipôle idéal
et de la modulation
d’amplitude
Physique (4) :(4points)
Les oscillations mécaniques du pendule de torsion
3,6 mS .m .mol
2
1
Masse molaire moléculaire de l'acide acétylsalicylique
m C 9 H 8O4 180 g. mol
Physique (1) :(2 points)
.
On donne l’équation de la réaction entre la molécule C9 H 8 O4 et l'eau :
Données :
Conductivités molaires ioniques à 25°C :
Le sujet comporte 5 exercices
1
1
1) Dresser le tableau d'avancement de l’équation de la réaction en utilisant les
expressions littérales.
2)Calculer la masse m.
3) Calculer le taux d'avancement final de la réaction et conclure.
4) Montrer que l’expression de la constante d’équilibre de cette réaction est liée à
et C A par la relation suivante : K
2
1
.C A et montrer que PK A 3 ,5 pour le
couple C9 H 8 O4( aq ) / C9 H7 O4(
aq ) .
5) Calculer la conductivité
éq de la solution à l’équilibre.
6) Lorsqu’ on mélange le volume V1 5ml de la solution ( S1 A ) avec le volume Veau
de l’eau distillée, on obtient une nouvelle solution ( S 2 A ) de concentration C 2 A .
On dose le volume V3 20 ml cette nouvelle solution ( S 2 A ) avec une solution de
HOaq de concentration molaire C B 2.10 3 mol / l .
soude Naaq
On donne les coordonnées du point de demi-équivalence :
VBE1/ 2 5 ml et PH1/ 2 3 ,5 .
3
:22 / 23
8
Les valeurs de Veau , C 2 A sont :
(1) : 25 ml ,2.103 mol .l 1 , ( 2 ) : 30 ml ,103 mol .l 1 ,( 3 ) : 25 ml ,103 mol .l 1
Partie (2)/(3,5Pts )
On prépare un ester ( E ) en réalisant la réaction entre l’acide carboxylique ( A ) et
un alcool ( B ) avec chauffage à reflux .
Le mélange est équimolaire no ( A ) no ( B ) no 5mol
On donne les formules semi-développées de l’acide et l’alcool.
O
CH3
CH
C
C2H5
CH2
OH
OH
CH3
1) Donner le nom de ( A ) et celui ( B ) .
2) Ecrire l’équation de cette réaction en utilisant les formules semi-développées.
3) Quelles sont les caractéristiques de cette réaction ?
4) Pourquoi on a utilisé le chauffage à reflux ?
5) Dresser le tableau d’avancement de cette réaction et déduire que le taux
d’avancement de cette réaction est lié à sa constante d’équilibre K par la
relation suivante :
K
1 K
6) On donne K 4 ; calculer .
7) Comment on peut augmenter le taux d’avancement de cette réaction
( le rendement à l’équilibre)?
Physique (I) . (2 Pts)
Données :
1
8
La célérité de la lumière dans l’air est : C 3.10 m.s .
L’écart angulaire entre le centre de la tache centrale brillante et la 1ère
extinction lors de la diffraction par une fente ou par un fil est exprimé par la
relation
a
avec a la largeur de la fente ou le diamètre du fil et la
longueur d’onde de la lumière utilisée.
Pour petit, on considère que tan( ) en radian.
4
:22 / 23
8
On réalise l’expérience de diffraction par une lumière monochromatique de
longueur d’onde : 658nm .
On place à quelques centimètres de la source laser une fente verticale de largeur
a 52,6 m .
La figure de diffraction obtenue est observée sur un écran vertical placé à une
distance D 1m de la fente.
Cette figure est constituée d’une série de taches lumineuses situées sur une
perpendiculaire à la fente.
La largeur de la tache centrale est notée par L . (voir figure ci-dessous)
1)Parmi les deux propositions (1)
et (2), choisir celle qui est juste.
Le phénomène de diffraction
montre que :
(1) : la lumière est de nature
corpusculaire
(2) : la lumière est de nature
ondulatoire
2) Calculer la fréquence de cette
onde.
3) Montrer que l’expression de la
largeur a de la fente s’écrit sous la forme: a
2. .D
et calculer la valeur L .
L
4) Calculer en électronvolt ( ev ) l’énergie de ce photon sachant que la constante
de Planck est h 6 ,63.10 34 J .s et 1ev 1,6.10 19 J
5) On donne la la relation de Ritz-Rydberg pour la série de Balmer de l’émission de
1 1
RH 2 avec RH 10 ,97.106 m1 et n le
n2
4 n
nombre quantique. Calculer n sachant que la longueur d’onde de la lumière
rouge émise par l’atome d’hydrogène est : n2 658nm
l’atome d’hydrogène :
1
Physique (2) (2Pts) :
I. Désintégration du Radium.
5
:22 / 23
8
Ce gaz radioactif naturel est issu des roches contenant de l'uranium
U et du
226
radium 88 Ra .
A
226
Le radon Z Rn se forme par désintégration du radium 88 Ra , selon l'équation de
réaction nucléaire suivante :
226
88
A
Z
Rn He .
Ra
4
2
On donne la loi de décroissance radioactive : N(t ) No .e
t
et la constante
ln 2
radioactive
t1/ 2
1) Quel est le type de radioactivité correspondant à cette réaction de
désintégration? Calculer A et Z.
N ( ZA Rn )
A
2) On pose r
, avec N ( Z Rn ) le nombre de noyaux de radon formés
226
N ( 88 Ra )
226
et N ( 88 Ra ) nombre de noyaux de radium réstants à l’instant t.
Montrer que : t .ln( r 1 ) .
3) Calculer le rapport r sachant que t 3t 1 / 2 .
9
4) Un échantillon de radium de masse m0 et d’activité ao 24.10 Bq à
a .M
t1/ 2 et calculer mo .
l’instant t 0 0 , montrer que mo o
N A .ln2
5) Calculer E l’énergie de cette désintégration spontanée.
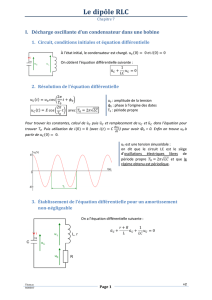
Physique (3) (5 points)
Partie (1) / (3Pts)
Le montage suivant est constitué de :
Un générateur de force électromotrice U o ;
Un condensateur de capacité C ;
Une bobine d’inductance Lo 1H et de résistance
r 0 .
Deux interrupteurs ( K 1 ) et ( K 2 ) .
1) ( K 2 ) ouvert, on ferme l’interrupteur ( K 1 ) .
Exprimer la charge maximale q m du condensateur en fonction de la capacité C
du condensateur et deU o la f.é.m du générateur.
:22 / 23
8
2) Le condensateur étant totalement chargé , on ouvre l’interrupteur ( K 1 ) et on
A
L'air contient du Radon Z Rn en quantité plus ou moins importante.
238
92
6
ferme ( K 2 ) à un instant pris comme origine des dates (t 0 ) .
2-1) Etablir l’équation différentielle des oscillations électriques vérifiée par q (t) :
charge de l’armature A du condensateur.
2-2) La solution de l’équation différentielle est : q t qm sin(
l’expression de la période propre est : To 2
2-3) On donne la
représentation graphique de
charge électrique q( t ) :
2
t ) ,montrer que
To
L.C .
Calculer les valeurs de :
, C et U o .
2-3) Déterminer l’expression
de l’intensité du courant
électrique i t circulant dans
le circuit en précisant sa
valeur maximale I m .
3)Montrer que l’expression de
l’énergie magnétique emmagasinée dans la bobine est : E m
1 2
qm q 2
2C
4) Déduire que ce dipôle est un oscillateur harmonique (l’énergie totale ET se
conserve) et Calculer la valeur de ET .
Partie (2) / (2Pts) Etude de la modulation d’amplitude
On réalise la modulation d’amplitude en utilisant un circuit intégré multiplieur X.
On applique à l’entrée E1 du circuit intégré X une tension P( t ) Pm .cos( 2 F .t ) , et
à l’entrée E2 la tension S( t ) U o avec S( t ) S m .cos( 2 f .t ) (figure(1)).
On obtient à la sortie S du circuit intégré la tension u( t ) K . S( t ) U o .P( t ) .
La courbe de la figure(2) correspondant au signal modulé en amplitude est
obtenue avec un oscilloscope de sensibilité horizontale: 2,5ms / div ; et de
sensibilité verticale: 3V / div
1)Donner les noms des tensions S( t ) , p( t ) et U o .
7
:22 / 23
8
2) On donne u( t ) U m ( t ).cos( 2 F .t ) avec : U m ( t ) A m cos( 2 f .t ) 1
l’amplitude du signal modulé.
2-1) Trouver les expressions de U m(max) et U m (min) en fonction de A et m .
2-2) Déduire que le taux de modulation : m
U m (max) U m(min)
U m (max) U m(min)
.
2-3) Calculer la valeur de m.
2-4) Calculer F la fréquence de l’onde porteuse et f celle du signal modulant .
8
:22 / 23
8
On donne : C = 90N.m/rad et 2 10 .
1) En appliquant la relation fondamentale de la dynamique, établir l’équation
différentielle du mouvement de la tige et déduire la nature du mouvement.
2) On donne la solution de l’équation différentielle (équation horaire) :
2
t , en déduire l’expression de To la période propre des
To
( t ) m .cos
oscillations de la tige .
3) Ecrire l’expression numérique de l’équation horaire (t ) .
4) Calculer max la vitesse angulaire maximale.
5) Calculer le travail du couple de torsion
WC
effectuer entre 1
1 2
et 2 .
6
4
1
C m2 2
2
7) En déduire que l’énergie mécanique du système se conserve.
8) Trouver l’abscisse angulaire lorsque EC E P .
6) Montrer que l’expression l’énergie cinétique est : EC
Figure(1)
Figure(2)
9) Sachant que le pendule pendant son oscillation dans deux liquides différentes
viscosités . A l’aide d’un système informatique on obtient les deux courbes
suivantes :
Physique (4)/(4Pts)
On considère une tige mince AB de masse m et de
longueur L, suspendue par un fil et libre de tourner
dans le plan horizontal autour de l’axe du fil.
On note l’angle de rotation de la tige par rapport à
sa position d’équilibre.
Le fil applique sur la tige un couple résistant (dit
couple de torsion) de moment de torsion : M C C
. Le moment d’inertie de la tige par rapport à l’axe du
fil est J 9.10 2 Kg.m 2 .
On écarte la tige horizontalement, dans le sens positif,
d’un angle m
(
)
rad
4
par rapport à sa position d’équilibre et on la libère sans vitesse initiale à un
instant t=0.
Donner le nom de chaque régime.
(
)
الصفحة
1
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
8
2
.
الفيزياء والكيمياء
0202 يونيو:دورة
:7 المعامل
ساعات4 :مدة اإلنجاز
المادة
8:عدد الصفحات
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
.
Chimie (7 points)
L’exercice comporte deux parties indépendantes.
Partie 1 : Étude de quelques solutions aqueuses
L’ammoniac est un gaz soluble dans l’eau et donne une solution basique. Les solutions commerciales d’ammoniac
sont concentrées et sont souvent utilisées dans les produits sanitaires après dilution.
L’objectif de cet exercice est l’étude de quelques propriétés des solutions aqueuses de l’ammoniac et la
détermination de sa concentration dans un produit commercial.
Donnée :
Toutes les mesures sont effectuées à t=25 °C.
La masse volumique de l’eau e 1 g.mL1 .
Les calculatrices non programmables sont autorisées
On donnera les expressions littérales avant de passer aux applications numériques
Le sujet comporte cinq exercices
• Un exercice de chimie (7 points)
• Quatre exercices de physique (13 points)
Exercice de chimie (7 points)
Partie 1 : Étude de quelques solutions aqueuses.
(3,25 points)
Partie 2: Étude de la pile Cuivre-Aluminium .
(3,75 points)
Exercices de physique (13 points).
Exercice 1 : L’onde sinusoïdale dans une corde.
(1 point)
Exercice 2 : Quelques isotopes du Plutonium.
(1,5 point)
Exercice 3 : Étude des dipôles RLC dans les régimes libre et forcé.
(5,5 points)
Partie I : oscillations électriques libres dans le dipôle RLC série.
(3 points)
Partie II : le dipôle RLC le régime forcé.
(2,5 points)
Exercice 4 :
8
الصفحة
(5 points)
Partie I : Étude du mouvement d’un corps sur une piste verticale.
(2,5 points)
Partie II : Le satellite SOHO au point de Lagrange L1.
(2,5 points)
La masse molaire du chlorure d’hydrogène : M(HCl)=36,5 g.mol-1.
Le produit ionique de l’eau : Ke=10-14.
1- Préparation de la solution d’acide chlorhydrique
On prépare une solution (S) d’acide chlorhydrique de concentration C=10-2 molL-1 en diluant une solution
commerciale (S0) de concentration C0 en cet acide.
La densité de la solution commerciale par rapport à l’eau est d=1,365.
Le pourcentage massique de l’acide dans cette solution commerciale est p=26,74 %.
p.d .e
1-1 Montrer que la concentration C0 s’écrit sous la forme C0
.Calculer sa valeur. (0,75 pt)
M( HCl )
1-2 Calculer le volume qu’il faut prélever de la solution commerciale pour préparer 1L de la solution (S).(0,25 pt)
2- Détermination de la valeur du pKa du couple NH4 / NH3
Å l’aide des mesures du pH, des solutions aqueuses d’ammoniac, de concentrations différentes, on détermine la
concentration molaire des ions hydroxyde HO dans chaque solution. La courbe de la figure (1) représente les
NH3 .
variations de HO fonction de
NH4
HO ( mmolL1 )
NH3
Figure (1)
2-1 Écrire l’équation de la réaction entre l’ammoniac et l’eau. (0,25pt)
2-2 Dresser le tableau d’avancement de la réaction. (0,5pt)
2-3 Exprimer la concentration HO en fonction de pKe, du rapport
NH4
NH3 et pKa du couple NH / NH (0,75pt)
4
3
NH4
2-4 Déterminer la valeur de pKa du couple NH4 / NH3 . (0,75pt)
Partie 2: Étude de la pile Cuivre-Aluminium
On réalise la pile Cuivre –Aluminium en plongeant une plaque d’aluminium Al (s) de masse m0 = 5.4 g dans un
الصفحة
3
8
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
الصفحة
4
8
.
bécher contenant V1 = 50 mL de solution de nitrate d’aluminium ( Al 3( aq ) 3NO3( aq ) ) ) de concentration initiale
C1 = 0,10 molL-1. et une plaque de cuivre Cu (s) dans un bécher contenant V2 = 40 mL de solution de nitrate de
cuivre (II) ( Cu 2( aq ) 2NO 3( aq ) ) de concentration C2 = 0,15 mol/L.
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
.
Préciser laquelle, justifier votre réponse.(0,25 pt)
2Déterminer les valeurs numériques de la célérité et de la longueur d’onde. (0,5 pt)
3L’une des courbes suivantes, représente l’allure de la corde à t=30 ms.
Données :
3Cu s 2 Al 3( aq ) est K = 10200
La constante d’équilibre de la réaction : 2 Al s 3Cu2( aq )
La constante de Faraday : 1 F 96500 C.mol 1 .
Les masses molaires : M(Al) = 27 gmol-1 et M(Cu) = 63,5 gmol-1
On ferme l’interrupteur K à l’instant t = 0, un courant continu d’intensité I = 15 mA circule dans le circuit
électrique.
1- Déterminer le quotient de la réaction Qr,i à l’état initial. (0,25)
2- Quel est le sens d’évolution spontanée du système chimique (0,25)
3- Préciser, en justifiant votre réponse le rôle joué par chaque l’électrode.(0,5)
4- Donner la représentation conventionnelle de la pile.(0,25)
5- Sachant que la pile est totalement épuisée.
5-1- Calculer la quantité d’électricité maximale Qmax débitée par la pile..(0,75)
5-2- Déterminer la durée du fonctionnement de la pile Δtmax . (0,5)
5-3- Calculer la variation de masse Δm(Cu) de l’électrode de cuivre..(0,5)
5-4- Calculer la variation de concentrations des ions d’aluminium Al 3 . (0,75)
Exercice 1: Les ondes(1 pt)
Physique (13 points)
Ä l’instant t=0 l’extrémité S, d’une corde tendue et horizontale, entame un mouvement sinusoïdal le long de l’axe
vertical (Oz).La courbe de la figure1 représente les variations de l’élongation yS en fonction du temps.
yS ( t )
Courbe 1
Courbe 2
m
m
Préciser laquelle, justifier votre réponse.(0,25 pt)
Exercice 2: Physique nucléaire (1,5 pt)
Le plutonium, dont différents isotopes " 238 Pu , 239 Pu et 240 Pu " ont été découverts sur le site de la centrale
japonaise de "Fukushima", est un métal d’origine artificielle utilisé dans le nucléaire civil et militaire.
Quinze isotopes différents produits artificiellement pour la première fois en 1940, le plutonium peut se présenter
sous la forme de quinze isotopes différents, tous radioactifs. Depuis le début des essais atmosphériques jusqu’à leur
interdiction, plus de quatre tonnes de plutonium, principalement sous formes d’oxydes, ont ainsi été dispersées dans
l’atmosphère de l’hémisphère nord et se sont déposés sur le sol et dans les océans, selon le commissariat français à
l’énergie atomique. Leur persistance dans l’environnement dépend de leur demi-vie.
1- Définir les isotopes d’un élément chimique.(0,25 pt)
2- L’uranium 234 234
92 U , est un isotope de l’uranium présent dans l’uranium naturel. Les rapports des
énergies de liaison et des énergies de liaison par nucléon d’un noyau de plutonium APu et celui d’uranium 234 sont
t
El ( APu )
l ( 234U )
et
r
1,0064 .
1
,0191
2
El ( 234U )
l ( APu )
Le numéro atomique de l’élément chimique plutonium étant Z=94, donner la composition du noyau de
plutonium APu .(0,25 pt)
3- Le noyau du plutonium 239 est fissible une des ’équations de sa fission sous l’impact d’un neutron est :
239
1
1
13552Te 102
94 Pu 0 n
42 Mo 3 0 n
On donne les énergies de liaison des noyaux suivants :
239
135
102
Noyau
94 Pu
52Te
42 Mo
3
3
Énergie de liaison (MeV)
1,79.10
1,12.10
8,64.102
respectivement r1
1L’une des courbes suivantes, représente les variations de l’élongation yM d’un point M de la corde situé à la
distance d=20 cm de S.
yM ( t )
Courbe A
t( s )
yM ( t )
Courbe B
t( s )
3-1 À partir des énergies de liaison de ces trois noyaux, donner l’expression de l’énergie libérée lors de la réaction de
fission. Calculer cette énergie.( 0,25)
3.2 Calculer l’énergie de liaison par nucléon de chacun des noyaux. Comparer la stabilité de ces trois noyaux.(0,25 pt)
4- Dans les notes d’un technicien japonais, de la centrale nucléaire "Fukushima", ayant étudié un échantillon
radioactif de plutonium 238, on trouve les informations suivantes.
5
الصفحة
8
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
6
.
الصفحة
8
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
.
uL
L’activité à t 2 t 1 est a t 2 t 1 1 ,587.10 11 Bq
2
2
Le nombre des noyaux restants à t 3t 1 est N t 3 t 1 3,167.10 20 .
2
2
Déterminer à partir des deux valeurs données la valeur de t 1 en "ans". (0,5 pt)
2
On donne : " 1 an = 365 jrs ".
t
Exercice 3 : Électricité
L’exercice comporte deux parties indépendantes.
Partie 1 : Oscillations électriques libres.
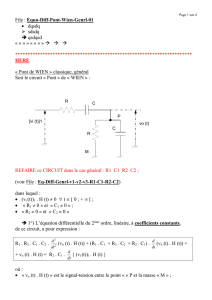
On considère le circuit électrique représenté sur la figure ci-dessous. Ce circuit comporte :
- Un générateur G de tension continue idéal de force électromotrice E=10 V.
- Deux conducteurs ohmiques de résistances respectives R0 100 et R réglable.0
- Une bobine d'inductance L=1 H et de résistance nulle.
- Un condensateur de capacité C 1 F initialement déchargé.
- Un interrupteurs K.
K fermé
R0
E
i
i
R
uL
uR
uC
C
Dans tout l’exercice, on adopte les sens conventionnels de l’intensité du courant et les tensions représentés sur la
figure.
1- On ferme l’interrupteur K pendant une durée suffisamment grande pour que le régime permanent soit
établi. Justifier les affirmations suivantes : (0,75 pt)
a- L’intensité du courant dans, la branche contenant le condensateur, est nulle.
b- Les tensions électriques uL , u R et uC sont nulles.
E
c- L'expression de L'intensité du courant traversant la bobine est I0
.
R0
2- À un instant pris comme origine des dates, on ouvre K.
2-1 Établir, pour une valeur quelconque de R, l'équation différentielle vérifiée par uL la tension aux bornes de
la bobine. (0,5 pt)
2-2 On règle R, sur la valeur R=0. Dans ce cas la solution de l'équation différentielle précédente s’écrit :
2
uL ( t ) Um cos(
t ) .
T0
a- Déterminer la valeur de et l’expression de Um en fonction de L, C, R0 et E. (0,75 pt)
b- Calculer la valeur de Um, commenter le résultat (0,5 pt)
2-3 On règle R sur la valeur R 50 .La courbe ci-dessous représente les variations de uL en fonction du
temps.
Instant t1
Déterminer la valeur de l’énergie dissipée par effet Joule, entre l’instant t=0 et l’instant t1 indiqué sur
la figure. (0,5 pt)
Partie 2 : Oscillations électriques forcées.
On réalise un circuit RLC série comprenant :
- Un générateur délivrant une tension alternative sinusoïdale u(t) de valeur efficace constante U = 10 V et de
fréquence N réglable.
- Un conducteur ohmique de résistance R 40 .
- Une bobine (b) (différente de celle de la première partie) d’inductance L=0,1 H et de résistance r.
- Un condensateur de capacité C (différente de celle de la première partie).
i( t ) I . 2 cos( 2 Nt )
u( t ) U . 2 cos( 2 Nt )
L ,r
C
R
uR
uL
uC
Le générateur applique une tension alternative sinusoïdale u( t ) U . 2 cos( 2 Nt ) , un courant électrique,
alternatif sinusoïdal d’intensité i( t ) I . 2 cos( 2 Nt ) circule dans le circuit.
1- On se place dans le régime sinusoïdal établi (les constantes d’intégration sont nulles). (0,75 pt)
1-1 Exprimer uR(t) en fonction de R, I, N, et t.
1-2 Exprimer uL(t) en fonction de L, r, I, N, et t.
1-3 Exprimer uL(t) en fonction de C, I, N, et t.
2- Montrer l’égalité suivante. (0,5 pt)
1
U . 2 cos( 2 Nt ) ( R r ).I . 2 cos( 2 Nt ) I . 2 sin( 2 Nt ). 2 NL
2 NC
3- La relation précédente est vraie à tout instant, montrer les résultats suivants. (0,75 pt)
الصفحة
7
8
ab-
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
8
8
.
U
R r cos( ) Z cos( )
I
1
2 LN
2
CN
tan( )
R r
Z
R r 2LN
2
االمتحان التجريبي الموحد الثاني
0202 دورة يونيو
علوم رياضية أ خيار فرنسية:المسلك
الموضوع
^
( OC ,OM) (voir figure).On rappelle l’expression du vecteur accélération dans le repère de Frenet.
2
..
. 2
d 2
d
a r 2 u r n r u r n
2
dt
4-1 En appliquant la deuxième loi de Newton.
dt
.
a- Exprimer R l’intensité de l’action de la piste sur S en fonction de m, g, r, et . (0,25 pt)
g
VB2
2 1 cos .(0,25 pt)
r2
r
4-2 En déduire l’expression de R en fonction de m, g, r et seulement. (0,25 pt)
4-3 Montrer que le corps S ne peut pas quitter la piste entre les points C et D.(0,25 pt)
4-4 En déduire la condition que doivent vérifier h et r pour que S ne quitte pas la piste au point F..(0,25 pt)
Partie 2 : Le point de Lagrange L1.
Les points de Lagrange (notés L1 à L5), ou, plus rarement, points de libration, sont des positions de l'espace où on
peut mettre un corps en mouvement circulaire autour de S (centre du Soleil) synchrone avec le mouvement du
centre de la terre O autour de S.
L’objectif de cette partie est la détermination de la position L1.
Nous considérons que la Terre et le Soleil ont une répartition de masses à symétrie sphérique, et que le centre de la
terre O est en mouvement circulaire de rayon D=OS, dans le référentiel héliocentrique.
Données
G=6,67.10-11 SI : la constante de gravitation universelle.
SOHO, noté H dans la figure, est un satellite de masse m destiné à l'observation solaire, a été lancé en 1995. Il se
trouve au point de Lagrange L1 situé encre la Terre et le Soleil. Ce satellite est animé,, dans le référentiel
héliocentrique, d’un mouvement circulaire de centre S et reste constamment sur la droite joignant le centre de la
Terre O au centre du soleil S. On note x la distance entre SOHO et le centre de la terre O (voir figure)
1- En considérant que la Terre n’est soumise qu’’à la force gravitationnelle appliquée par le Soleil,
a- Montrer que le mouvement circulaire de O est uniforme.(0,25 pt)
b- Exprimer la vitesse angulaire du centre de la terre autour du Soleil, en fonction de G, la masse du soleil Ms et
la distance D entre les centres S et O. (0,25 pt)
c- Calculer la masse du Soleil Ms (0.25 pt)
2-. On suppose que SOHO n’est soumis qu’aux forces gravitationnelles appliquées par le Soleil et la Terre.(0,5 pt)
a- Reproduire le schéma sur ta copie en indiquant clairement, les vecteurs forces appliquées sur SOHO.
b- Exprimer le vecteur accélération du satellite en fonction de G, MT, D et de la distance x encre le centre O
de la Terre et le satellite. Pour simplifier on posera Ms = K.MT· (MT la masse de la terre)
4. Appliquer la deuxième loi de Newton au satellite pour obtenir une relation encre D, x et K. (0,75 pt)
x
5. Le point L1 est beaucoup plus proche de la Terre que du Soleil 1
D
u
1
x
O
En tenant compte de l'approximation.
12 .
n
x 2
D
u
x
(1 )
D
H
Déterminer la valeur de x. (0,5 pt)
n
D
Données : a= 1,50. 1011 m ; K = 3,33. 105
S
T=365 jrs période de la terre ; . 1 jour=24 H.
.
b- Montrer que la vitesse angulaire s’écrit sous la forme :
Déterminer les valeurs numériques de C et R.(0,5 pt)
Exercice 4 : Mécanique.
L’exercice comporte deux parties indépendantes.
Partie 1 : Mouvement d’un corps S ponctuel sur une piste verticale.
Dans cette partie aucun calcul n’est exigé. On néglige tous les frottements.
L’objectif de cette partie est l’étude du mouvement d’un corps S, supposé ponctuel, de masse m, sur une piste
verticale (ABCDF) constituée de :
- AB partie rectiligne incliné par rapport au plan horizontal d’un angle .On note h l’altitude du point A par
rapport au plan horizontal contenant le point B. (Voir figure 1)
- Partie BC rectiligne horizontale.
- CDF partie circulaire de centre O et de rayon r. Le rayon OC est perpendiculaire au rayon OD.
y
A
h
F
j
S
i
D
O
B
x
n
u
C
1- On libère le corps S à un instant, pris comme origine des dates, sans vitesse initiale du point A pris comme
.
4- Au point C le corps S entame son mouvement sur la partie circulaire. On repère la position de S par l’angle
1
2 CN
4- La courbe ci-dessous représente les variations de l’impédance Z en fonction de la fréquence N
c-
الصفحة
origine du repère d’espace A , i , j .
1- En appliquant la deuxième loi de Newton.(0,5 pt)
a- Déterminer l’expression de R l’intensité de l’action de la piste AB sur le corps S en fonction de m, g et .
b- Déterminer l’équation horaire du mouvement du corps S.
2- En déduire l’expression de la vitesse VB du corps S au point B en fonction de g et h.(0,25 pt)
3- Après son arrivée au point B, le corps S poursuit son mouvement sur la partie BC.
3-1 Écrire l’énoncé de la première loi de Newton.(0,25 pt)
3-2 Montrer que le mouvement de S est uniforme entre les points B et C.(0,25)
L’aluminium est extrait d’oxyde d’aluminium solide 4
Le pourcentage massique d’oxyde d’aluminium dans le Bauxite est : 5=48%
Examen normalisé 2 du baccalauréat
Mai 2021
On produit l’aluminium en deux étapes :
Matière
Physique-Chimie
Coefficient
7
Section
Sciences Mathématiques B
Durée
4 h
*Traitement du Bauxite et trier l’oxyde d’aluminium puis le transformer à l’état fondue à
950°C selon l’équation suivante :
(4
)6 −→ (24
*
+3
)aq
*Réaliser l’électrolyse de la solution fondue pour obtenir le métal d’aluminium.
Chimie
Dans une usine de production d’aluminium la cellule d’électrolyse contient l’oxyde
Partie 1 : Etude d’un mélange de solutions aqueuses
On prépare une solution de volume V=50 mL en ajoutant
méthanoique (HCOOH) et
qui se trouve dans le Bauxite.
= 5,00
d’aluminium fondu et une cathode de graphite et une anode de carbone qui intervient
= 2,50
d’acide
d’éthanoate de sodium (
).
1-écrire l’équation de dissolution d’éthanoate de sodium dans l’eau. L’acide conjugué de
l’ion éthanoate est l’acide éthanoïque ; quel est la formule de cet acide.
dans l’électrolyse selon la demie équation suivante :
% +:'; −→ %'; + <=
> ?@ A 6 @ B?6 ? @C?D6 @ED? 6
Le circuit électrique fonctionne pendant une durée ∆@ = 12ℎ avec un courant électrique
qui se produit dans la solution.
continu I = 50,4
On donne : J(4 ) = 27L.
3-dresser le tableau d’avancement de la réaction.
1-définir l’électrolyse.
4-déduire la relation entre la concentration d’ion éthanoate et la concentration d’ion
2-écrire la demie équation d’oxydo-réduction de la réduction d’aluminium.
méthanoate.
3-déterminer sur un schéma simple le circuit d’électrolyse en précisant le signe et le nom
5-montrer que la conductivité
de chaque électrode et le sens du mouvement de porteurs de charge.
2-la base conjuguée de l’acide méthanoïque est l’ion éthanoate HCOO- déduire la réaction
de la solution s’écrit sous la forme
= ,
+ , .
: la concentration d’ion méthanoate. On néglige la concentration des ions oxonium et
; J( ) = 16L.
; O = 96500 .
4-déterminer les valeurs de > ?@ A.
5-écrire l’équation bilan de la réaction.
hydroxyde.
6-trouver la masse d’aluminium produite pendant la durée ∆@
6-sachant que la conductivité de la solution à l’équilibre est 0,973 S.m-1. Déduire
7-déterminer la masse m(B) du Bauxite nécessaire pour réaliser cet électrolyse.
7-trouver la valeur K de la constante d’équilibre associé à la réaction étudié.
On donne les conductivités molaires ioniques enS.m2.mol-1 à 25°C.
!( ) = ", #$.
; !(%& %'' ) = #, .
; !(()* ) = ",
Physique :
.
8-donner l’expression de K en fonction de +,- et +,- .calculer sa valeur et la comparer
au resultat obtenu précédemment .
On donne : +,- = +,-( ./0 .11/⁄./0 .112 ) = 4,8
Exercice1 : détermination du pourcentage du Potassium radioactif dans le chocolat
Le corps humain a besoin des sels minéraux parmi eux on trouve le potassium Q, , mais
cet élement est la source radioactive dans le corps humain , il contient l’isotope radioactif
RS
Q, avec un pourcentage presque 1,1.10 %
La constante radioactive des noyaux RSQ, est U = 1,7. 10
désintégration le Calcium RSS
+,- = +,-( /.11/ ⁄/.112 ) = 3,8
9-déterminer pH du mélange.
Partie2 : Production d’aluminium :
L’aluminium est considéré le métal le plus utilisé vue de ses propriétés comme la masse
volumique basse est sa résistance à la rouille.
Page 1 sur 6
La masse molaire du Potassium : J = 39,1 L.
V
6
et se produit lors de sa
.
1-écrire l’équation de désintégration du RSQ, ,quelle est sa nature ?
Page 2 sur 6
2-un morceau de chocolat de masse mC=100g contient une masse m=400mg de
fonction de C(@).
Potassium.
1-2-montrer que l’expression de la résistance s’écrit sous
2-1-calculer le nombre N0 de noyaux RSQ,
la forme suivante : m = −
2-2-déduire l’activité de cet échantillon .
c;
(n.
oc;
o^
+ pc )
2-3-montrer que l’activité de cet échantillon est supposée constante pendant une heure.
2-4-calculer le nombre de particules W liberée par le morceau du chocolat pendant une
2-détermination de la valeur r.
heure.
**G est un générateur de tension continue
3-une étude médicale avertit qu’un individu ne peut pas supporter pendant une heure
plus que 10 X particule W .
On règle R sur la valeur R=100Ω et on visualise les
tensions E (@) et E (@) sur l’oscilloscope (figure3)
Vérifier que la consommation du morceau du chocolat ne pose aucun risque radioactif
-la sensibilité verticale pour l’entrée A :0,5V/div
sur le corps de l’individu.
-la sensibilité verticale pour l’entrée B :2V/div
Exercice2 :
-la sensibilité horizontale : 1ms/div
Les parties 1 et 2 sont indépendantes.
2-1-trouver la nouvelle expression de la résistance r.
Partie 1 :
2-2-calculer la valeur de r.
On considère le circuit électrique représenté sur la figure1 telle que :
3-détermination la valeur de l’inductance L :
E=12 V ; C=0,4 YO
**G est un générateur GBF :
On règle R sur la valeur R=r et on obtient la figure 4 qui
On ferme l’interrupteur K à l’instant t=0
1-déterminer l’équation différentielle vérifié par la tension E. .
2-sachant que E. = 4(1 − ?
Z
[
) est une solution de l’équation différentielle déterminer
les expressions de 4 ?@ \ e fonction des paramètres du circuit.
3-montrer que l’expression de la constante du temps \ s’ecrit sous la forme suivante :
]=
^
b
_ `ab2 c d
%
.calculer la valeur de \ sachant que E. = 7,56e à @ = 2 6
représente les variations de E en fonction du temps.
La sensibilité verticale pour les deux entrées :2V/div et la
sensibilité horizontale :1ms/div.
3-1-trouver la fréquence du générateur GBF
3-2-On presse le bouton ADD de l’oscilloscope on
visualise sur l’écran de l’oscilloscope la tension
Eq = E + E
La figure5 représente les variations de Eq en fonction du
Déduire la valeur de la résistance R.
4-montrer que : gh (\) = 0,4. gh (max) telle que gh (\)
temps.
est l’énergie électrique stockée dans le condensateur à
@ = \ et gh (max) l’énergie électrique maximale que le
3-2-1-exprimer Eq en fonction de L ,r et E
3-2-2-déterminer la valeur de L.
condensateur peut la stocker.
Partie 2 :
On veut déterminer la résistance r et l’inductance L
Exercice3:
d’une bobine.
Les grandes expériences réalisées par les physiciens à la fin du
1-étude théorique :
dix-neuvième siècle est la connaissance des valeurs des masses
**G est un générateur de tension variable (figure2)
des particules comme les atomes ,les noyaux et les nucléons
1-1-donner les expressions des tensions E (@) et E (@) en
Expérience de Millikan
ainsi leurs charges.
Page 3 sur 6
Page 4 sur 6
L’expérience de Millikan est considéré comme une expérience qui aboutit à la valeur de la
charge élémentaire ? = 1,6. 10
Q
Dans une deuxième expérience on réalise deux opérations :
-On charge les gouttes de glycérine sous l’action des rayons électromagnétiques , chaque
Au cours de cette expérience Millikan a étudie le mouvement de la chute verticale d’une
goutte acquiert une charge positive q.
goutte de glycérine entre deux plaques métalliques horizontales chargées sous une tension
-On applique entre les plaques une tension électrique continue U=3700 V
continue.
La distance entre les plaques est suffisamment grande d=10cm.
1-Détermination du rayon de la goutte de glycérine :
Ensuite on fait entrer les gouttes chargées entre les plaques sans vitesse on observe que les
On pénètre entre deux plaques non chargées des gouttes de glycérine avec une vitesse
gouttes ont un mouvement verticale vers le haut. Au début la vitesse augmente et stabilise à
initiale nulle. On suppose que les gouttes de glycérine sont identiques et on représente
R
chacune par une boule homogène de rayon r et de volume = rD .
On modélise la force de frottement due à l’action de l’air par une force st telle que
st = −6ruDvt avec
vt la vitesse de la goutte
une vitesse limite v~• et parcourt une distance l=8cm pendant une durée @ = 30,2 6
durant le régime permanent.
2-1-en appliquant
2h€h loi de Newton montrer que l’équation différentielle du
mouvement de la goutte après sa charge entre les plaques est sous forme :
Préciser les expressions de A et B.
η le coefficient de viscosité de glycérine u = 1,83. 10
X
oz
o^
= • − ‚z
On choisit un axe vertical oz orienté vers le haut dans le même sens du mouvement.
(SI)
2-2-exprimer la vitesse limite v~• en fonction de m , g, q , U , d ,η et r.
on donne : la masse volumique de glycérine : Y = 1260 yL.
la masse volumique de l’air : YS = 1,29 yL.
2-3-déterminer le nombre de charge élémentaire que porte la goutte au cours de cette
l’intensité de pesanteur g=9,81
expérience.
6
1-1-faire l’inventaire de forces appliquées à la goutte de glycérine et montrer qu’on peut
négliger la poussée d’Archimède exercée par l’air.
1-2-En appliquant la deuxième loi de Newton montrer que l’équation différentielle du
mouvement de la goutte s’écrit sous la forme suivante :
z+
;{m; oz
. =
| o^
;{m;
.}
|
On utilise un axe vertical orienté dans le sens du mouvement de la goutte vers le bas.
1-3-déduire en fonction de Y ; D ; L ; u l’expression de la vitesse limite v~ du mouvement.
1-4-Un système adéquat nous permet de suivre le mouvement de la goutte durant son
régime permanent entre les plaques . les résultats de l’expérience montrent que la goutte
parcourt une distance l=8 mm durant le régime permanent pendant une durée t1=24,8s
Déterminer la valeur r du rayon de la goutte.
2-Détermination de la charge de la goutte :
Dans une deuxième expérience on réalise deux opérations :
-on charge les gouttes de glycérine sous l’action des rayons électromagnétiques . chaque
goutte acquiert une charge positive q.
-on applique entre les plaques une tension électrique continue U=3700 V
La distance entre les plaques est suffisamment grande d=10 cm
Page 5 sur 6
Page 6 sur 6
Durée de l’épreuve : 3h
Examen Blanc-n°1
Coefficient : 7
La figure (2) donne les courbes pH =f(VB) et
2023/2022
Matière : Physique Chimie
Classe : 2ème bac SP
=g(VB) obtenues lors de ce dosage.
Prof : Anass El Badaoui
Chimie : (7pts)
L’ibuprofène est une molécule de formule brute C13H18O2 . Elle constitue le principe actif de
divers médicaments de la classe des anti-inflammatoires.
Cette partie vise :
- L'étude d'une solution aqueuse d'ibuprofène ;
figure (1)
- Le titrage d'une solution aqueuse d'ibuprofène ;
figure (2)
Données :
-
M(C13H18O2) = 206g mol-1 ; Ke=10-14 .
2-1/ Nommer les éléments du dispositif expérimental numérotés 1,2 ,3 et 4 sur la
- L’étiquette d’un médicament fournit l'information "Ibuprofène…. 400 mg " ;
figure (1).
1) Etude d’une solution aqueuse d’ibuprofène :
2-2/ Parmi les courbes (1) et (2) de la figure (2), quelle est celle qui représente
-2
-1
Le pH d’une solution aqueuse d’ibuprofène de concentration molaire C=5.10 mol L vaut
pH =2,7 à 25°C .
1-1/ Ecrire l'équation de la réaction modélisant la transformation entre l’ibuprofène et
l'eau .
=g(VB) ?
(0,25)
2-3/ Écrire l’équation de la réaction qui a eu lieu lors du dosage .
(0,5)
2-4/ Déterminer graphiquement la valeur du volume VBE , versé à l'équivalence.
(0,5)
1-2/ Montrer que cette transformation est limitée.
Déduire la valeur de la quantité de matière nA d'ibuprofène dans la solution (S). ( 0,75)
(0,75)
1-3/ Calculer la valeur du quotient de réaction Qr,éq ,du système chimique à l’équilibre.
En déduire la valeur du pKA du couple C13H18O2 / C13H17O2-. (0,75)
- On dissout un comprimé contenant l’ibuprofène selon un protocole bien défini afin
d'obtenir une solution aqueuse (S) d’ibuprofène de volume VS =100 mL.
- Pour vérifier, la masse d’ibuprofène contenu dans ce comprimé, on procède à un
titrage acido-basique du volume VS par une solution aqueuse d’hydroxyde de sodium
-
2-5/ Déduire la valeur de la masse m d’ibuprofène dans le comprimé et la comparer à
celle indiquée sur l'étiquette du médicament .
(0,75)
2-6/ Pour un volume VB=6mL (VB < VBE ) :
2) Titrage d’une solution aqueuse d’ibuprofène
+
(0,5)
2-6-1/ Trouver l’expression du taux d’avancement τ de la réaction du dosage.
calculer sa valeur . conclure .
2-6-2/ Calculer le rapport
(0,75)
[
]
[
]
, déduire l’espèce prédominante . (0,75)
2-6-3/ Trouver l’expression de pH en fonction de VBE ,VB et pKA .puis montrer
-1
(Na (aq)+ HO (aq)) de concentration molaire CB =0 ,194 mol.L , en utilisant le dispositif
dans le cas où VB =
que pH = pKA .
(0,75)
expérimental de la figure (1).
Page 1 sur 7
prof : El Badaoui Anass
Page 2 sur 7
prof : El Badaoui Anass
Physique 2 : Electricité
Physique 1 : ondes
( 5,5pts)
(2 ,5pts)
- On réalise l'expérience schématisée ci-dessous, où HP est l'émetteur ultrasonore ,et M1
et M2 des récepteurs ultrasonores se trouvent sur la même droite . (voir figure -1).
- Les ondes sonores reçues par M1 et M2 sont visualisés sur l'écran d'un oscilloscope.
- Lorsque les deux récepteurs sont sur la même abscisse x=0 les signaux visualisés sur
l'écran de l'oscilloscope sont en phase (figure -2) .
- On fixe la position de récepteur M1 à x =0 et on translate le récepteur M2 vers la droite,
on observe sur l'écran que les signaux sont en phase pour la deuxième fois quand
l'abscisse de récepteur M2 est d =2,8m .
On se propose, dans la partie I de cet exercice, de déterminer les grandeurs caractéristiques des
éléments d’un circuit électrique, en étudiant la charge d’un condensateur et sa décharge à travers une
bobine. Dans la partie II, on étudiera un signal modulé en amplitude.
PartieI : Réponse d’un dipôle RC à un échelon de tension ascendant et étude d’un dipôle RLC
1-Réponse d’un dipôle RC à un échelon de tension ascendant
On réalise le montage représenté sur la figure-1 comportant :
- un générateur idéal de tension de f.e.m. E ;
- un condensateur de capacité C variable initialement déchargé ;
- un conducteur ohmique de résistance R ;
- un conducteur ohmique de résistance R1 ;
- une bobine d’inductance L=0,1H et de résistance négligeable ;
- un interrupteur K.
1-1/ On ajuste la capacité du condensateur sur une valeur C et on place l’interrupteur,
à la date t=0, en position (1) .
1-1-1/ Etablir l’équation différentielle vérifiée par l’intensité du courant i(t) . (0, 5)
1-1-2/ La solution de cette équation différentielle s’écrit sous la forme :
HP
i(t) =A .
avec A une constante et τ la constante de temps du dipôle RC.
Trouver l’expression de A et celle de τ .
(0, 5)
1-2/ Les courbes (a) et (b) de la figure-2 représentent l’évolution de l’intensité i(t) du
courant lorsqu’on ajuste la capacité du condensateur sur une valeur C1 puis sur
une valeur C2 avec C1 < C2 .
Sh=1ms/div
fig 1
1) Définir la longueur d'onde mécanique λ .et Calculer sa valeur .
1-2-1/ Indiquer la courbe correspondant à chaque capacité . justifier .
(0, 5)
2) Calculer Vair , la vitesse de propagation de l'onde sonore dans l'air.
1-2-2/ Montrer que i=2,2mA pour t = τ .
(0, 5)
(0,75)
1-2-3/ La capacité du condensateur équivalent à un condensateur de capacité C1
monté en parallèle avec un condensateur de capacité C2 est Ce =10μF . Montrer
que C1= 4μF . (0, 5)
3) La vitesse de la propagation du son dans l'air s'écrit sous la forme : V=V0 .√
avec : V0 =331,5 m.s-1 la vitesse de la propagation du son dans l'air à 0°c .
1-2-4/ Déterminer la valeur de R et celle de E.
t° s’exprime en °c .
3-1/ Calculer la température T de l'expérience .
(0, 5)
(0, 5)
(0, 5)
3-2/ On fixe la valeur de la fréquence N, Comment varie la longueur d'onde quand on
augmente la température? Justifier .
Page 3 sur 7
(0,75)
prof : El Badaoui Anass
Page 4 sur 7
prof : El Badaoui Anass
2- Décharge du condensateur dans une bobine :
Après avoir chargé complètement le condensateur de capacité C1, on bascule à un instant t
(qu’on prendra comme nouvelle origine des dates t=0) l’interrupteur K en position (2). La
courbe de la figure-3 représente l’évolution, au cours du temps, de la tension uR1(t) aux
bornes du conducteur ohmique de résistance R1. (T) représente la tangente à la courbe
à l’instant t=0.
2-1- Etablir l’équation différentielle vérifiée par uR1 (t) . (0, 5)
2-2-Trouver la valeur de R1.
(0, 5)
Partie II : Etude d’un signal modulé en amplitude
Afin d’obtenir un signal modulé en amplitude, on utilise un circuit intégré multiplieur X de
constante caractéristique k =0,1V-1 (fig.4). On applique sur l’entrée E1 du multiplieur X une
tension sinusoïdale U1(t) = Pmcos(
et sur l’entrée E2 une tension U2(t)=U0+S(t) avec U0
la tension de décalage et S(t) = Smcos(
la tension modulante qu’on veut transmettre .
la tension de sortie Us(t) est : Us(t)=k.U1(t).U2(t)
On visualise la tension s(t) sur l’entrée X de l’oscilloscope
et la tension de sortie us(t) sur l’entrée Y, et on élimine
la base de temps (mode XY). On obtient ainsi
Figure 4
l’oscillogramme de la figure-5 représentant us(t)
en fonction de s(t) .
Les deux parties sont indépendantes l’une de l’autre
Partie I : Pourquoi Pluton n'est plus une planète ?
(3pts)
La planète Pluton, découverte en 1930 était considérée comme la neuvième planète du
système solaire. Le 05/01/ 2005, une équipe d'astronomes a découvert sur des photographies
prises en 2003 un nouveau corps gravite autour du Soleil sur une orbite elliptique qu'elle a
nommé «Éris» et non classé comme planète. La découverte d'Éris et d'autres astres
similaires a été le début de nombreuses discussions entre scientifiques sur la définition même
du mot «planète ». En 2006, au cours d'une assemblée, l'union astronomique internationale
a décidé de déclasser Pluton .
Données :
L'une des conditions de considérer un astre comme une planète est d'être plus massif.
Éris possède un satellite naturel nommé «Dysnomia » (D).
(D)
La Période de révolution de Pluton: Tp = 248 ans.
(E)
Période de révolution d'Éris: TE =557 ans.
22
⃗1
𝒖
Masse de Pluton : MP = 1,31.10 kg .
ME et MD sont les masses respectives d'Éris et de Dysnomia.
Rayon de l'orbite circulaire de Dysnomia : R D=3,60.107 m.
Période de révolution de Dysnomia: TD=15 jours = 1,3.106 s.
Constante de gravitation universelle : G = 6, 67.10- 11 m3.kg- 1.s- 2 .
On étudiera le mouvement supposé circulaire uniforme de Dysnomia (considéré comme
corps ponctuel) autour d'Éris dans le référentiel lié au centre d'Éris et dont les axes sont
dirigés vers des étoiles fixes.
1) En justifiant la réponse, choisir parmi les schémas ci-dessous, celui qui correspond à
un mouvement circulaire accéléré puis celui qui correspond à un mouvement circulaire
uniforme. Sur chaque schéma, les vecteurs vitesse et accélération sont représentés en
un point de la trajectoire de «Dysnomia ».
⃗
𝒂
(A )
1) Déterminer graphiquement le taux de
⃗
𝑽
⃗
𝒂
(B )
⃗𝑽
⃗𝑽
⃗
𝒂
(C )
2) Enoncer la troisième loi de Kepler, relative à la période de révolution T d'une planète
modulation m. (0, 5)
autour du Soleil, dans le cas d'une orbite elliptique de demi grand axe a .
2) Déduire la qualité de cette modulation . (0, 5)
(0, 5)
3) L'orbite d' Éris se situe -t-elle au-delà ou en-deçà de celle de Pluton? justifier par un
calcul.
(0, 5)
4) Exprimer en fonction des paramètres de l'énoncé et du vecteur unitaire ⃗ 1 , le vecteur
accélération ⃗ D de « Dysnomia » .
(0, 5)
3) Déterminer les valeurs des tensions U0 et Pm.
(0, 5)
Page 5 sur 7
Physique 3 : Mécanique (5pts)
prof : El Badaoui Anass
Page 6 sur 7
prof : El Badaoui Anass
5) Montrer que la période de révolution TD de « Dysnomia » a pour expression :
√
Durée de l’épreuve : 3h
Examen Blanc
Coefficient : 7
Date de l’épreuve :
06 / 06 / 2022
Matière: Physique Chimie
Classe : 2ème bac SP
(0, 5)
6) En déduire la valeur de la masse ME d'Éris.
(0, 5)
7) Calculer le rapport des masses d'Éris et de Pluton. Expliquer alors pourquoi la
découverte d'Éris a remis en cause le statut de planète pour Pluton. (0, 5)
Partie II : mouvement de rotation d’un solide autour d’un axe fixe . (2,5pts)
- On modélise un levier de charge par une poulie (P) homogène de rayon r=20cm
pouvant tourner autour d’un axe horizontal (Δ) fixe qui coïncide avec son axe de
symétrie, et un solide (S) de masse m =50kg lié à la poulie par une corde inextensible,
de masse négligeable et ne glisse pas sur la gorge de la poulie.
- Pour lever le solide (S) un moteur exerce sur la poulie un couple moteur de moment
M=105 N. m . On repère la position du centre d'inertie G de (S) à l'instant t par sa
coordonnée z dans le repère (Oz) lié à la terre supposé galiléen.
- A l'instant t0 = 0s le centre d'inertie G part de O sans vitesse initiale.
Données :
L’usage de la calculatrice scientifique non programmable est autorisé.
La formule littérale doit être donnée avant l’application numérique et le résultat
accompagné de son unité.
Les exercices peuvent être traités séparément selon le choix du candidat(e).
Z
- On néglige toute sorte de frottement.
Le sujet comporte quatre exercices : un exercice de chimie et trois exercices de physique
(P)
- JΔ : le moment d'inertie de (P) par rapport à l'axe (Δ).
- g=10 m.s-2 .
1) En appliquant la 2
Chimie : (7 points)
ème
(S)
loi de Newton et la relation
O
fondamentale de la dynamique en cas de rotation,
Dosage d’une solution d’acide benzoïque
Physique 1 : (3points)
montrer que l'expression de l'accélération de (G) est :
Partie I : Ondes lumineuses
Partie II : Nucléaire dans la médecine
(0, 5)
2) Une étude expérimentale a montré que l'équation horaire du mouvement de G est :
z = 0,2 t2 ; Déterminer la valeur de JΔ .
Physique 2 : Electricité (4,5 points)
Partie I : circuit LC
(0, 5)
Partie II : L’étude de la modulation et la démodulation d’une onde modulée.
3) Après n =8trs on arrête le moteur qui applique le couple moteur sur la poulie.
3-1/ Déterminer la nature du mouvement de (S) et de (P) .
(0,5)
Physique 3 : mécanique ( 5,5 points )
Partie I : Mouvement d’un skieur (S),
3-2/ Déterminer l'équation horaire du mouvement de (S) .(on choisira l'origine des
temps l'instant d'arrêt du moteur).
Page 7 sur 7
Réalisé par Professeur :
Anass El Badaoui
Partie II : Pendule simple
(0, 5)
prof : El Badaoui Anass
Page 1 sur 8
Prof : Anass El Badaoui
1-3/ Choisir l’indicateur coloré adéquat pour réaliser ce dosage. Justifier.
Chimie : (7pts)
L’acide benzoïque est un composé organique de formule brute C6H5COOH. Il est utilisé dans
la fabrication de plusieurs colorants organiques et aussi utilisé comme matière conservatrice
dans l’industrie des produits agroalimentaires.
L’objectif de cet exercice est le dosage d’une solution d’acide benzoïque et la détermination
de la valeur du pKA du couple C6H5COOH / C6H5COO- .
Données :
- Toutes les mesures sont effectuées à 25 °C.
;
sa valeur. Conclure.
(0,75 pts)
1-4-2/ Montrer par calcul que pour ce volume pH = pKA .
(0,75 pts)
1-5/ Ecrire l’équation de la réaction entre l’acide benzoïque C6H5COOH et l’eau. (0,5pt)
2) Détermination de la constante d’acidité pKA du couple C6H5COOH / C6H5COO- :
.
A l’aide des mesures du pH des solutions aqueuses d’acide benzoïque de concentrations
-
- On néglige la conductivité molaire ionique des ions H3O et OH .
d’une solution aqueuse ionique est :
différentes, on détermine le taux d’avancement final τ de chaque solution .La courbe de la
∑
[ ]
figure-2 représente la fonction
1) Dosage d’une solution d’acide benzoïque :
On dose une solution (S) d’acide benzoïque de volume V=15,2mL et de concentration C
avec une solution d’hydroxyde de sodium de concentration Cb = 0,2 mol.L-1 .
1-1/ Écrire l’équation de la réaction du dosage.
1-4-1/ Trouver l’expression du taux d’avancement de la réaction du titrage, calculer
(0,75pt)
+
- On rappelle que la conductivité
, le pH du mélange est égal à 4,2 .
1-6/ Dresser le tableau d’avancement de cette réaction et montrer qu’elle est limitée.
- Les conductivités molaires ioniques en mS.m2.mol-1 Sont :
;
1-4/ Pour un volume versé
(0,25 pts)
(0,5 pts)
1-2/ On obtient au cours de ce dosage l’évolution du pH de la solution en fonction du
en fonction de .
𝟏 𝝉
2-1/ Trouver l’expression de la constante
×10-3
d’acidité KA du couple C6H5COOH / C6H5COOen fonction de τ et C .
(0,75pt)
Fig-2
2-2/ En exploitant la courbe de la figure 2,
3,15
déterminer la valeur du pKA . (0,75pt)
volume Vb de la solution d’hydroxyde de sodium ajouté . (fig-1)
𝝉𝟐
1-2-1/ Déterminer la concentration de la solution de l’acide benzoïque. (0,5 pts)
1-2-2/ Déterminer le pHE du mélange à l’équivalence . (0,25 pts)
3) Réaction de l’acide benzoïque avec l’ion éthanoate :
On dispose de deux indicateurs colorés indiqués dans le tableau suivant :
Dans un flacon contenant de l’eau, on introduit n0=3.10-3 mol d’acide benzoïque et même
quantité de matière d'éthanoate de sodium CH3COONa . On obtient une solution aqueuse
Zone de
L’indicateur coloré
virage
hélianthine
3,2 – 4,4
Phénol -phtaléine
8,0 – 10
de volume V=100 mL.
On modélise la transformation chimique qui s’effectue par l’équation suivante :
C6H5COOH(aq) + CH3COO-(aq)
C6H5COO-(aq) + CH3COOH(aq)
La mesure de la conductivité du milieu réactionnel à l’équilibre donne la valeur :
Fig-1
3-1/ Montrer que l’expression de l’avancement final de la réaction s’écrit :
;
Calculer sa valeur.
(0,75pt)
3-2/ Trouver l’expression de la constante d’équilibre K associée à l’équation de la
réaction en fonction de xf et n0 . Calculer sa valeur. (0,5pt)
Page 2 sur 8
Prof : Anass El Badaoui
Page 3 sur 8
Prof : Anass El Badaoui
Physique 1 :
(3 pts)
Physique 2 : Electricité
( 4,5pts)
Partie I : Ondes lumineuses
Partie I : On monte en série un condensateur totalement chargé sous une tension U0 avec
- Pour déterminer la valeur de la longueur d'onde , d'une source (S) laser, on réalise
l'expérience de diffraction en utilisant plusieurs fils fins de diamètres a différents.
- On envoie un faisceau fin de la source sur chacun des fils et on obtient sur un écran (E)
situé à D=2,5m du plan vertical contenant le fil, une figure de diffraction constituée de
taches lumineuses claires et sombres. Pour chaque fil on mesure la largeur L de la
tache centrale sur l'écran. Les mesures effectuées ont permis le tracé de la courbe L en
fonction de .
On donne :
c =3.108 m.s -1 ; D >> L ; tan
pour petit
une bobine d’inductance L et de résistance interne négligeable. ( fig-1 )
2) Déterminer la relation entre D , L ,
tension uc(t) aux bornes du condensateur. (0,25pt)
2) Etablir l’équation différentielle vérifiée par la tension uc(t) aux bornes du condensateur
(0,25pt)
3) Déterminer l’expression de la fréquence N0 pour que uc(t) =U0.cos ( 2π.N0.t + φ) soit
la solution de l’équation différentielle précédente . (0,5pt)
4) La figure 2 représente les variations de la tension uc(t) en fonction du temps. à l’aide
1) Faire le schéma du montage permettant de mettre en évidence le phénomène étudié et
préciser la condition de son obtention ainsi que la nature de la lumière.
1) Reprendre le schéma de la figure et faire le branchement nécessaire pour visualiser la
de la courbe déterminer la valeur de la phase φ.
(0,25pt)
(0,25pt)
L (mm)
et a . (0,25pt)
3) Déterminer à partir de la figure les valeurs de
et de la fréquence
du laser. (0,5pt)
4) On place dans l'espace entre le plan contenant le fil
de diamètre a et l'écran, une plaque transparente en
𝟏
(mm -1)
𝒂
2
verre d'indice de réfraction n .
0
4-2/ Calculer n sachant que la largeur de la tache verticale a varié de 30% . (0,25pt)
(0,5pt)
5) La figure 3 représente les variation de
en fonction de uc . déterminer la valeur de
la tension U0 et la valeur de la fréquence N0 . (on pend π2=10 ) (0,5pt)
Partie II : Nucléaire
est radioactif
Fig-2
1
4-1/ Soit L’ la largeur de la tache centrale apparaissant sur l'écran.Montrer que L=nL’
Le Rhénium
Fig-1
6) Montrer que l’expression de l’énergie magnétique Em emmagasinée dans la bobine
. il est utilisé en radiothérapie dans le but de soulager la
maladie rhumatoïde. Le noyau résultant de la désintégration du noyau Re est l'Osmium
.
1) Ecrire l'équation de cette désintégration en déterminant les valeurs de A et Z . (0,25pt)
2) Dans un hôpital, un technicien a préparé un flacon de volume V0= 10mI d'une solution
s’écrit sous la forme : Em =
avec C la capacité du condensateur . (0,5pt)
7) La figure 4 représente les variations de Em en fonction de
. Déterminer la valeur de
C et déduire la valeur de L . (0,5pt)
de Rhénium 186 dont l'activité à l'instant de préparation est a0=3,7.109 Bq .
𝑬𝒎 𝟏𝟎 𝟑 𝐉
𝐝𝟐 𝐮𝐜
2
en V/s
𝐝𝐭 𝟐
2-1/ Calculer la masse du Rhénium 186 contenue dans le flacon . (0,5pt)
𝟏𝟎𝟖
2-2/ La solution préparée est utilisée pour examiner deux patients : pour le premier,
l'injection a eu lieu un jour après la date de préparation de la solution et pour le
Fig-3
Fig-4
𝐮𝒄 𝐞𝐧 𝐕
deuxième , 5 jours après cette date . Sachant que l'activité de la dose injectée doit être
égale à 7.107 Bq calculer le volume de la solution qu'il faut injecter à chaque patient.
(0,5pt)
On donne : - temps de demi-vie de Rhénium 186 : t 1/2=3,7 jrs ;
- M(Re)=186g/mol
Page 4 sur 8
;
NA= 6,02.10
23
mol
𝟏𝟎𝟖
-1
Prof : Anass El Badaoui
Page 5 sur 8
Prof : Anass El Badaoui
Partie II :
Le but de cette partie est l’étude de la modulation et la démodulation d’une onde modulée.
Etude de la modulation
Physique 3 : Mécanique (5,5pts)
Partie I : Un skieur (S), de masse m glisse sur une piste rectiligne OA inclinée d'un angle
On considère le circuit de la figure (1) .On applique sur l’entrée E1 du multiplieur X une
tension sinusoïdale U1(t) = Pm cos(
la tension de décalage et S(t) = Sm cos(
et sur l’entrée E2 une tension U2(t)=U0+S(t) avec U0
la tension modulante qu’on veut transmettre .
α=30° par rapport à l'horizontal, et part sans vitesse initiale du point A . (OA=L=40m )
Le skieur quitte la piste au point O à la vitesse VO et atterrit au point P situé sur une piste
BD = 60m inclinée d‘un angle α=30° par rapport l'horizontal.( voir figure )
A
On visualise sur l’écran d’un oscilloscope la tension de sortie Us(t) tel que :
Us(t)=K.U1(t).U2(t)
/
avec K constante qui caractérise le multiplieur X .
1) Montrer que Us(t) peut s’écrire comme : Us(t)=A [ 1 + m.cos(
Donner l’expression de A et m .
α
].cos(
OB=h=20m
O
B
x
𝑽𝑶
x’
(0,25pt)
2) L’expression de la tension modulée est : Us(t)=4[ 1,8 +1,4cos(
P
α
].cos(
2-2/ Déterminer m la valeur du taux de modulation. Déduire la qualité de cette
D
y
3) 2-1/ Quelles sont les fréquences de la porteuse Fp et du signal modulant fs ? (0,25pt)
On néglige tous types de frottements et la poussée d’Archimède, et on prend g=10m.s-2.
Mouvement sur la piste (AO) :
modulation . (0,25pt)
1) En appliquant la 2ème loi de Newton, déterminer la nature du mouvement du
Etude de la démodulation
La figure (2) représente le schéma du montage du récepteur d’onde électromagnétique
skieur sur la piste OA. Calculer l’accélération a1 du centre d’inertie G du skieur.
(0,25pt)
2) Ecrire les équations horaires du mouvement Vx’(t) et x’(t). Exprimer la vitesse
modulée en amplitude Us(t) et qui comporte trois parties.
VO en fonction de α , L et g . Calculer sa valeur.
4) Préciser le rôle de la partie 2 et la partie 3 dans ce montage. (0,25pt)
5) Pour sélectionner cette onde électromagnétique avec le circuit idéal (LC), quelle est la
valeur que doit avoir le coefficient d’auto inductance L . (0,25pt)
(0,5pt)
Mouvement dans le champ de pesanteur :
Le skieur fait un saut en O avec la vitesse VO . on considère maintenant l’instant de passage
On donne : la capacité du condensateur du circuit idéal (LC) est : C=2µF
de skieur par le point O comme nouvelle origine des dates .
3) En appliquant la 2ème loi de Newton établir les équations horaires du mouvement
Figure-2
x(t) et y(t) dans le repère (o, x, y). (0,5pt)
4) Déduire l’équation de la trajectoire de (S) .
(0,25pt)
5) Montrer que le skieur arrive au point P à l’instant
√
.Calculer sa valeur.
(0,5pt)
6) Calculer la vitesse Vp de skieur au point P . (0,25pt)
Figure-1
Partie 1
Partie 2
Partie 3
7) Exprimer la distance d = BP en fonction de α , h et L. Calculer la distance d .
(0,5pt)
8) Calculer la vitesse minimale V’o que doit avoir le skieur au point O pour qu’il
puisse atterrir exactement au point D . (0,5pt)
Page 6 sur 8
Prof : Anass El Badaoui
Page 7 sur 8
Prof : Anass El Badaoui
Partie II :
- On modélise le système mécanique (solide – fil ) par un pendule simple constitué d'un
fil inextensible de longueur L et de masse négligeable, et d'un solide (S) de masse m et
de dimensions négligeables devant la longueur L.
- On rappelle qu'un pendule simple est un cas particulier du pendule pesant.
- Le pendule se trouve au repos à sa position d'équilibre stable.
- A la date t = 0, On lance le pendule avec une vitesse initiale dans le sens positif de
telle façon qu'il acquiert une énergie cinétique Eco=13,33 J ; le pendule effectue alors
un mouvement oscillatoire sinusoïdal d'élongation maximale m=0,2rad .
- La position du pendule à un instant t est repérée par l'abscisse angulaire . (figure-1)
- Le plan horizontal passant par la position d'équilibre stable ( =0) est pris comme
origine de l'énergie potentielle de pesanteur Epp=0 .
- L'étude se limite au cas de faibles oscillations et se fait dans un référentiel galiléen .
- On néglige tout frottement.
Données:
- Longueur du pendule simple : L=2m ;
- L'intensité de pesanteur: g=9,8m.s-2 ;
- Dans le cas de faibles oscillations :
- On rappelle la relation trigonométrique : cos2
avec en radian ;
+ sin = l
2
1) Par analyse dimensionnelle, montrer que l'expression
√ est homogène.(0,25pt)
2) L'équation horaire du mouvement de ce pendule est :
Déterminer, dans le système international des unités, les valeurs de To et de
. (0,5pt)
3) Montrer que l'expression de l'énergie potentielle de pesanteur du pendule est de la
forme:
(0,5pt)
4) Montrer que l'expression de l'énergie mécanique du pendule est de la forme:
(0,5pt)
5) En exploitant la conservation de l'énergie mécanique, calculer la masse m du solide (S)
(0,5pt)
L
Page 8 sur 8
Prof : Anass El Badaoui
Examen blanc N°3
Physique-Chimie
2bac SMF
Les ondes1:(Pr. Mohamed BAROUDI)
Les ondes2:(Pr. Mohamed BAROUDI)
Chimie:(Pr. Mohamed BAROUDI)
Partie 1:
Partie 2:
Electricité1:(Pr. Mohamed BAROUDI)
Electricité2:(Pr. Mohamed BAROUDI)
La physique nucléaire:(Pr. Mohamed BAROUDI)
Mécanique:(Pr. Mohamed BAROUDI)
Examen blanc N°08
2SP – BIOF
Pr . RAZKAOUI Ahmed
On donnera les expressions littérales avant de passer aux applications numériques.
Le sujet comporte 4 exercices
Chimie (7 points)
- Pile de lithium.
- La vitamine C .
Physique ( 13 points )
Exercice I:
- Partie 1 : La fission d’uranium 235.
- Partie 2 : Les ondes lumineuses.
Exercice II:
- Détermination expérimentale de l'inductance L de la bobine
- La modulation et la démodulation d’amplitude
Exercice III :
- Mouvement d’une bille métallique dans l’air et dans un liquide .
Examen blanc N°08
2SP – BIOF
Pr . RAZKAOUI Ahmed
Chimie :
Partie 1 : Pile au lithium
Examen blanc N°08
2SP – BIOF
Pr . RAZKAOUI Ahmed
6.2. Vérifier que le nouveau taux d’avancement final vaut τ = 23,4% .Commenter en comparant ce
résultat à celui de la question 4.
Physique :
Les piles au lithium ont le principal avantage d'avoir une grande durée d'utilisation,
elles sont utilisées dans un certain nombre d'appareils électroniques et répandues dans
l’industrie. Une pile au lithium est constituée d’un cylindre de 3,4 cm de diamètre et
de 6,2 cm de hauteur, sa capacité volumique = 1,28.106 C/dm3 représente la quantité
de charge électrique contenue dans un volume d’un dm3.
Données :
Les couples en présence sont SOCl2 /S et Li+ / Li.
Au cours du fonctionnement de la pile, Li s'oxyde et SOCl2 se réduit et il se forme S , SO2, Li+
et Cl- .
- 1 F = 96500 C.mol-1
- Masses molaires en g.mol-1: M(O) = 16,0 ; M(S) = 32,1 ; M(Cl) = 35,5 ; M(Li) = 6,9 .
1- Ecrire les demis équations d’oxydo-réduction à coté de chaque électrode.
2- Calculer le volume de la pile en dm3 ?
3- Quelle est la quantité d'électricité que peut produire cette pile? On néglige l’épaisseur de ses parois.
4- Quelles sont les masses minimales des réactifs nécessaires pour produire cette quantité d'électricité ?
-
Partie 2 : La vitamine C
La vitamine C est une espèce chimique hydrosoluble sensible à la chaleur et à la lumière jouant un rôle
majeur dans le métabolisme de l'être humain et de nombreux autres mammifères. Chimiquement
parlant, il s'agit de l'acide ascorbique de formule chimique C6H8O6 , qui sera étudié dans cette partie .
Données :
Toutes les mesures ont été effectuées à 25°C à laquelle le produit ionique de l’eau vaut Ke = 10-14.
La constante d’acidité du couple auquel appartient l’acide : pKA = 4,15 .
La masse molaire de l’acide : M = 176g . mol-1.
On dissout un sachet d’un médicament contenant cet acide dans un volume V = 62,5 mL d’eau distillée
pour obtenir une solution (S) d’acide ascorbique de concentration C . Le pH de la solution à l’équilibre
vaut 3,05.
1. Que se passera-t-il si on change la température de la solution aqueuse préparée précédemment ?
2. Montrer que la masse , en g , de l’acide contenu dans le sachet du médicament a pour expression :
m = 1,1.101-pH ( 10pKA-pH + 1). Calculer sa valeur.
3. En déduire la valeur de C.
4. Vérifier que le taux d’avancement final relatif à cette réaction vaut = 7,4 % .Commenter.
5. Déterminer l’espèce qui prédomine dans cette solution, à l’équilibre, en calculant un rapport.
6. On prélève de la solution préparée un volume V0 auquel on ajoute un volume de l’eau distillée Ve
pour préparer une solution (S’) de concentration C’ =1mmol.L-1 et de volume V’= 60,5mL .On note
pH’ la nouvelle valeur de cette solution.
6.1. Vérifier que V0 = 5mL . Déduire le volume Ve.
Exercice 1 :
Partie 1 : La fission de l’uranium 235
L’uranium 235 est un isotope fissile, car il se désintègre également sous l’effet d’un neutron
thermique incident émis, par exemple, lors d’une fission spontanée, émettant à son tour, avec les
produits de fission, plusieurs autres neutrons susceptibles chacun de provoquer la fission d’autres
noyaux d’uranium 235 : c’est ce qu’on appelle une réaction en chaîne.
Parmi les réactions de fission de l’uranium, on trouve :
1. Définir : la fission, l’énergie de liaison.
2. Déterminer la valeur de a et b.
3. En s’appuyant sur le digramme ci-contre :
3.1 Calculer l’énergie de liaison par nucléon du noyau
uranium 235..
3.1 Calculer en (J) l’énergie libérée par m= 1mg d’uranium.
4. La combustion d’une tonne de charbon libère 2,5.1010 J.
Quelle masse de charbon libère, en théorie, autant d’énergie
que 1mg d’uranium ?
Données : 1MeV =1,6 .10-13J
Partie 2 : Les ondes lumineuses
Choisir la (ou les) proposition (s) justes parmi :
1-Quand la lumière passe d’un milieu à un autre d’indice optique n différent :
La fréquence de la lumière est modifiée
La longueur d’onde de la lumière est modifiée
La couleur de la lumière est modifiée
La célérité de la lumière est modifiée
2- Lorsque l’on réalise la décomposition de la lumière blanche à l’aide d’un prisme afin d’observer le
spectre de la lumière blanche :
Cette expérience met en jeu le phénomène de réfraction
Cette expérience met en jeu le phénomène de diffraction
Cette expérience met en jeu le phénomène de dispersion
Le violet est plus dévié que le rouge
Le rouge est plus dévié que le violet
Examen blanc N°08
2SP – BIOF
Pr . RAZKAOUI Ahmed
Examen blanc N°08
2SP – BIOF
Pr . RAZKAOUI Ahmed
Exercice 3 :
Partie 1 : Détermination expérimentale de l'inductance L d’une bobine
Pour déterminer expérimentalement l’inductance d’une bobine , on réalise le montage suivant constitué
d’une bobine (B) idéale, du conducteur ohmique de résistance R et d’un GBF délivrant une tension
rectangulaire (figure 1)
On visualise sur un oscilloscope les deux tensions UAM(t) dans la voie Y1 et UBM(t) dans la voie Y2 on
obtient les deux oscillogrammes de la figure 2.
1- Donner le nom de la composante X.
2- Nommer les tensions : S(t), P(t) et us(t).
3- Soit Um(t) l’amplitude de la tension us(t) :
a- Exprimer Umax l’amplitude maximale de Um(t) en fonction de Sm, Pm, U0 et K.
b- Exprimer Umin l’amplitude minimale de Um(t) en fonction de Sm, Pm, U0 et K.
4- Sur l’écran de l’oscilloscope, on visualise :
Sur la voie X : la tension .S(t)+U0.
Sur la voie Y : la tension Us(t).
En utilisant le mode (XY) , on obtient la courbe suivante :
Les données :
* la résistance du conducteur ohmique : R=5.103Ω
* La sensibilité verticale : - La voie Y1 : Sv=0,2V/div
- La voie Y2 : Sv=5V/div
* La sensibilité horizontale : SH= 1ms/div
1- Recopier le schéma de la figure 1 et montrer comment on branche l’oscilloscope pour
visualiser les deux tensions UAM(t) et UBM(t) .
2- Montrer que l’expression de la tension UAM(t) s’écrit :UAM= -L/R .[ d(UBM) /dt]
3- Trouver la valeur de l’induction L de la bobine en (mH) .
Partie 2 :
Pour étudier la modulation d’amplitude, on réalise le montage expérimental suivant :
Examen blanc N°08
Exercice 4 :
2SP – BIOF
Pr . RAZKAOUI Ahmed
Examen blanc N°08
2SP – BIOF
Pr . RAZKAOUI Ahmed
Groupe Scolaire Berrada
Examen blanc de fin d’année
Année Scolaire : 2020 / 2021
Matière
Physique - Chimie
Durée
3h
Option
Deuxième BAC - SC . PC – BIOF
Coeff
7
L’usage de la calculatrice scientifique non programmable est autorisé
Ce sujet comporte 2 exercices de chimie et 4 exercices de physique :
Chimie (7 points)
Chimie -1-
Etude d’une solution d’acide salicylique
Chimie -2-
Etude de la pile Cuivre - Aluminium
Physique (13 points)
Physique -1-
Propagation d’une onde mécanique progressive
Physique -2-
Propagation d’une onde lumineuse
Physique -3-
Le Radon et la qualité de l’air
Physique -4-
Etude d’un dipôle RC et d’un circuit RLC série
Physique -5-
Etude du mouvement d’une bille métallique
1 / 7
Chimie -1- (4,75 points)
0,25
0,5
0,75
L’acide salicylique de formule brute C7H6O3 est utilisé pour la synthèse de l’Aspirine qui
est considéré parmi les médicaments les plus efficaces pour les maux de tête, fièvre,…
On se propose, dans cet exercice, d’étudier les propriétés de cet acide symbolisé par
AH.
1- considérons une solution aqueuse (SA) de l’acide salicylique de concentration CA = 0,1
mol.L-1 et de pH = 2,4.
1-1/ Ecrire l’équation de la réaction de l’acide AH avec l’eau.
1-2/ Exprimer la constante d’équilibre K de cette réaction en fonction de [𝐻3 𝑂+ ]é𝑞 et
CA.
1-3/ Dans l’approximation où l’acide AH est faiblement dissocié dans l’eau
( [𝐻3 𝑂 + ]é𝑞 << CA ), montrer que le taux d’avancement final τ de cette réaction peut
s’écrire sous la forme :
0,5
0,25
0,5
0,5
0,25
0,75
𝑪𝑨
0,25
, puis calculer sa valeur. (on donne pKA = 3).
1-4/ On dilue un volume V de la solution (SA) en ajoutant de l’eau distillée, afin
d’obtenir une solution (SA’) de concentration CA ’. La mesure du pH de la solution (SA’) a
donné la valeur pH ’ = 2,8. Déterminer la concentration CA ’.
2- Pour vérifier la valeur de CA, on dose un volume VA = 16 mL de la solution (SA) par une
solution (SB) d’hydroxyde de sodium (Na+(aq) + HO-(aq)) de concentration CB = 0,1 mol.L-1 .
On suit les variations du pH du mélange en fonction de VB volume versé de la solution
(SB), et on obtient la courbe représentée ci-contre.
2-1/ Ecrire l’équation de la réaction du dosage.
2-2/ Calculer la constante d’équilibre K de cette
réaction.
2-3/ Déterminer les coordonnés du point
d’équivalence E.
2-4/ En déduire la valeur de CA.
2-5/ Pour un volume VB = 8 mL et à l’aide du
tableau d’avancement de cette réaction de dosage,
montrer que son taux d’avancement final τ peut
s’écrire sous la forme :
τ= 1 0,5
τ =√
𝑲𝑨
𝟏𝟎 𝒑𝑯−𝒑𝑲𝒆
𝑪𝑩
𝑽
(1 + 𝑽𝑨 ). Calculer τ et conclure.
𝑩
2-6/ Pour un volume versé de la solution (SB), VB = 18 ml, quelle est parmi les espèces
AH et A- celle qui prédomine dans le mélange réactionnel ? Justifier.
Donnée : à 25 ° la constante pKe vaut : pKe = 14.
Chimie -2- (2,25 points)
La pile de type ‘’métal/ion métallique’’ a été découverte à l’époque où l’évolution du
télégraphe nécessitait des sources de courant électrique continue.
Cet exercice a pour but d’étudier, d’une manière simplifiée, une pile Cuivre – Aluminium.
Données :
- Constante du Faraday : F = 96500 C.mol-1.
On réalise une pile Cuivre-Aluminium en liant deux demi-pile par un pont salin du nitrate
d’ammonium (NH4+ + Cl-).
2 / 7
0,25
0,25
0,5
0,5
0, 5
La première demi-pile est constituée d’une plaque métallique du cuivre
partiellement immergée dans une solution aqueuse du sulfate de cuivre II (Cu2+(aq)
+ SO42-(aq)) de concentration en ions Cu2+ est C1 = 0,10 mol.L-1 et de volume
V1 = 50 mL.
La deuxième demi-pile est constituée d’une plaque métallique d’aluminium
partiellement immergée dans une solution aqueuse du chlorure d’aluminium (Al3+(aq)
+ 3Cl-(aq)) de concentration en ions Al3+ est C2 = 0,010 mol.L-1 et de volume
V2 = 50 mL.
Un voltmètre électronique est branché aux bornes de la pile, où son pôle COM est lié à
l’électrode de cuivre, a mesuré la tension U = - 1,6 V.
1- Pour chacune des affirmations suivantes, choisir celle ou celles qui sont correctes :
A. Lors de son fonctionnement, une pile :
(a) évolue par transfert direct d’électrons entre ses réactifs
(b) évolue vers un état d’équilibre
(c) transforme une partie de l’énergie électrique en énergie chimique
(d) l’oxydation se fait à la cathode
B. Les porteurs de charge :
(a) sont des ions dans les parties métalliques du circuit
(b) se déplacent dans le sens du courant à l’extérieur de la pile
(c) sont des électrons dans le pont salin
(d) sont des ions dans les solutions contenues dans la pile
2- Montrer que la plaque d’aluminium représente l’anode de cette pile.
3- Donner le schéma conventionnel de la pile.
4- Ecrire les demi-équations des réactions produites au voisinage de chaque électrode et
en déduire l’équation bilan de la réaction au cours du fonctionnement de la pile, sachant
que les couples intervenants dans la réaction sont Al3+(aq)/Al(S) et Cu2+(aq)/Cu(S).
5- On remplace le voltmètre par un ampèremètre en série avec un conducteur ohmique
de résistance R, et on constate le passage d’un courant électrique d’intensité constante
I = 50 mA pendant une durée Δt = 1h. Exprimer la concentration des ions Cu2+ dans la
solution, en fonction de I, Δt, F, V1 et C2 , la concentration initiale de la solution du
chlorure d’aluminium. Calculer sa valeur.
Physique -1- (1,25 points)
Un vibreur provoque à l’instant t = 0, une onde progressive sinusoïdale le long d’une
corde. La figure ci-contre représente l’aspect de la corde à l’instant t = 400 ms.
3 / 7
0,75
Choisir, en justifiant, la seule bonne réponse parmi les réponses proposées.
Q.1 : La longueur d’onde λ vaut :
0,5
(A) : λ = 60 cm
(B) : λ = 30 cm
(C) : λ = 40 cm
(D) : λ = 20 cm
(E) Autre
réponse
Q.2 : La célérité de l’onde propagée le long de la corde vaut :
0,5
(A) : V = 0,35
m.s-1
(B) : V = 3,5
m.s-1
(C) : V = 35
m.s-1
Physique -4- (5 points)
(D) : V = 350
m.s-1
(E) Autre
réponse
(D) : en
quadrature de
phase
(E) Autre
réponse
Les deux parties I et II sont indépendantes.
I- On réalise le montage expérimental ci-contre constitué des éléments suivants :
Q.3 : Comparer les vibrations des points S et M.
0,25
(A) : en phase
(B) : en
opposition de
phase
(C) : même
phase
Générateur idéal de courant
Condensateur de capacité C, initialement déchargé.
Conducteur ohmique de résistance R.
Micro-ampèremètre.
Interrupteur K.
A l’instant t = 0, on met l’interrupteur K en position (1),
le micro-ampèremètre indique la valeur Io = 20 μA.
Un système d’acquisition informatique adéquat a permis
d’obtenir les variations de la charge q du condensateur en fonction de la tension uC aux
bornes du condensateur.( figure-2-)
Physique -2- (1,25 points)
On éclaire une fente verticale de largeur a = 0,1 mm par une source LASER donnant une
lumière monochromatique de longueur d’onde λ = 633 nm. On observe des taches
lumineuses de diffraction sur un écran qui se trouve à une distance D de la fente.
La célérité de la lumière dans le vide ou l’air c = 3.108 m.s-1.
0,25
0,5
0,5
0,25
1- Déterminer la valeur de la fréquence ν de la lumière utilisée.
2- Montrer que l’expression de la largeur de la tache centrale est 𝐿 =
2𝜆𝐷
𝑎
.
0,5
3- On répète la même expérience en utilisant un fil très fin vertical de diamètre d, la
largeur de la tache centrale devient alors L’ = 4 L. Déterminer la valeur de d.
Physique -3- (2 points)
La terre émet de façon naturelle le gaz radon 𝟐𝟐𝟐
𝟖𝟔𝑹𝒏. Ce gaz qui se propage facilement à
l’intérieur des immeubles se désintègre spontanément pour donner un noyau de polonium
𝟐𝟏𝟖
𝟖𝟒𝑷𝒐.
Il est considéré comme l’une des principales causes du cancer du poumon après la
cigarette. Selon l’instance internationale de la protection radioactive, la
concentration volumique de la radioactivité du gaz radon dans l’air des locaux ne
doit pas dépasser 400 Bq.m-3.
Données : Energies de masse des nucléons et du noyau de radon 222 :
Energie de masse en (Mev)
0,25
0,5
0,5
4- Pour s’assurer de la qualité de l’air à l’intérieur du hall d’un immeuble, un échantillon
d’air de volume V = 1 L est prélevé à l’instant to = 0 et son activité vaut ao = 0,6 Bq.
Déterminer l’activité du radon dans cet échantillon à l’instant t1 = 25h, et en déduire si
l’air à l’intérieur du hall de l’immeuble répond-il au critère fixé par l’instance
internationale de la protection radioactive à cet instant.( on donne t1/2 = 100h )
86 protons
136 neutrons
Noyau 𝟐𝟐𝟐
𝟖𝟔𝑹𝒏
80692,2
127781,1
206765,4
1- Donner la composition du noyau de radon 222 .
2- Ecrire l’équation de désintégration du noyau de radon 𝟐𝟐𝟐
𝟖𝟔𝑹𝒏 . Identifier le type de
cette désintégration.
3- Calculer, en unité Mev/nucléon, l’énergie de liaison par nucléon du noyau 𝟐𝟐𝟐
𝟖𝟔𝑹𝒏.
4 / 7
0,5
0,5
0,75
0,75
1- Déterminer graphiquement la valeur de la capacité C
du condensateur.
2- Déterminer la durée nécessaire pour que la tension aux
bornes du condensateur prends la valeur uC = 6V.
3- Quand la tension aux bornes du condensateur prends
la valeur uC = Uo, on bascule l’interrupteur K en position (2) à
un instant choisi comme nouvelle origine des dates (t = 0).
La courbe de la figure -3- représente les variations
de ln(uC) en fonction du temps.
3-1- Etablir l’équation différentielle vérifiée par la tension uC(t).
3-2- La solution de cette équation différentielle est
uC(t) = Uo.e-kt.
Trouver l’expression de k en fonction de R et C.
3-3- En exploitant la courbe, déterminer les valeurs
de Uo et R.
3-4- Soient t1 et t2 deux instants où la tension uC arrive
aux valeurs uC(t1) = 90% Uo et uC(t2) = 10% Uo .
Calculer l’énergie dissipée par effet joule dans le circuit
entre ces deux instants t1 et t2.
II- on réalise le montage de la figure 4 qui comprend :
- Un générateur de force électromotrice E = 12V et dont la
résistance interne est négligeable.
- Un conducteur ohmique de résistance R = 200Ω.
- Une bobine d’inductance réglable L et de résistance
uC(v)
ln(uC)
figure 4
5 / 7
négligeable.
- Un condensateur de capacité C’ = 0,5 µF.
- Un interrupteur K à deux positions.
Lorsque le condensateur est complètement chargé, on bascule l’interrupteur dans la
position (2) à un instant considéré comme origine du temps et on visualise la courbe
représentant les variations de la tension aux bornes du condensateur uc’ en fonction du
temps (figure 5) l’aide d’un dispositif approprié.
I- Etude du mouvement rectiligne avec frottement sur le plan incliné AO
Une bille métallique, de masse m = 23 g, est envoyé sur un plan incliné d’angle α = 30° par
rapport à l’horizontal d’un point A avec une vitesse initiale VA, à l’instant t = 0, pour
arriver au point O avec une vitesse Vo = 8 m.s-1.
On étudie le mouvement du centre d’inertie G de la bille dans le repère (A,𝑖⃗) supposé
Gliléen.
Au cours de son mouvement sur le plan incliné AO, la bille est soumise à des forces de
frottement équivalentes à une force ⃗⃗
𝒇 constante de sens opposé au mouvement et
figure 5
d’intensité 𝒇 = 2,3.10-2 N. On donne g = 10 m.s-2.
0,5
1- En appliquant la deuxième loi de Newton sur la bille, montrer que l’équation
différentielle que vérifie la vitesse VG du centre d’inertie G de la bille s’exprime comme
suit :
𝒅𝑽𝑮
𝒅𝒕
= - (
𝒇
𝒎
+ g sin α )
0,25
2- En déduire la nature du mouvement de G.
0,5
3- Déterminer la valeur de la vitesse VA ainsi que la distance AO sachant que le
mouvement de A à O a duré 5 secondes.
II- Etude du mouvement dans le champ de pesanteur uniforme
0,5
0,25
0,25
0,25
0,5
1- Etablir l’équation différentielle que vérifie la tension uc’(t) aux bornes du
condensateur en fonction du temps.
2- Déterminer graphiquement la valeur de la pseudo-période T.
3- On considère que la valeur T est égale à la période propre To de l’oscillateur LC. En
déduire la valeur L.
4- Quelle est la forme de l’énergie emmagasinée dans le circuit à l’instant t = 6 ms.
Justifier.
5- Sachant qu’à l’instant t = 4 ms la valeur l’énergie totale emmagasinée dans le circuit
vaut ET = 7,5 μJ , et en exploitant la courbe de la figure-5-, déterminer la valeur de la
tension uR aux bornes du conducteur ohmique à cet instant.
Physique -5- (3,5 points)
La bille continue son mouvement, du point O à une date considérée comme nouvelle
origine des dates, dans le champ de pesanteur uniforme afin de tomber au point P comme
le montre la figure. On étudie le mouvement de G dans le repère (OXY) supposé Galiléen.
0,5
1- En appliquant la deuxième loi de Newton, trouver les équations horaires du
mouvement.
0,25
2- En déduire l’équation de la trajectoire y(x) du mouvement de la bille.
0,5
3- Déterminer tp l’instant d’arrivée de la bille au point P du sol.
0,5
4- Déterminer la valeur de la vitesse Vp de la bille au point P.
0,5
5- En déduire l’orientation (la valeur de l’angle noté θ) que fait le vecteur vitesse, au
point P, avec la verticale (OY).
On se propose dans cet exercice d’étudier le mouvement d’une bille métallique en
plusieurs situations mécaniques.
(figure)
⃗⃗⃗⃗⃗⃗
𝑽
𝑶
O
x
P
A
𝑖⃗
h = 3m
α
Y
6 / 7
7 / 7
I. TEMPS DE DEMI-VIE ET TEMPS DE DEMI-REACTION (6 points)
BAC BLANC
1. Temps de demi-vie
Le thorium 230Th est utilisé dans la datation des coraux et concrétions carbonatées ainsi que dans la
datation des sédiments marins et lacustres. Dans un échantillon de « thorium 230 », on appelle N(t) le
nombre de noyaux de thorium présents à chaque date t et N0 celui des noyaux présents à la date t0 = 0 an.
N (t )
On a représenté dans l’annexe 1 (A RENDRE AVEC LA COPIE) la courbe donnant le rapport
.
N0
230
1.1. Le noyau Th est un émetteur α et se désintègre pour donner du 88Ra. Indiquer ce que représente α et
écrire l’équation de la réaction nucléaire correspondante, en énonçant les lois utilisées (le noyau de radium
est obtenu dans un état non excité).
mars 2006
1.2. Donner la définition du temps de demi-vie t1/2 et déterminer sa valeur pour le thorium 230Th en
expliquant succinctement la méthode utilisée.
1.3. Donner l’expression mathématique de la loi de décroissance radioactive et calculer la constante
radioactive en année –1.
PHYSIQUE - CHIMIE
1.4. Parmi ces grandeurs :
- l’âge de l’échantillon de noyaux
- la quantité initiale de noyaux.
- la température
- la nature des noyaux
quelle est la seule grandeur qui fait varier le temps de demi-vie ?
Série S
1.5. Le thorium 230Th fait partie de la famille radioactive de l’uranium 238U. Une famille radioactive est
composée d’un ensemble de noyaux radioactifs, tous issus d’un noyau initial instable qui, de père en fils,
par désintégrations successives conduisent à un noyau stable, ici le « plomb 206 ». L’ « uranium 238 »,
dissous à l’état de traces dans l’eau de mer, produit des atomes de « thorium 230 » suivant les réactions
nucléaires suivantes :
DUREE DE L’EPREUVE : 3 H 30. - COEFFICIENT : 8
238
92 U
!
234
90Th
!
234
91 Pa
!
234
Z4 U
!
230
Z5Th
Donner les valeurs de Z4 et Z5, en les justifiant, et indiquer le type de radioactivité pour les deux premières
transformations.
L’usage des calculatrices est autorisé
Ce sujet comporte un exercice de PHYSIQUE –CHIMIE, deux exercices de PHYSIQUE et un exercice de
CHIMIE présentés sur 10 pages numérotées de 1 à 10, y compris celle-ci et les feuilles annexes relatives
aux exercices I , II et IV, à rendre avec la copie, numérotées 8/10, 9/10 et 10/10.
Le candidat doit traiter les quatre exercices qui sont indépendants les uns des autres :
I.
II.
III.
IV.
Temps de demi-vie et temps de demi-réaction (6 points)
Charge et décharge d’un condensateur (6 points)
Frédéric et son pistolet à fléchette (3 points)
Déterminer la constante d’équilibre par deux méthodes (5 points)
page 1 / 10
1.6. Au début de leur formation, les concrétions carbonatées des coraux contiennent de l’ « uranium 238 »
et pas de « thorium 230 ». La méthode de datation de ces carbonates repose sur le rapport des nombres de
N ( 230Th)
noyaux :
. Ce rapport augmente au cours du temps jusqu’à ce qu’on appelle « l’équilibre
N ( 238U )
séculaire ». Celui-ci correspond à l’état où les deux populations des noyaux d’ « uranium 238 » et de
« thorium 230 » ont même activité.
dN (t )
1.6.1. L’activité A(t) d’une population de noyaux identiques est définie ici par : A(t ) = !
dt
Montrer que A(t) = λ.N(t) pour une population de noyaux donnée.
N ( 230Th)
1.6.2. En déduire, qu’à l’équilibre séculaire, le rapport
est constant.
N ( 238U )
page 2 / 10
2. Temps de demi-réaction :
II. CHARGE ET DECHARGE D’UN CONDENSATEUR (6 points)
On étudie maintenant la décomposition chimique au cours du temps, en présence d’un catalyseur,
d’une solution aqueuse de peroxyde d’hydrogène ou eau oxygénée, de concentration molaire effective
[H2O2]0 = 9,0×10–2 mol.L–1 à t0 = 0 s, suivant la réaction :
2 H2O2 (aq) =
O2 (g) + 2 H2O (l)
Le peroxyde d’hydrogène se décompose à température ambiante.
La courbe de l’annexe 2 (A RENDRE AVEC LA COPIE) donne l’évolution de la concentration de la
solution aqueuse d’eau oxygénée en fonction du temps.
2.1. L’eau oxygénée appartient au couple O2 / H2O2.
En utilisant l’équation associée à la réaction précédente, donner le second couple auquel appartient l’eau
oxygénée, en précisant pour chaque couple si elle constitue l’oxydant ou le réducteur.
2.2. Justifier en exploitant la courbe, sans calcul, le fait que l’on peut considérer la décomposition du
peroxyde d’hydrogène comme une transformation chimique lente et totale.
2.3. Définir le temps de demi-réaction. Déterminer sa valeur approximative à partir de la courbe 1 de
l’annexe 2.
2.4. Effet de la concentration initiale
La courbe 2 de l’annexe 2 donne l’évolution de la concentration de la solution d’eau oxygénée en fonction
du temps, avec : [H2O2]0 = 1,8×10 –1 mol.L-1
A partir des courbes 1 et 2, quelle est l’influence de la concentration molaire initiale sur le temps de demiréaction ?
2.5. Effet de la température
Sur la figure de l’annexe 2 tracer l’allure de la courbe donnant, pour une température plus faible,
l’évolution de la concentration de la solution d’eau oxygénée en fonction du temps, avec
[H2O2]0 = 9,0×10 –2 mol.L-1
On réalise le montage ci-contre comportant :
- un générateur de f.é.m. E = 9,0 V et de résistance interne
négligeable ;
- un condensateur dont la capacité varie entre 40 et 80 µF ;
- un conducteur ohmique de résistance R = 40 Ω.
uC
1. Le condensateur est préalablement déchargé. Quel est le
phénomène physique mis en jeu quand on place l’interrupteur
K en position (1) ? Pourquoi ce phénomène est-il très rapide ?
2. Un ordinateur muni d’une carte d’acquisition permet d’enregistrer l’évolution au cours du temps de la
tension uAM aux bornes du condensateur. L’acquisition commence quand on bascule l’interrupteur K de la
position (1) à (2). Ces données sont traitées par un tableur grapheur pour obtenir la courbe de la figure 1 de
l’annexe 3 (A RENDRE AVEC LA COPIE).
2.a. Quel est le phénomène physique mis en évidence ?
2.b. En utilisant la courbe de la figure 1 de l’annexe 3 (A RENDRE AVEC LA COPIE), déterminer la
constante de temps de ce phénomène ; en déduire une valeur approchée de la capacité du condensateur.
2.c. On reprend cette expérience avec un condensateur de capacité deux fois plus grande. Dessiner sur la
figure 1 de l’annexe 3 (A RENDRE AVEC LA COPIE) l’allure de la courbe obtenue. Justifier
brièvement.
3. L’étude théorique de ce phénomène conduit à une équation différentielle : RC
3. Conclusion
Les grandeurs
I. Dipôle RC.
où uC est la tension aux bornes du condensateur.
N (t )
et [H2O2](t) évoluent dans le temps suivant la même loi mathématique.
N0
du c
dt
+ uc = 0
3.a. Retrouver cette équation différentielle en appliquant la loi d’additivité des tensions.
Quelle(s) analogie(s) et quelle(s) différence(s) peut-on constater en ce qui concerne les facteurs qui
influencent le temps de demi-vie et le temps de demi-réaction dans les exemples étudiés ?
Remarque : ce résultat, obtenu dans le cas de la réaction étudiée, n’est pas généralisable à toute
transformation chimique.
-
3.b. La solution de cette équation différentielle est de la forme : uC = A . e B.t.
Déterminer l’expression des constantes positives A et B.
II. Dipôle RLC.
On réalise le montage suivant comportant :
- un générateur de f.é.m. E = 9,0 V et de résistance interne
négligeable ;
- un condensateur dont la capacité varie entre 40 et 80 µF ;
- une bobine d’inductance L = 1,0 H et de résistance interne
r = 10 Ω ;
- un conducteur ohmique de résistance R’ = 5,0 Ω.
L’interrupteur K est placé en position (1) puis basculé en
position (2), l’acquisition commence à ce moment.
1.a. Quelles sont les grandeurs mesurées en voies Y1 et Y2 du système d’acquisition ?
1.b. L’une des grandeurs permet de connaître les variations de l’intensité i du courant électrique.
Laquelle ? Justifier.
page 3 / 10
page 4 / 10
2. Les données acquises en voies Y1 et Y2 sont traitées par un tableur grapheur pour obtenir la courbe de la
figure 2 de l’annexe 3 (A RENDRE AVEC LA COPIE).
2.a. Associer les courbes x et y de la figure 2 de l’annexe 3 (A RENDRE AVEC LA COPIE) aux voies
Y1 et Y2.
IV. UN PEU DE CHIMIE DU VIN . (5 points)
Cet exercice comporte deux parties indépendantes.
2.b. Quel est le phénomène observé ? Pourquoi ne se produit-il pas dans l’expérience de la partie I ?
2.c. Mesurer la pseudo-période T des oscillations, en déduire la valeur de la capacité C.
A. Première partie : à propos du dioxyde de soufre dissout dans le vin.
3. Le tableur grapheur permet d’obtenir les courbes représentant les variations de l’énergie électrique EE
emmagasinée par le condensateur ; de l’énergie magnétique EM emmagasinée par la bobine et de leur
somme E = EE + EM. Ces courbes sont données à la figure 3 de l’annexe 3 (A RENDRE AVEC LA
COPIE).
Le dioxyde de soufre (ou acide sulfureux , anhydride sulfureux , gaz sulfureux) a été depuis longtemps
utilisé pour la conservation des fûts de chêne . Il est volontairement ajouté au vin lui-même, qu’il protège
des altérations par son pouvoir antiseptique et oxydant .
Le dioxyde de soufre introduit dans un vin se combine en quelques heures aux composés organiques à
fonction carbonyle .Il en reste néanmoins une fraction « à l’état libre » . Il existe en solution sous trois
formes :
SO2 ( dioxyde de soufre ) , HSO3 - ion hydrogénosulfite ,
SO3 2- ion sulfite.
3.a. Donner les expressions littérales des énergies EE et EM.
3.b. Identifier les courbes (3) ; (4) ; (5) de la figure 3 de l’annexe 3 (A RENDRE AVEC LA COPIE) en
justifiant la réponse. En comparant les courbes (3) et (4), donner une interprétation du phénomène étudié.
3.c. Interpréter qualitativement l’évolution de l’énergie représentée par la courbe (5). Évaluer l’énergie
dissipée pendant les 50 premières millisecondes.
1) On donne les couples suivants et leur pKa à 25 °C :
couple (1) SO2 , H2O / HSO3 - : pKa1 =1,9
couple (2)
a) Écrire l’équation chimique modélisant l’action de
constante d’acidité Ka1 .
HSO3 - / SO3 2- : pKa2 =7,2
SO2 sur l’eau . Écrire l’expression de sa
b) Écrire l’équation chimique modélisant l’action de la forme acide
l’expression de la constante d’acidité Ka2 .
sur l’eau. Écrire
c) Établir le domaine de prédominance de ces trois formes en fonction du pH .
III. Frédéric et son pistolet à flèches (3 points)
Frédéric décide d'utiliser ses connaissances en mécanique pour étudier le mouvement d’une flèche tirée par
son pistolet.
Négligeant l'action de l'air et prenant la valeur g = 10 m.s-2 pour la pesanteur, il considère la flèche A
r
comme un objet ponctuel de masse m = 50 g et de vitesse initiale v 0 .
r
La flèche est tirée d'un point M, à la distance d, au-dessus du sol, avec une vitesse v 0 verticale.
2) Le pH d’un vin est de l’ordre de 3 -3,5. Parmi les espèces chimiques citées, quelle est celle qui
prédomine ?
3) Le graphique 1 donné en annexe 4 (A RENDRE AVEC LA COPIE) indique la proportion
(pourcentage molaire) de chacune de ces trois espèces chimiques en fonction du pH .
a) Identifier les trois courbes . (On mettra le nom de l’espèce chimique dans le rectangle.)
b) En utilisant la relation entre le pH et le pKa d’un couple, montrer que ce graphique permet de
retrouver les valeurs de pKa1 et pKa2 .
1. Etude théorique du mouvement de la flèche.
y
Dans le repère (O, x, y) (cf. schéma ci-contre), O étant le point du sol
se trouvant à la verticale de M), établir sous forme littérale les
équations horaires du mouvement de la flèche après son lancement.
4) Le tableau ci-dessous donne la teneur en forme SO2 pour 100 mg d’anhydride sulfureux libre en
fonction du pH du vin .
r
v0
M
2. Détermination expérimentale de la valeur vo.
Le canon du pistolet est vertical ; son extrémité est située au point M2
tel que d = 1,70 m. Frédéric tire vers le haut et constate que la flèche
touche le sol 2,20 s après son départ de M2.
Calculer la valeur vo de la vitesse initiale, en utilisant les équations
établies dans la première partie.
HSO3-
SO2 en mg
9,3
7,5
5,9
4,7
3,7
3,0
2,3
1,9
1,2
pH
2,8
2,9
3,0
3,1
3,2
3,3
3,4
3,5
3,7
a) Justifier l’évolution indiquée ci-dessus.
d
r
j r
i
b) Calculer, en utilisant la relation entre le pH et le pKa, pour un vin blanc Sainte Croix du Mont de
pH 3,5 , la valeur des rapports suivants : [HSO3-] / [SO2 ] et
[SO3 2- ] / [HSO3 - ]
.
x
c) Ces résultats sont-il en accord avec la question 2 ?
O
3. Sommet de la trajectoire.
Calculer la valeur H de la hauteur maximale atteinte par la flèche, en utilisant les équations établies dans la
première partie.
page 5 / 10
page 6 / 10
B. Deuxième partie : détermination de l’acidité d’un vin.
Le vin contient d’autres espèces acides : des acides organiques ( tartrique , malique , citrique … ) et les
espèces dues à la dissolution du gaz carbonique .
On élimine l’acidité volatile d’un échantillon de vin par un chauffage à reflux à 100 °C pendant 20 minutes
On prélève ensuite un volume Vo = 20,0 mL de vin que l’on dose par une solution d’hydroxyde de sodium
de concentration molaire C égale à 1,00 .10 -1 mol.L-1.
Numéro d’anonymat :
ANNEXE 1 relative à l’exercice I
N(t)
N0
Un suivi pHmètrique permet de construire la courbe 2 de l’annexe 4 (A RENDRE AVEC LA COPIE)
de dosage ci-dessous. Tous les acides présents sont dosés simultanément. Afin de simplifier l’écriture de la
réaction de titrage on confondra tous les acides sous une seule et même notation : AH.
1) Définir l’équivalence d’un titrage .
2) Remplir le tableau d’avancement donné en annexe 4 (A RENDRE AVEC LA COPIE).
3) Établir la relation entre la quantité n0 d’acide dosé et la quantité de matière d’ions hydroxyde n(HO-)E
versée à l’équivalence .
En déduire la concentration molaire de tous les acides présents.
4) Pour être commercialisable en France, un vin doit présenter une acidité minimale de 50 mmol.L-1. Ce
vin est-il conforme à la législation ?
t en milliers
d'années
ANNEXE 2 relative à l’exercice I
[H2O2]
en mol.L-1
courbe 2
15,0x10-2
10,0x10-2
courbe 1
5,0x10-2
t en min
0
page 7 / 10
20
40
60
(À RENDRE AVEC LA COPIE)
80
100
page 8 / 10
Numéro d’anonymat :
Numéro d’anonymat :
ANNEXE 3 relative à l’exercice II
ANNEXE 4 relative à l'exercice IV
% molaire
uC (V)
u c( V )
100
Figure 1
8
80
6
60
4
Graphique 1
B
2
0
C
40
0
5
10
15
t (ms)
(tm s )
20
pH
0
0
2
4
6
8
10
Figure2
Date
Avancement
pH
d( pc m
H ª?)
pH = f (V)
12
10
Graphique 2
Figure3
2
8
6
dpH /dV= f (V)
1
4
2
0
(À RENDRE AVEC LA COPIE)
page 9 / 10
0
5
10
15
(À RENDRE AVEC LA COPIE)
20
0
2 5 (Vm L )
page 10 / 10
EXERCICE I : Les indicateurs colorés naturels de la cuisine à la chimie
(8 points)
La première utilisation d'un indicateur coloré pour les titrages acido-basiques remonte à 1767 par
W. Lewis. Il employait un extrait de tournesol (...) .
On utilisait à l'époque des extraits de plantes qui changent de couleur avec l'acidité du milieu (...).
On peut en citer quelques-uns parmi les plus connus et les meilleurs :
- l'artichaut (...)
- la betterave rouge (...)
- le chou rouge, de loin l'extrait le plus intéressant car sa couleur change nettement suivant la valeur du
pH :
pH
0-3
4-6
7-8
9-12 13-14
couleur
rouge violet bleu
vert
jaune
d'après Chimie des couleurs et des odeurs
BACCALAURÉAT BLANC GÉNÉRAL
Session février 2007
PHYSIQUE – CHIMIE
1. Des indicateurs colorés en cuisine.
Série S
Le chou rouge est un légume riche en fibres et en vitamines, qui se consomme aussi bien en salade que
cuit.
Mais la cuisson du chou rouge peut réserver des surprises: chou rouge et eau de cuisson deviennent
rapidement bleus. Pour rendre au chou sa couleur violette, on peut ajouter un filet de citron ou du
vinaigre.
Après avoir égoutté le chou, une autre modification de couleur peut surprendre le cuisinier: versée dans un
évier contenant un détergent, l'eau de cuisson devient verte.
En utilisant les textes ci-dessus
1.1. Donner la propriété essentielle d'un indicateur coloré acido-basique.
DUREE DE L’ÉPREUVE : 3h 30 – COEFFICIENT : 6
1.2. Préciser le caractère acide ou basique du vinaigre et du détergent.
2. Des indicateurs colorés pour les titrages.
De nos jours, les indicateurs colorés sont toujours largement utilisés pour les titrages. La pH-métrie
est une autre technique de titrage acido-basique qui permet en outre de choisir convenablement un
indicateur coloré acido-basique pour ces mêmes titrages.
L’usage des calculatrices est autorisé
Bien inscrire sur l’en tête visible de la copie la classe et l’enseignement de spécialité suivi : mathématiques,
sciences physiques ou S.V.T.
Dans la suite de l'exercice, on s'intéresse au titrage de l'acide éthanoïque de formule CH3 – CO2H
(noté par la suite HA) contenu dans un vinaigre commercial incolore.
La base conjuguée de cet acide sera notée A– .
Ce sujet comporte trois exercices présentés sur 12 pages numérotées de 1 à 12, y compris celle-ci et celles de
la feuille annexe
2.1. Dilution du vinaigre.
Le vinaigre commercial étant trop concentré pour être titré par la solution d'hydroxyde de sodium
disponible au laboratoire, on le dilue dix fois. On dispose pour cela de la verrerie suivante :
Éprouvettes :
5 mL
10 mL
25 mL
50 mL
100 mL
Pipettes jaugées : 1,0 mL
5,0 mL
10,0 mL
20,0 mL
Fioles jaugées :
150,0 mL
200,0 mL
250,0 mL
500,0 mL
La feuille annexe, insérée au milieu de ce sujet, est à rendre avec la copie
Le candidat doit traiter les trois exercices, qui sont indépendants les uns des autres :
Les indicateurs colorés naturels de la cuisine à la chimie
Des oscillations électriques à la cuve à ondes
III.
Supernova
I.
II.
(8 points)
(7 points)
(5 points)
Choisir dans cette liste la verrerie la plus appropriée pour effectuer la dilution. Justifier.
2.2. Réaction de titrage.
1
2
On titre un volume VA = 10,0 mL de la solution diluée de vinaigre par une solution aqueuse d'hydroxyde
de sodium (ou soude) de concentration molaire en soluté apporté cB = 1,0 × 10–1 mol.L-1.
On ajoute un volume Veau = 60 mL afin d'immerger les électrodes du pH-mètre après agitation.
Le suivi pH-métrique de la transformation permet de construire la courbe fournie dans l'ANNEXE À
RENDRE A VEC LA COPIE.
Cette partie a pour but de vérifier que la transformation associée à la réaction de titrage est totale.
Pour cela, on déterminera son taux d'avancement final pour un volume VB = 6,0 mL de solution aqueuse
d'hydroxyde de sodium versé.
Donnée : produit ionique de l'eau à 25°C Ke = 10 –14
2.2.1. Écrire l' équation associée à la réaction de titrage.
[A ind
]éq
[HA ind ]éq
=10pH-pKi
On s'interroge sur les couleurs que prendrait le mélange réactionnel lors du titrage colorimétrique de
l'acide éthanoïque en présence d'une petite quantité de l'un ou l'autre de ces extraits naturels.
2.4.2. La courbe pH-métrique montre que, pour VB = 9,8 mL, le pH de la solution est voisin de 6,5 et que,
pour VB = 10,1 mL, il est voisin de 10,5.
Pour chaque extrait naturel et pour chacun de ces deux volumes VB, déterminer la valeur du
[A ind
]éq
rapport
puis compléter la ligne correspondante du tableau de l'ANNEXE À RENDRE
[HA ind ]éq
AVEC LA COPIE.
2.2.2. Pour VB = 6,0 mL, déterminer le réactif limitant.
2.2.3. Pour VB = 6,0 mL, déterminer l'avancement maximal xmax . On pourra s'aider d'un tableau
d'avancement.
2.2.4. Après avoir relevé la valeur du pH du mélange obtenu, déterminer la quantité de matière d'ions
hydroxyde restante après la transformation (n HO - )f dans le volume total de mélange réactionnel.
2.4.3. En déduire les couleurs observées dans chaque cas. Compléter la ligne correspondante du tableau
de l'ANNEXE À RENDRE AVEC LA COPIE.
2.4.4. Conclure sur l'indicateur coloré le plus adapté pour ce titrage.
2.4.5. Pourquoi faut-il choisir un vinaigre incolore pour ce type de titrage ?
2.2.5. Déterminer le taux d'avancement final et conclure.
2.3. Détermination par titrage de la concentration molaire en acide éthanoïque apporté du vinaigre.
2.3.1. Déterminer graphiquement sur l'ANNEXE À RENDRE AVEC LA COPIE le volume de la
solution d'hydroxyde de sodium versé à l'équivalence. Préciser la démarche utilisée.
2.3.2. Déterminer la valeur de la concentration molaire en acide éthanoïque apporté cA dans le vinaigre
dilué et en déduire la valeur de la concentration molaire en acide éthanoïque apporté c0 du vinaigre
commercial.
2.4. Retour historique …
On souhaite réaliser un titrage colorimétrique de l'acide éthanoïque contenu dans le vinaigre dilué avec un
des deux extraits naturels (artichaut et betterave rouge) utilisés au dix huitième siècle.
Pour chaque indicateur coloré, on considère que les teintes sont dues à la prédominance d'une espèce
chimique, notée HAInd pour sa forme acide et A–Ind pour sa forme basique. Le pKA des couples HAInd/ A–Ind
sera noté pKi.
On donne les valeurs des pKi à 25°C :
artichaut: (pKi )1 = 7,5
betterave rouge: (pKi)2 = 11,5
pKi
Teinte pour HAInd dominant
Teinte pour A–Ind dominant
Artichaut
7,5
incolore
jaune
Betterave
11,5
rouge
jaune
2.4.1. En utilisant l'expression de la constante d'acidité Ki, montrer que la relation suivante est vérifiée :
3
4
EXERCICE II : Des oscillations électriques à la cuve à ondes
(7 points)
Les différentes parties du problème sont indépendantes.
B)
Étude des ondes
Pour étudier les ondes progressives sinusoïdales à la surface de l'eau, on utilise une cuve à ondes.
Un vibreur permet de générer des ondes planes circulaires de fréquence f à la surface de l'eau. Les crêtes
des vagues donnent des rides brillantes et les creux des rides sombres sur un écran que l'on photographie.
Afin d'apprécier l'échelle, 2 marques A et B ont été faites sur l'écran qui correspondent à une distance AB =
7,0 cm dans la cuve.
1.
Mesure de la célérité des ondes.
A) Étude du vibreur
La surface de l'eau est excitée par de l'air pulsé : les pulsations sont créées par une petite pompe. Leur
fréquence peut être réglée de 10 à 40 Hz grâce à un oscillateur électrique entretenu.
Les oscillations électriques peuvent être obtenues à l'aide d'un condensateur de capacité C= 30 µF relié à
une bobine d'auto-inductance L et de résistance interne r : ( L,r).
2. Influence de la profondeur de l'eau sur la célérité des ondes.
2.1. Pour étudier l'influence de la profondeur h de l'eau sur la célérité des ondes, on place sur le
fond de la cuve une plaque (P) de plexiglas transparent. On délimite ainsi des zones de profondeur h
et h' (h' < h). On génère des ondes incidentes planes sinusoïdales de fréquence f = 11 Hz. Montrer,
en utilisant la photo 3 (page 8), que la célérité des ondes dépend de la profondeur de l'eau.
R
t
RC ) est bien solution
c) Vérifier que u C (t ) = E (1 − e
de cette équation différentielle.
2. À l'instant t = 0 s, l’interrupteur K’ est fermé et
simultanément K est ouvert, ce qui a pour effet de relier le
condensateur, porteur de la charge Q0, à la bobine. On
peut, à l'aide d'une interface appropriée, visualiser uC(t) :
tension aux bornes du condensateur, sur l'écran d'un
ordinateur et on obtient la courbe n°1 (page 7).
vibreur
h'
r
h
P
2.2. On remplace la plaque P par une plaque P', on obtient la photo 4 (page 8). Quel phénomène
observe-t-on ? (On pourra se référer à des phénomènes lumineux abordés en seconde).
a) uC(t) est-elle une fonction périodique ?
Comment qualifie-t-on un tel régime d'oscillations ?
b) Calculer l'énergie E0 emmagasinée par le condensateur à l'instant t0 = 0 s.
c) Calculer l'énergie E1 emmagasinée par le condensateur à l'instant t1 = 30 ms.
d) Interpréter la variation de l'énergie entre les instants t0 et t1.
e) Ce dispositif peut-il être utilisé pour créer les oscillations à la surface de l'eau ?
i
3. On désire entretenir les oscillations.
a) Que signifie: "entretenir les oscillations" ?
b) Pour ce faire, on introduit un montage équivalent à un dipôle D
fournissant une puissance p = r i2 où r a la même valeur que la résistance
de la bobine. Quel est le nouveau régime des oscillations ?
c) Quelle est alors la forme de uC(t) ? Ce montage peut-il être utilisé
pour générer des ondes sinusoïdales dans la cuve ? (justifier).
d) Quelle est la fréquence propre des oscillations si L = 0,75 H et C
= 30 µF ?
1.2. À l'aide de la photo 1 (page 8), déterminer le plus précisément possible la longueur d'onde
λ1 et calculer la célérité v1 des ondes sachant que pour cette expérience 1 la fréquence des
vibrations est f1 = 8,0 Hz.
1.3. Une expérience 2 est réalisée à une fréquence différente f2 = 17 Hz.
a) À l'aide de la photo 2 (page 8), montrer que la célérité des ondes varie avec leur
fréquence.
b) Comment appelle-t-on ce phénomène ?
1. En gardant K’ ouvert, on ferme K.
a) Tracer sur votre feuille le schéma simplifié du
montage simplifié en y représentant uC(t) et le
sens conventionnel du courant. Préciser la
convention utilisée pour la tension.
b) Déterminer l’équation différentielle vérifiée par
uC(t) lors de cette phase.
−
1.1. À l'aide du vibreur, on crée des ondes progressives sinusoïdales de fréquence f à la surface
de l'eau. Le phénomène observé possède une longueur d’onde λ.
a) Définir ce qu’est la longueur d’onde λ.
b) Quelle relation existe-t-il entre la longueur d’onde λ, la fréquence f et la célérité v des
ondes observées ?
C
2.3.
2.3.1. En eau très profonde, pour des vagues de basse fréquence, on peut démontrer que la célérité
v des ondes ne dépend pratiquement plus de h. Elle varie alors proportionnellement à la période T
g
suivant la loi : v =
T , où g est l'intensité de la pesanteur (g = 9,8 m s-2). Calculer v1 et v2 pour
2π
les fréquences f1 = 5,0 Hz et f2 = 10 Hz, ainsi que les longueurs d'onde λ1 et λ2 correspondantes.
A
uC
uAB
D
L, r
2.3.2. On excite sinusoïdalement un point S à partir de l'instant t = 0 s. On observe un point M à
10 m de S. À quel instant t1 le point M entre t-il en vibration si la fréquence excitatrice en S est
f1 = 5 Hz ?
Calculer de même l'instant t2 pour une fréquence f2 = 10 Hz.
B
5
6
Courbe 1
7
8
EXERCICE III : Supernova
(5 points)
Le texte suivant est adapté du site de l’université de Jussieu (Paris VI) :
2. Confirmation de l’hypothèse de Pankey
La vie d'une partie des étoiles s'achève dans une gigantesque explosion, appelée supernova, qui peut
amener une seule étoile à être, pendant quelques jours, aussi brillante qu'une galaxie composée de
milliards d’étoiles. Pour les plus brillantes, l'éclat de l’étoile diminue de façon exponentielle.
Dès 1950, l'idée fut émise que les restes d’une supernova contiennent des noyaux radioactifs engendrés par
des réactions thermonucléaires lors de l'explosion, et que c'est l'émission de ces noyaux qui alimente
l'astre en énergie pendant les années suivantes.
En 1962, J. Pankey mit en avant la chaîne nickel-56 cobalt-56 fer-56 : le nickel-56 a une durée de demi-vie
de 6 jours, et le cobalt-56 de 10 semaines ; l'ensemble rendait bien compte des observations de la
luminosité des supernovae, et de surcroît la genèse du fer, le plus abondant des éléments lourds dans
l'Univers, était révélée.
En 1987, dans une petite galaxie située à 170 mille années de lumière, une supernova apparut. Tous les
instruments en fonctionnement au sol et dans l'espace furent braqués sur elle. La brillance de l'objet dans
le ciel déclinait bien au rythme de la décroissance du nickel-56, puis du cobalt-56. Mais surtout, les rayons
γ émis par cet astre furent enregistrés par des dispositifs sensibles placés à bord de satellites. En effet, la
décroissance radioactive des noyaux de cobalt-56 s'accompagne de l'émission de rayons γ à une énergie
bien déterminée de 1238 kiloélectronvolts (keV). Les suppositions de Pankey furent confirmées dans les
moindres détails.
Ainsi fut vérifiée cette prédiction extravagante : le fer, roi de la création nucléaire, le plus solide des
noyaux d'atomes, n'est pas créé en tant que fer, mais en tant que nickel radioactif.
Données :
Célérité de la lumière dans le vide : c = 3, 00.108 m.s -1
Notation atomique de quelques éléments stables :
59
59
28 Ni
27 Co
neutron
1,67493.10–27
À la date t0 = 40 jours après l’apparition de la supernova, le télescope Ginga de la NASA, sensible aux
rayons γ, s’est tourné vers la supernova pour suivre l’évolution de sa luminosité pendant une période de 6
mois. Ginga était muni d’un filtre afin de ne détecter que les photons γ (*) d’une énergie de 1238 keV.
On a obtenu la courbe 1 donnée en ANNEXE (à rendre avec la copie). Cette courbe indique le nombre de
photons γ détectés par Ginga par heure d’observation et par mètre-carré.
(*)
Le rayonnement lumineux émis lors d’une transformation nucléaire peut être interprété comme une
« particule de lumière » appelée photon.
On considère dans les questions 2.1. et 2.2. que l’hypothèse de Pankey est vraie.
2.1. Justifier qu’à la date t0 le nombre de noyaux de nickel-56 dans la supernova est négligeable.
2.2. Expliquer pourquoi la courbe permet de visualiser la décroissance radioactive des noyaux de cobalt-56.
2.3. Mesurer sur la courbe la demi-vie du noyau radioactif responsable de la décroissance.
2.4. À l’aide du texte, en déduire que l’émission γ de la supernova est compatible avec l’hypothèse de la
chaîne nickel-56 cobalt-56 fer-56.
3. Estimation de l’activité de la supernova
3.1. Rappeler la définition de l’année de lumière (a.l.). Estimer la date à laquelle l’explosion de l’étoile a eu
lieu.
3.2. Exprimer, en mètres, la distance D séparant le système solaire de la supernova observée en 1987.
56
26
3.3. À l’aide d’une propriété générale des ondes à rappeler, dire où se situe, à la date t + ∆t, l’énergie
lumineuse émise par la supernova à la date t.
Fe
−19
Électron-volt : 1 eV = 1, 602.10 J
Masses (en kg) :
électron
proton
9,11.10–31
1,67264.10–27
1.5. Calculer l’énergie de liaison du noyau de fer-56. Montrer que le noyau de fer est plus stable que le
noyau de cobalt-56 qui a pour énergie de liaison ε l ( 56 Co ) = 7,80.10 −11 J = 487 MeV .
cobalt 56
9,28677.10–26
3.4. [Question hors-barême]
Montrer que, si un télescope dirigé vers une source lumineuse située à une distance D mesure un
nombre NT de photons par mètre carré et par heure, le nombre de photons NS émis par heure par la
source au moment où elle a émis ce rayonnement peut être évalué avec la formule :
NS = 4π.D2.NT
Evaluer l’ordre de grandeur de l’activité de la supernova à l’instant où elle a émis le rayonnement
détecté sur Terre à la date t1 = 90 jours après l’explosion de l’étoile.
fer 56
9,28619.10–26
1. Énergie libérée par une désintégration radioactive
1.1. Énoncer les lois de conservation applicables aux transformations nucléaires.
1.2. Écrire l’équation de la transformation nucléaire du nickel 56, en considérant que le noyau fils n’est pas
produit dans un état excité. Préciser de quel type de radioactivité il s’agit.
1.3. Écrire l’équation de la transformation nucléaire du noyau issu de la désintégration du nickel 56.
Préciser de quels types de radioactivité il s’agit.
1.4. On considère que l’atome de fer est au repos à sa formation. Calculer l’énergie libérée puis l’énergie
de chacun des produits de la désintégration nucléaire écrite en 1.3.
9
10
EXERCICE III : Supernova
Courbe 1
Nombre de photons γ détectés par Ginga par heure d'observation
et par mètre carré
Milliers de photons
Feuille annexe à rendre avec la
copie
EXERCICE I : Les indicateurs colorés naturels de la cuisine à la chimie
4,5
4,0
3,5
3,0
2,5
2,0
1,5
1,0
0,5
0,0
40
t1 =90
140
190
240
Date (jours après l'apparition de la supernova)
TABLEAU
Artichaut
VB = 9,8 mL
VB = 10,1 mL
Betterave
VB = 9,8 mL
VB = 10,1 mL
[A - ]eq
[HA]eq
Couleur
11
12
Durée de l’épreuve : 3h
Examen Blanc-n°1
Coefficient : 7
La figure (2) donne les courbes pH =f(VB) et
2023/2022
Matière : Physique Chimie
Classe : 2ème bac SP
=g(VB) obtenues lors de ce dosage.
Prof : Anass El Badaoui
Chimie : (7pts)
L’ibuprofène est une molécule de formule brute C13H18O2 . Elle constitue le principe actif de
divers médicaments de la classe des anti-inflammatoires.
Cette partie vise :
- L'étude d'une solution aqueuse d'ibuprofène ;
figure (1)
- Le titrage d'une solution aqueuse d'ibuprofène ;
figure (2)
Données :
-
M(C13H18O2) = 206g mol-1 ; Ke=10-14 .
2-1/ Nommer les éléments du dispositif expérimental numérotés 1,2 ,3 et 4 sur la
- L’étiquette d’un médicament fournit l'information "Ibuprofène…. 400 mg " ;
figure (1).
1) Etude d’une solution aqueuse d’ibuprofène :
2-2/ Parmi les courbes (1) et (2) de la figure (2), quelle est celle qui représente
-2
-1
Le pH d’une solution aqueuse d’ibuprofène de concentration molaire C=5.10 mol L vaut
pH =2,7 à 25°C .
1-1/ Ecrire l'équation de la réaction modélisant la transformation entre l’ibuprofène et
l'eau .
=g(VB) ?
(0,25)
2-3/ Écrire l’équation de la réaction qui a eu lieu lors du dosage .
(0,5)
2-4/ Déterminer graphiquement la valeur du volume VBE , versé à l'équivalence.
(0,5)
1-2/ Montrer que cette transformation est limitée.
Déduire la valeur de la quantité de matière nA d'ibuprofène dans la solution (S). ( 0,75)
(0,75)
1-3/ Calculer la valeur du quotient de réaction Qr,éq ,du système chimique à l’équilibre.
En déduire la valeur du pKA du couple C13H18O2 / C13H17O2-. (0,75)
- On dissout un comprimé contenant l’ibuprofène selon un protocole bien défini afin
d'obtenir une solution aqueuse (S) d’ibuprofène de volume VS =100 mL.
- Pour vérifier, la masse d’ibuprofène contenu dans ce comprimé, on procède à un
titrage acido-basique du volume VS par une solution aqueuse d’hydroxyde de sodium
-
2-5/ Déduire la valeur de la masse m d’ibuprofène dans le comprimé et la comparer à
celle indiquée sur l'étiquette du médicament .
(0,75)
2-6/ Pour un volume VB=6mL (VB < VBE ) :
2) Titrage d’une solution aqueuse d’ibuprofène
+
(0,5)
2-6-1/ Trouver l’expression du taux d’avancement τ de la réaction du dosage.
calculer sa valeur . conclure .
2-6-2/ Calculer le rapport
(0,75)
[
]
[
]
, déduire l’espèce prédominante . (0,75)
2-6-3/ Trouver l’expression de pH en fonction de VBE ,VB et pKA .puis montrer
-1
(Na (aq)+ HO (aq)) de concentration molaire CB =0 ,194 mol.L , en utilisant le dispositif
dans le cas où VB =
que pH = pKA .
(0,75)
expérimental de la figure (1).
Page 1 sur 7
prof : El Badaoui Anass
Page 2 sur 7
prof : El Badaoui Anass
Physique 2 : Electricité
Physique 1 : ondes
( 5,5pts)
(2 ,5pts)
- On réalise l'expérience schématisée ci-dessous, où HP est l'émetteur ultrasonore ,et M1
et M2 des récepteurs ultrasonores se trouvent sur la même droite . (voir figure -1).
- Les ondes sonores reçues par M1 et M2 sont visualisés sur l'écran d'un oscilloscope.
- Lorsque les deux récepteurs sont sur la même abscisse x=0 les signaux visualisés sur
l'écran de l'oscilloscope sont en phase (figure -2) .
- On fixe la position de récepteur M1 à x =0 et on translate le récepteur M2 vers la droite,
on observe sur l'écran que les signaux sont en phase pour la deuxième fois quand
l'abscisse de récepteur M2 est d =2,8m .
On se propose, dans la partie I de cet exercice, de déterminer les grandeurs caractéristiques des
éléments d’un circuit électrique, en étudiant la charge d’un condensateur et sa décharge à travers une
bobine. Dans la partie II, on étudiera un signal modulé en amplitude.
PartieI : Réponse d’un dipôle RC à un échelon de tension ascendant et étude d’un dipôle RLC
1-Réponse d’un dipôle RC à un échelon de tension ascendant
On réalise le montage représenté sur la figure-1 comportant :
- un générateur idéal de tension de f.e.m. E ;
- un condensateur de capacité C variable initialement déchargé ;
- un conducteur ohmique de résistance R ;
- un conducteur ohmique de résistance R1 ;
- une bobine d’inductance L=0,1H et de résistance négligeable ;
- un interrupteur K.
1-1/ On ajuste la capacité du condensateur sur une valeur C et on place l’interrupteur,
à la date t=0, en position (1) .
1-1-1/ Etablir l’équation différentielle vérifiée par l’intensité du courant i(t) . (0, 5)
1-1-2/ La solution de cette équation différentielle s’écrit sous la forme :
HP
i(t) =A .
avec A une constante et τ la constante de temps du dipôle RC.
Trouver l’expression de A et celle de τ .
(0, 5)
1-2/ Les courbes (a) et (b) de la figure-2 représentent l’évolution de l’intensité i(t) du
courant lorsqu’on ajuste la capacité du condensateur sur une valeur C1 puis sur
une valeur C2 avec C1 < C2 .
Sh=1ms/div
fig 1
1) Définir la longueur d'onde mécanique λ .et Calculer sa valeur .
1-2-1/ Indiquer la courbe correspondant à chaque capacité . justifier .
(0, 5)
2) Calculer Vair , la vitesse de propagation de l'onde sonore dans l'air.
1-2-2/ Montrer que i=2,2mA pour t = τ .
(0, 5)
(0,75)
1-2-3/ La capacité du condensateur équivalent à un condensateur de capacité C1
monté en parallèle avec un condensateur de capacité C2 est Ce =10μF . Montrer
que C1= 4μF . (0, 5)
3) La vitesse de la propagation du son dans l'air s'écrit sous la forme : V=V0 .√
avec : V0 =331,5 m.s-1 la vitesse de la propagation du son dans l'air à 0°c .
1-2-4/ Déterminer la valeur de R et celle de E.
t° s’exprime en °c .
3-1/ Calculer la température T de l'expérience .
(0, 5)
(0, 5)
(0, 5)
3-2/ On fixe la valeur de la fréquence N, Comment varie la longueur d'onde quand on
augmente la température? Justifier .
Page 3 sur 7
(0,75)
prof : El Badaoui Anass
Page 4 sur 7
prof : El Badaoui Anass
2- Décharge du condensateur dans une bobine :
Après avoir chargé complètement le condensateur de capacité C1, on bascule à un instant t
(qu’on prendra comme nouvelle origine des dates t=0) l’interrupteur K en position (2). La
courbe de la figure-3 représente l’évolution, au cours du temps, de la tension uR1(t) aux
bornes du conducteur ohmique de résistance R1. (T) représente la tangente à la courbe
à l’instant t=0.
2-1- Etablir l’équation différentielle vérifiée par uR1 (t) . (0, 5)
2-2-Trouver la valeur de R1.
(0, 5)
Partie II : Etude d’un signal modulé en amplitude
Afin d’obtenir un signal modulé en amplitude, on utilise un circuit intégré multiplieur X de
constante caractéristique k =0,1V-1 (fig.4). On applique sur l’entrée E1 du multiplieur X une
tension sinusoïdale U1(t) = Pmcos(
et sur l’entrée E2 une tension U2(t)=U0+S(t) avec U0
la tension de décalage et S(t) = Smcos(
la tension modulante qu’on veut transmettre .
la tension de sortie Us(t) est : Us(t)=k.U1(t).U2(t)
On visualise la tension s(t) sur l’entrée X de l’oscilloscope
et la tension de sortie us(t) sur l’entrée Y, et on élimine
la base de temps (mode XY). On obtient ainsi
Figure 4
l’oscillogramme de la figure-5 représentant us(t)
en fonction de s(t) .
Les deux parties sont indépendantes l’une de l’autre
Partie I : Pourquoi Pluton n'est plus une planète ?
(3pts)
La planète Pluton, découverte en 1930 était considérée comme la neuvième planète du
système solaire. Le 05/01/ 2005, une équipe d'astronomes a découvert sur des photographies
prises en 2003 un nouveau corps gravite autour du Soleil sur une orbite elliptique qu'elle a
nommé «Éris» et non classé comme planète. La découverte d'Éris et d'autres astres
similaires a été le début de nombreuses discussions entre scientifiques sur la définition même
du mot «planète ». En 2006, au cours d'une assemblée, l'union astronomique internationale
a décidé de déclasser Pluton .
Données :
L'une des conditions de considérer un astre comme une planète est d'être plus massif.
Éris possède un satellite naturel nommé «Dysnomia » (D).
(D)
La Période de révolution de Pluton: Tp = 248 ans.
(E)
Période de révolution d'Éris: TE =557 ans.
22
⃗1
𝒖
Masse de Pluton : MP = 1,31.10 kg .
ME et MD sont les masses respectives d'Éris et de Dysnomia.
Rayon de l'orbite circulaire de Dysnomia : R D=3,60.107 m.
Période de révolution de Dysnomia: TD=15 jours = 1,3.106 s.
Constante de gravitation universelle : G = 6, 67.10- 11 m3.kg- 1.s- 2 .
On étudiera le mouvement supposé circulaire uniforme de Dysnomia (considéré comme
corps ponctuel) autour d'Éris dans le référentiel lié au centre d'Éris et dont les axes sont
dirigés vers des étoiles fixes.
1) En justifiant la réponse, choisir parmi les schémas ci-dessous, celui qui correspond à
un mouvement circulaire accéléré puis celui qui correspond à un mouvement circulaire
uniforme. Sur chaque schéma, les vecteurs vitesse et accélération sont représentés en
un point de la trajectoire de «Dysnomia ».
⃗
𝒂
(A )
1) Déterminer graphiquement le taux de
⃗
𝑽
⃗
𝒂
(B )
⃗𝑽
⃗𝑽
⃗
𝒂
(C )
2) Enoncer la troisième loi de Kepler, relative à la période de révolution T d'une planète
modulation m. (0, 5)
autour du Soleil, dans le cas d'une orbite elliptique de demi grand axe a .
2) Déduire la qualité de cette modulation . (0, 5)
(0, 5)
3) L'orbite d' Éris se situe -t-elle au-delà ou en-deçà de celle de Pluton? justifier par un
calcul.
(0, 5)
4) Exprimer en fonction des paramètres de l'énoncé et du vecteur unitaire ⃗ 1 , le vecteur
accélération ⃗ D de « Dysnomia » .
(0, 5)
3) Déterminer les valeurs des tensions U0 et Pm.
(0, 5)
Page 5 sur 7
Physique 3 : Mécanique (5pts)
prof : El Badaoui Anass
Page 6 sur 7
prof : El Badaoui Anass
5) Montrer que la période de révolution TD de « Dysnomia » a pour expression :
√
(0, 5)
6) En déduire la valeur de la masse ME d'Éris.
(0, 5)
Durée de l’épreuve : 3h
Examen Blanc n°11
Coefficient : 7
Date de l’épreuve :
2023
Matière: Physique Chimie
Classe : 2ème bac SP
7) Calculer le rapport des masses d'Éris et de Pluton. Expliquer alors pourquoi la
Réalisé par Professeur :
Anass El Badaoui
Chimie : (7pts)
découverte d'Éris a remis en cause le statut de planète pour Pluton. (0, 5)
Partie II : mouvement de rotation d’un solide autour d’un axe fixe . (2,5pts)
- On modélise un levier de charge par une poulie (P) homogène de rayon r=20cm
pouvant tourner autour d’un axe horizontal (Δ) fixe qui coïncide avec son axe de
symétrie, et un solide (S) de masse m =50kg lié à la poulie par une corde inextensible,
de masse négligeable et ne glisse pas sur la gorge de la poulie.
- Pour lever le solide (S) un moteur exerce sur la poulie un couple moteur de moment
M=105 N. m . On repère la position du centre d'inertie G de (S) à l'instant t par sa
coordonnée z dans le repère (Oz) lié à la terre supposé galiléen.
- A l'instant t0 = 0s le centre d'inertie G part de O sans vitesse initiale.
Données :
Z
- On néglige toute sorte de frottement.
(P)
- JΔ : le moment d'inertie de (P) par rapport à l'axe (Δ).
- g=10 m.s-2 .
(S)
1) En appliquant la 2ème loi de Newton et la relation
O
fondamentale de la dynamique en cas de rotation,
montrer que l'expression de l'accélération de (G) est :
(0, 5)
2) Une étude expérimentale a montré que l'équation horaire du mouvement de G est :
z = 0,2 t2 ; Déterminer la valeur de JΔ .
(0, 5)
3) Après n =8trs on arrête le moteur qui applique le couple moteur sur la poulie.
3-1/ Déterminer la nature du mouvement de (S) et de (P) .
(0,5)
3-2/ Déterminer l'équation horaire du mouvement de (S) .(on choisira l'origine des
temps l'instant d'arrêt du moteur).
Page 7 sur 7
(0, 5)
prof : El Badaoui Anass
Page 1 sur 6
prof : El Badaoui Anass
Physique 1 : (2,5pts)
Physique 2 : électricité
(4,5pts)
Partie 1 :
Page 2 sur 6
prof : El Badaoui Anass
Page 3 sur 6
prof : El Badaoui Anass
Physique 3 : Mécanique
(6pts)
Partie 1 :
Partie 2 :
Partie 2 :
Page 4 sur 6
prof : El Badaoui Anass
Page 5 sur 6
prof : El Badaoui Anass
Page 6 sur 6
prof : El Badaoui Anass
page
7
1
1 امتحان وطني تجر يبي رقم
للبكالور يا
المسالك الدولية
2023 الدورة العادية
- الموضوع-
3
مدة الإنجاز
7
المعامل
المادة
الفيز ياء و ال�كيمياء
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية
الشعبة أو المسلك
INSTRUCTIONS GENERALES
• L’utilisation de la calculatrice non programmable est autorisée ;
• Le candidat peut traiter les exercices de l’épreuve suivant l’ordre qui lui convient ;
• L’utilisation de la couleur rouge lors de la rédaction des solutions est à éviter.
COMPOSANTES DU SUJET
L’épreuve est composée de quatre exercices indépendants entre eux et répartis suivant les domaines comme
suit :
Exercice 1
Chimie
7 points
Exercice 2
Ondes et Nucléaire
3 points
Exercice 3
Electricite
4.75 points
Exercice 4
Mecanique
5.25points
1
aebc
Prof.Zakaryae Chriki
Exercice 1
Chimie
7 points
Les deux parties sont indépendantes
Partie I : Etude de quelques réactions d’un acide
1-La mesure du pH d’une solution aqueuse S0 d’un acide AH, de volume V0 , et de concentration molaire
C0 2, 0.10 2 mol.L1 donne : pH = 3,25.
1-1- Dresser le tableau d’avancement de la réaction de AH avec l’eau.
1-2- Définir le taux d’avancement final de la réaction. Calculer sa valeur.
1-3- Déterminer la constante d’acidité K A du couple AH(aq) / A(aq)
.
2 -Une autre solution aqueuse S de cet acide, de concentration C a été préparée par dissolution d’une masse
m 1,5g de l’acide AH dans un volume V 250 mL d’eau pure. On en prélève un volume Va 15 mL que l’on
HO(aq)
de concentration
titre, par dosage pH-métrique, avec une solution d’hydroxyde de sodium Na (aq)
molaire Cb 0,10 mol.L1 . Un logiciel de traitement de données approprié permet de tracer la courbe
représentant pH f (Vb ) avec Vb le volume versé d’hydroxyde de sodium et la courbe
dpH
f (Vb ) .(figure ci-contre)
dVb
pH ;
2-1- Faire le schéma annoté du dispositif permettant de
réaliser ce dosage.
2-2 -Déterminer, graphiquement, le volume Vbe
dpH
dVb
d’hydroxyde de sodium versé à l’équivalence.
2-3- Déterminer la concentration C de
Vb (mL)
la solution S.
2-4- Déterminer la masse molaire M(AH) de l’acide
0
3
AH.
Partie II : Etude d’une pile
/ /Ag (aq)
/ Ag(s) () .
On réalise la pile représentée par le schéma conventionnel suivant: ()Ag (s) / Ag (aq)
Le pôle positif de la pile est constitué d’une lame d’argent plongée dans une solution de nitrate d’argent de
concentration C1 0,10 mol.L1 et de volume V 20 mL .
Le pôle négatif de la pile est constitué d’une lame d’argent plongée dans une solution de nitrate d’argent de
concentration C 2 1, 0.10 3 mol.L1 et de volume V 20 mL .
1- Ecrire l'équation de la réaction qui se produit au niveau de l’anode lors du fonctionnement de la pile.
2-Calculer le quotient de réaction initial Q r i.
3-Déterminer l’avancement final de la réaction sachant que le quotient de réaction à l’équilibre
est Qr,éq 1 .
Partie II : Etude d’une pile
L’oléine est un corps gras constituant majoritaire de l’huile d’olive , c’est un triglycéride qui peut
être obtenu par la réaction du glycérol avec l’acide oléique .
Pour préparer le savon , on chauffe à reflux , une fiole contenant une masse m 10,0g d’huile
d’olive(oléine ) et un volume V 20mL d’une solution d’hydroxyde de sodium de concentration
C 7,5mol.L1 et un volume V 10mL de l’éthanol et des pierres ponce .On chauffe le mélange
réactionnel pendant 30min puis on le verse dans une solution saturée de chlorure de sodium .Après
agitation et refroidissement du mélange , on sèche le solide obtenu et on mesure sa masse , on
2
aebc
Prof.Zakaryae Chriki
trouve alors m 8,0g .
Données : glycérol
: CH2OH CHOH CH2OH ;
Acide oléique : C17 H33 COOH
Masses molaires en g.mol1 :
Composé
oléine
savon
Masse molaire en g.mol-1
M(O)=884
M(S)=304
1- Expliquer pourquoi on verse le mélange réactionnel dans une solution saturée de chlorure de
sodium.
2- Ecrire l’equation de la reaction du glycerol avec l’acide oleique .Préciser la formule semidéveloppée de l’oléine .
3- Ecrire l’équation de la réaction de saponification et déterminer la formule chimique du savon en
précisant la partie hydrophile de ce produit.
4- On suppose que l’huile d’olive n’ est constitué que d’oléine. Montrer que l’expression du
m M (O)
rendement de la réaction du saponification s’écrit sous la forme r
.Calculer r .
.
3m M ( S )
Exercice 2
Ondes et Nucléaire
3 points
Partie I :Ondes
Propagation d’une onde le long d’un ressort
On crée par compression de spires, à l’instant t 0 , une onde périodique sinusoïdale à l’extrémité S d’un
ressort à spires non jointives, considéré infiniment long ( figure 1).
x
La courbe de la figure 2 représente l’élongation x M (t) d’un point M
du ressort.
Figure 1
1- L’onde qui se propage le long du ressort est-elle une onde transversale ou longitudinale ? Justifier.(0,5 pt)
2- Déterminer graphiquement la période T du mouvement
xM
de M .
t(ms)
3- Déterminer la célérité v de l’onde sachant que le point M
0
60
20 40
se trouve à la distance d 80 cm de l’extrémité S du
Figure 2
ressort.
4-Déterminer la longueur d’onde de cette onde.
Partie II :Transformations nucléaires Désintégration du radon 222
Le radon 222 ( 222
86 Rn) est un élément radioactif émetteur α .
La courbe de la figure ci-contre représente l’évolution temporelle du nombre N de noyaux d’un échantillon de
radon 222.
N(x109 )
1-Déterminer la composition du noyau de
radon 222.
2-L’équation de désintégration radioactive
du radon 222 s’écrit :
222
86
Rn x4 He 84y Po .
Déterminer la valeur de x et celle de
y.
3- En exploitant la courbe de la figure
ci-contre, déterminer la constante
radioactive du radon 222.
2
1
t(jour)
0
4-Déterminer l’activité a de l’échantillon à
l’instant t 6 jours .
1
3
2
aebc
Prof.Zakaryae Chriki
Exercice 3
Electricite
4.75 points
Partie I: On réalise le circuit de la figure 1 constitué :
- d’un générateur idéal de force électromotrice E,
- d’un interrupteur K à deux positions,
- d’un condensateur de capacité C non chargé initialement,
- d’une bobine de résistance r et d’inductance L 0,8H .
(1)
électronique X une tension sinusoïdale u2 ( t ) U 0 S( t )
avec U 0 la composante continue de la tension et
(2)
2 .t
S( t ) Sm .cos
la tension correspondante
Ts
K
i
C
E
1-On place l’interrupteur K en position (1).Quel est le
phénomène physique qui se produit ? Est-il lent ou
instantané? Justifier.(0,5 pt)
2-On bascule, à un instant t = 0 , l’interrupteur en position (2).
(L, r)
uc
20
(On prend π =10 ).
40
3- Les courbes de la figure 3 représentent l’évolution temporelle de
E e l’énergie emmagasinée dans le condensateur et de E m l’énergie
emmagasinée dans la bobine.
3-1- Identifier en justifiant la courbe correspondant à
l’énergie E m .
Interpréter ce résultat.
Energies(10 J)
Exercice 4
c2
16
0
c1
20
3
C0
D
S
C
L
partie 1
R
C
partie 2
R
0
partie 3
M
5.25points
On considère le montage représenté dans la figure 1 ;
X
ئئ
S
E2
u2(t)
A
z
O
( )
F
d’inertie J par rapport à un axe ( ) horizontal passant par son centre O. La
1
E1
u1(t)
Mecanique
poulie est solidaire d’un bras de masse négligeable et de longueur
OA 0, 40 m (figure1).
Cet exercice vise à étudier la modulation et la de demodulation.
4
t( 5, 4.103 s )
.
un ouvrier utilise une poulie homogène de rayon r 10cm et de moment
Figure 3
1 - Modulation
2 .t
électronique X une tension sinusoïdale u1( t ) Pm .cos
Tp
- Le générateur GBF 2 applique à l’entrée E2 de la composante
1,5
On prend l’intensité de la pesanteur g =10m.s-2 et on néglige les frottements.
Pour soulever un corps solide (S) de centre d’inertie G et de masse m 50 kg ,
Les ondes sonores audibles ont une faible fréquence , leur transmission à des longues distances nécessite
qu’elles soient modulante à une onde électromagnétique de haute fréquence.
- Le générateur GBF 1 applique à l’entrée E1 de la composante
0,5
Partie I : Mouvement d’un système mécanique
t(ms)
10
- 0,3
4-Déterminer la valeur du produit L.C pour que la sélection de l’onde soient bonne.
5-Montrer que l’intervalle auquel doit appartenir la valeur de la résistance R pour une bonne
4 2 L.Ts
4 2 L
Détection de l’enveloppe de la tension modulante dans ce montage est :
R
Tp
Tp2
6- Calculer les bornes de cet intervalle sachant que L 1,5mH .
Figure 2
8
Partie II:
2 t 2 t
cos
Ts Tp
3-Préciser le rôle de la partie 3 dans ce montage.
5
3-2-Trouver la variation d’énergie totale E du
circuit entre les deux instants t 0 et t 50 ms .
- 0,2
2 - Démodulation
La figure 3 représente le montage utilisé
dans un dispositif de réception constitué de trois parties.
0
2
1
- 0,1
2- En exploitant la courbe de la figure 2 :
a.Trouver les fréquences Fp de la porteuse
et fs de la tension modulante.
b.Déterminer le taux de modulation et en
déduire la qualité de modulation.
t(ms)
l’oscillateur LC, déterminer la capacité C du condensateur.
0
et préciser l’expression de A et celle de m .
u C (V)
2-4- Déterminer graphiquement la pseudopériode T des
oscillations.
2-5-En assimilant la pseudopériode T à la période propre T0 de
0,3
sous la forme : us ( t ) A 1 m cos
bornes du condensateur(Figure 2) .
2-1- Recopier le schéma de la figure 1 et y indiquer le branchement du système d’acquisition pour visualiser
la tension u C (t) ( le branchement du système d’acquisition est analogue à celui de l’oscilloscope).
2
0,1
positive caractérisant la composante X , fig 1
1-Montrer que l’expression de la de la tension S’écrit
Un système d’acquisition informatisé adéquat a permis d’obtenir la courbe d’évolution de la tension u C (t) aux
us V
0,2
à l’onde qu’on désire transmettre.
On visualise sur l’écran d’un oscilloscope la tension
de sortie us t k.u1( t ).u2 ( t ) avec k constante
Figure 1
2-2- Donner le nom du régime des oscillations observées.
2-3- Expliquer la diminution de l’amplitude des oscillations au cours du temps.
aebc
Prof.Zakaryae Chriki
uS(t)
ئ
Le corps (S) est attaché à l’extrémité d’une corde inextensible et de masse
négligeable enroulée sur la gorge de la poulie (figure1).
k
G (S)
Au cours du mouvement, la corde ne glisse pas sur la gorge de la poulie.
O'
Figure 1
L’ouvrier applique sur le bras OA, au point A, une force F perpendiculaire à
OA et d’intensité constante F 165 N .
La poulie est susceptible de tourner sans frottement autour de ( ) .
On étudie le mouvement du système mécanique dans un repère lié à un référentiel terrestre supposé galiléen.
5
aebc
Prof.Zakaryae Chriki
L’accélération du mouvement de G au cours de la montée de (S) est constante et sa valeur est : a G 3m.s 2 .
1- Quelle est la nature du mouvement de G ? Justifier votre réponse. (0,75pt)
2- Montrer, en appliquant la deuxième loi de Newton sur le solide (S), que l’intensité de la tension de la corde
est T 650 N . (0,75pt)
3- Donner la relation entre l’accélération linéaire a G et l’accélération angulaire θ et r. (0,25pt)
4- En appliquant la relation fondamentale de la dynamique dans le cas de la rotation sur le système en
r(F. T.r)
. Calculer sa valeur.(1pt)
rotation, montrer que l’expression de J est : J
aG
Partie II :Mouvement d’un oscillateur mécanique
On étudie dans cette partie les oscillations d’un système mécanique
(corps solide – ressort) dans deux situations :
- tous les frottements sont négligeables,
- les frottements fluides ne sont pas négligeables.
L’oscillateur mécanique étudié est constitué d’un solide (S) de centre
(S)
i
Figure3
O
G
x
d’inertie G et de masse m = 200g et d’un ressort à spires non jointives, de masse négligeable et de
raideur K .
Le ressort est horizontal, une de ses extrémités est fixée à un support et l’autre extrémité est accrochée
au solide (S) . Ce solide peut glisser sur le plan horizontal.
On étudie le mouvement du centre d’inertie G dans un repère R(O,i) lié à un référentiel terrestre
considéré galiléen.
On repère la position du centre d’inertie G , à un instant t, par l’abscisse x sur l’axe (O,i) .
A l'équilibre, l’abscisse du centre d’inertie G est x 0 (figure 3).
On prendra 2 10 .
Situation 1 : Tous les frottements sont négligeables
Dans cette situation on écarte (S) de sa position d’équilibre, dans le sens positif, et on l’envoie à un
instant de date t=0 avec une vitesse initiale V 0
v x (m.s 1 )
0,8
telle que V0 V0 i .
La courbe de la figure 4 représente l’évolution
0,4
au cours du temps de la vitesse v x du centre
t(s)
d’inertie G .
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
1-1- Etablir, en appliquant la deuxième loi de
Newton, l’équation différentielle vérifiée par
l’abscisse x(t) .(0,25pt)
1-2- Calculer la constante de raideur K. (0,5pt)
Figure 4
1-3- La solution de l’équation différentielle
2
s’écrit sous la forme : x(t) x m cos
t . Trouver la valeur de x m et celle de . (0,5pt)
T0
6
aebc
Prof.Zakaryae Chriki
On repère, à un instant t, la position d’un point de la poulie par son abscisse angulaire et la position du
centre d’inertie G par sa côte z dans le repère (O ' ; k) .
Situation 2 : Les frottements fluides ne sont pas négligeables
Les frottements fluides sont
crées, au cours du mouvement,
x
par une plaque, de masse
négligeable, liée au solide (S) .
Dans cette situation on écarte
(S) de sa position d’équilibre
dans le sens positif et on le
0
0,1
0,2
0,3
0,4
lâche à l’instant de date t 0
sans vitesse initiale.
La courbe de la figure 5
Figure 5
représente les variations de
l’abscisse x du centre d’inertie G du solide (S) en fonction du temps.
2-1- Justifier la diminution de l’amplitude des oscillations.
2-2- Vérifier, en décrivant la méthode utilisée, que l’amortissement des oscillations est un
amortissement fluide.
2-3-Donner le nombre d’affirmations justes parmi les affirmations suivantes :
a-La pseudo-période des oscillations est T 0,5s .
b- Les oscillations observées sont des oscillations forcées.
c- Les oscillations observées sont des oscillations libres.
d-Les oscillations observées sont des oscillations apériodiques.
7
t(s)
Niveau : 2BAC SMA
Physique chimie
09-Juin- 2022
Examen Blanc
Lycée Zineb ennafzaouia
-Sidi Slimane –
Pr. A.ROCHDI
Chimie (7pts) :
Le but de cet exercice est d'étudier la réaction de l'acide méthanoïque avec l'eau , avec l'hydroxyde de sodium,
avec ions éthanoate et avec le propan -1-ol.
Partie I (5,5pts) : Étude de la réaction d’acide méthanoïque :
Sujet
1-Réaction d'acide méthanoïque avec l’eau :
On donne K e = 10−14
Soit une solution aqueuse ( S1 ) d’acide méthanoïque de volume V1 et de concentration C1 = 10 −2 mo.L−1 .La mesure
du pH de cette solution à 25 °C donne pH = 2,9 .
On modélise la transformation chimique qui a lieu entre l’acide méthanoïque et l’eau par l’équation chimique suivante
:
HCOOH ( aq ) + H 2 O( ) ⎯
⎯→ HCOO(−aq ) + H 3O(+aq )
❖ L’usage de la calculatrice scientifique non programmable est autorisé.
❖ La formule littérale doit être donnée avant l’application numérique et
le résultat accompagné de son unité.
❖ Les exercices peuvent être traités séparément selon le choix du candidat(e).
❖ Le sujet comporte 5 exercices : un exercice de chimie et quatres exercices de
physique.
0,25
0, 5
0,25
1-1) Calculer le taux d’avancement final 1 et conclure.
1-2) Exprimer K la constante d’équilibre associée à l’équation de la réaction étudiée en fonction de C1 et 1 .
1-3) Vérifier que la valeur de la constante d’acidité pK A1 du couple HCOOH ( aq ) / HCOO(−aq ) est : pK A1 3,8 .
1-4) On prend un volume de la solution ( S1 ) et on y ajoute une quantité d’eau distillée pour obtenir une solution ( S 2 )
0, 5
de concentration C 2 = 10−3 mo.L−1 . Calculer dans ce cas le taux d’avancement final 2 de la réaction entre l’acide
méthanoïque et l’eau. Conclure.
2- Réaction d'acide méthanoïque avec hydroxyde de sodium (Dosage) :
Pour vérifier la valeur de la concentration molaire C1 de l'acide méthanoïque, on dose un volume Va = 10mL de la
+
−
solution précédente ( S1 ) par une solution (S B ) d'hydroxyde de sodium ( Na aq + HOaq ) de concentration molaire
Chimie (7 points)
C B = 10−2 mo.L−1 .
-Partie I : Étude de la réaction d’acide méthanoïque
(5,5 points)
-Partie II : La production de dihydrogène par électrolyse
(1,5 points)
0,25
2-1) Ecrire l’équation chimique modélisant ce dosage.
La courbe de la ci-contre représente les variations pH = f (VB ) et dpH = g (VB ) du mélange. On atteint
dVB
l’équivalence lorsqu’on ajoute le volume V BE de la solution S B .
2-2) Retrouver C1 .
2-3) En utilisant la valeur du correspondant à l’addition de 5mL
0, 5
Physique (13 points)
d’hydroxyde de sodium, montrer que le taux d’avancement de
Physique 1: Les transformations nucléaires :Explosion de Tchernobyl
(1,75 points)
Physique 2: Détermination de la longueur d’onde d'une onde lumineuse
(2 points)
la réaction du dosage à pour formule :
0,75
= 1−
(Va + Vb )
.10 pH − pKe . Calculer sa valeur.
Cb .Vb
3-Réaction
d’acide méthanoïque Avec les ions
éthanoate :
On mélange un volume V1 = 10mL d’une solution aqueuse
Physique 3 : Electricité
-Partie I: Étude des oscillations électriques libres amorties
(2pts)
-Partie II : Oscillations forcées dans un circuit RLC en Régime sinusoïdal
(2,25pts)
d’acide méthanoïque HCOOH deconcentration C = 10 −2 mo.L−1
et un volume V2 = 90mL d’une solution aqueuse d’éthanoate de sodium de méme concentration C .
On modélise la transformation qui a eu lieu par une réaction chimique d’équation :
Physique 4 : Mécanique :
HCOOH ( aq ) + CH 3COO − ( aq ) ⎯
⎯→ HCOO(−aq ) + CH 3COOH ( aq ) .
-Partie I : Étude du mouvement d’un skieur
(2pts)
-Partie II : Étude d’un système oscillant
(3pts)
On exprime la conductivité du mélange
réactionnel à un instant t en fonction de l’avancement x de la réaction par la relation = 81,9 + 1,37.10 4.x : avec
en mS .m −1 et x en mol .
1) On mesure la conductivité du mélange réactionnel à l’équilibre, on trouve : éq = 83,254mS .m .
−1
0,5
3-1) Vérifier que la valeur de la constante d’équilibre K associée à l’équation de la réaction K 10 .
0,25
3-2) En déduire la valeur de la constante d’acidité K A 2 du couple CH 3COOH ( aq ) / CH 3COO(−aq )
3-3) Calculer le pH du mélange à l’équilibre. En déduire les deux espèces chimiques prédominants dans
0,75
le mélange à l’équilibre parmi les espèces chimiques suivants :
1
HCOOH ( aq ) ; HCOO(−aq ) .
2
CH 3COOH ( aq ) ; CH 3COO(−aq )
4-Réaction d'acide méthanoïque avec le propan -1-ol
0,25
On étudie dans cette partie la réaction de l’acide méthanoïque avec le propan -1-ol C3 H 7 − OH .
On donne la masse molaire : M ( HCOOH ) = 46g.mol
−1
5)
Déduire a 0 l’activité de cet échantillon d’iode au moment d’explosion en Bq .
6)
Le nuage radioactif de l’iode à touché la France àprés un périple de 300km . A son arrivée en France, l’activité
0,5
du nuage à éte mesurée. Elle valait a = 2.10
18
En chauffant, à reflux, à une température constante, un mélange (S) contenant n0 = 0,2mol d’acide méthanoïque et
0,5
0,5
Bq .
n0 = 0,2mol de propan-1-ol, on obtient un composé organique et de l’eau. On choisit l’instant du début de la réaction
comme origine des dates (t = 0) .
Combien du temps à mis le nuage pour atteindre la France ?
4-1) Ecrire, en utilisant les formules semi-développées, l’équation chimique modélisant la réaction
qui a lieu. Donner le nom du composé organique formé
4-2) A un instant de date t1 , la masse de l’acide méthanoïque restant est m = 6,9 g . Sachant que le rendement de
Physique 2 : Détermination de la longueur d'onde d'une onde lumineuse (2 pts)
**********************************************************************************************
L’étude du phénomène de diffraction de la lumière permet de déterminer la longueur d'onde des ondes
cette réaction est r = 67 0 0 . Montrer que l’état d’équilibre n’est pas encore atteint à cet instant.
lumineuses.
On envoie une lumière monochromatique de longueur d’onde dans l’air provenant d’un laser, perpendiculairement
Partie 2: La production de dihydrogène par électrolyse (1,5pts)
La production de dihydrogène en vue d’une utilisation énergétique semble avoir de l’avenir, que ce soit avec les piles à
combustibles ou les moteurs à combustion interne. Ainsi le dihydrogène peut être produit par électrolyse.
Dans l’industrie pour la production de dihydrogène on utilise l’eau acidifiée et deux électrodes en graphite (cathode et
anode). Un générateur de tension continue maintient une tension de l’ordre de 2V permettant d’avoir une intensité du
courant électrique de plusieurs kiloampères.
sur un fil fin de diamètre d connu. On observe le phénomène de diffraction sur un écran distant de la distance D du
fil.
On mesure la largeur L de la frange centrale et on déduit la valeur de l’écart angulaire entre le milieu de la frange
centrale et la 1ère extinction (Figure 1). On répète les mêmes mesures pour d’autres fils.
L’équation bilan de la réaction qui a lieu est : 2H 2 O(l ) ⎯
⎯→ 2H 2 ( g ) + O2 ( g ) .
0,25
0,25
0,25
0, 75
1)
La réaction qui a lieu dans l’électrolyseur est-elle une réaction spontanée
? Justifier votre réponse.
2) Les couples d’oxydoréduction qui participent à l’électrolyse sont
O2 ( g ) / H 2 O( l ) et H + ( aq ) / H 2 ( g ) . Écrire la demi-équation électronique
correspondant à la formation du dihydrogène.
3) À quelle électrode se dégage le dihydrogène : cathode ou anode ? Justifier
votre réponse.
4) À l’instant t 0 = 0 , on démarre l’électrolyse. L’intensité du courant qui
circule dans l’élyctrolyseur est constante est égale I = 10kA .
Sachant que le rendement de la réaction qui produit le dihydrogène est r = 80 0 0 . Calculer V ( H 2 ) le volume
d’hydrogéne obtenu expérimentalement pendant une heure de fonctionnement
l’élyctrolyseur.
Données : Dans les conditions de l’électrolyse : Vm = 25L.mol
−1
t = t − t 0 = 1h de
; F = 96500C .mol
Figure 1
−1
Donneés :
La vitesse de propagation d’une onde lumineuse dans l’air égale à C 3,00.108 ms −1
****************************************************************************************
Physique 1 : Les transformations nucléaires :
La constante de planck h = 6,62.10
Explosion de Tchernobyl (1,75 pts)
Le 26 avril, un accident à la centrale nucléaire de Tchernobyl (ukranie) provoque une explosion d’un des
réacteurs. Une très grande quantité de radioéléments sont libéré dans l’atmosphére. Ce nuage radioactif à fait le
tour de la terre touchant l’ukranie, Pologne, filande, France ..., parmis ces éléments radioactifs rejetés on cite
0,25
0,25
−
0, 5
m(54 Xe ) = 130,8753u m( - ) = 0,00055u
1u = 931,5MeV . C −2 = 1,66054.10−27 kg
La demi- vie du noyau 131
53 I
: t1 / 2 = 8 jours
;
1eV = 1,60.10−19 J
1) Une onde lumineuse est elle une onde mécanique ? justifier ?
2) Donner la relation entre : , et d .
131
53
0,25
0,25
0,25
3)
0,5
Calculer la constante radioactive de désintégration .
Lors de l’explosion, 100kg de noyaux de l’iode ont été émis dans l’atmosphére. Calculer N 0 le nombre du
noyau initial émis.
monochromatique utilisée. Est-elle visible ?
4) La radiation émise par cette source laser correspond à la transition des atomes du néon d’un état d’énergie E2 à un
0,25
1) La désintégration du noyau
I conduit à la formation d’un noyau de Xenium 54 Xe .Ecrire l’équation de
désintégration de ce elément radioactif.
2) Calculer l’énergie libérée lors de la désintégration d’un noyau de 131
53 I .
0,25
J .s
3) La figure 2 représente la courbe = f ( ) ; Déterminer graphiquement la longueur d’onde de la lumière
m(131
53 I ) = 130,8773u
4)
−34
1
d
.
l’iode 131
53 I a une radioactivité de type
Données :
0,25
Figure 2
état d’énergie E1 .Calculer en eV la variation d’énergie E = E2 − E1 .
5) Si on réalise la même expérience en utilisant une lumière blanche, on observe une tâche centrale blanche et des
taches latérales irisées. Interpréter l’aspect de la figure observée.
6) Calculer la longueur d’onde de la lumière du laser utilisé lorsqu’elle se propage dans un milieu d’indice n = 1,5
ainsi que sa vitesse de propagation dans ce milieu
4
Physique 3 : Electricité :
5) On fait varier la capacité C et on mesure l’intensité
Partie I : Étude des oscillations électriques libres amorties (2 pts)
efficace du courant électrique circulant dans le circuit.
On obtient la courbe représentée dans la figure-3
On considère le montage de la figure 1 qui comprend :
Un générateur idéal de tension qui donne une tension E = 12V
Une bobine d’inductance L et de résistance négligeable ;
Un condensateur de capacité C ;
Un conducteur ohmique de résistance R = 30 ;
Un interrupteur K
On charge le condensateur sous la tension E en plaçant ’interrupteur
dans la position (1).
Lorsque le condensateur est complètement chargé, on bascule
0,25
5-2) Calculer la valeur de la puissance moyenne consommée
0,25
A l’aide d’un dispositif approprié, on visualise la courbe
Partie I : étude du mouvement d’un skieur (2 pts)
représentant les variations de la tension u R en fonction du temps
Un skieur (S), de masse m glisse avec frottement sur une piste rectiligne OA inclinée d'un angle par rapport à l’horizontal,
(figure2). Les droites T0 et T1 sont les tangentes à la courbe à des
mouvement , Le skieur part sans vitesse initiale du point A ( AO = L = 40m ) et quitte la piste au point O à la vitesse VO
1) Montrer que l’équation différentielle vérifiée par la tension u R
et atterrit au point D situé sur une piste BD inclinée d‘un angle par rapport l’horizontal. (Voir figure).
s’écrit sous la forme :
A.
d uR
du
4
+ 2. R + 2 u R = 0
dt
dt 2
T0
2
0,25
0,25
0,25
0,5
l’instant t 0 = 0 .
Mouvement sur la piste (AO) :
Pour étudier le mouvement de skieur sur la piste AO , on choisi
Donner les expressions de T0 et en fonction des paramètres du
circuit.
2) Quel est la valeur de la tension u L aux bornes de la bobine à
Les forces de frottements est équivalente à une force unique et constante f paralléle à l’axe (A, i ' ) de sens contraire au
dates t 0 = 0 et t1 = 3ms respectivement.
0, 75
dans le circuit à la résonance.
***************************************************************************************************
Physique 4 : Mécanique :
l’interrupteur dans la position (2) à l’instant t 0 = 0 , il passe alors dans le circuit un courant d’intensité i
2
5-1) En exploitant cette coourbe déterminer L ’inductance
de la bobine
un repère R’ (A, i ' ) lié à la terre et on considère l’instant du départ
du point A comme origine des temps.
T1
1) En appliquant la deuxième loi de Newton, Trouver l’expression
T0
0,25
3) Déduire la valeur de L
4) On considére que la pseudo-période des oscillations est égale à la période propre. Calculer la capacité C du
condensateur.
5) Calculer l’énergie dissipé par effet joule entre les instants t 0 = 0 et t1 = 3ms .
Partie II : Oscillations forcées dans un circuit RLC en Régime sinusoïdal (2,25 pts)
(
de l’accéleration du mouvement a G en fonction g et .
Données : f = 0,1.P avec
skieur et g = 10ms
−2
P : l’intensité du poids de
.
2) Le suivi du mouvement du skieur a permis de tracer la courbe
(Figure 2).
)
On réalise un circuit, comportant un générateur GBF qui délivre une tension sinusoïdale u (t ) = u m . cos 2N .t en
0,25
série avec une bobine d’inductance L de résistance interne r , un condensateur de capacité C réglable et un conducteur
0,25
ohmique de résistance R = 45 , l’expression de l’intensité du courant qui circule dans le circuit est
0,5
i (t ) = I m . cos(2N .t + ) , U m et sont maintenues constantes. On fixe la valeur de C sur une certaine valeur C1 .
On obtient les courbes u (t ) et u R (t ) représentées dans la
2-1) Trouver graphiquement la valeur de l’accélération. a G
2-2) Déduire la valeur de l’anlge .
2-3) En utilisant les équations horaires du mouvement v x ' (t ) et
x ' (t ) . Exprimer la vitesse v O en fonction de L et a G .
Calculer sa valeur.
B. Mouvement dans le champ de pesanteur dans le plan (xoy) :
figure-2.
0,25
1) Justifier que la courbe (a) représente la tension u (t )
1
2) En utilisant la figure 2, déterminer les valeurs des
U m , I m , N et
Le skieur fait un saut en O avec la vitesse v O . On considère maintenant O l’origine du répére R (O, i , j ) et l’instant de
passage de skieur par le point O comme nouvelle origine des dates. On néglége les frottements pendant la chute.
0,25
3) En appliquant la deuxième loi de Newton, etablir les équations horaires x (t ) et y (t ) du mouvement.
0,25
3) Déterminer Z l’impédance du circuit.
0, 25
4) On pose d = BD . Calculer la distance d .
0,25
4) Déduire r la résistance interne de la bobine.
0,25
5) Calculer v D la valeur de la vitesse de skieur au point D.
5
6
Partie II : Étude d’un système oscillant (3 pts)
page
Le but de cet exercice est la détermination de que quelques grandeurs qui sont liées au mouvement d’un systéme
oscillant.
On considère une tige homogène de masse m et de centre d’inertie G capable de tourner autour d’un axe fixe
7
1
2 امتحان وطني تجر يبي رقم
للبكالور يا
passant par son extrémité O . On pose J le moment d’inertie de la tige par rapport à l’axe de rotation ( ) On fixe
المسالك الدولية
en O , un ressort spirale caractérisé par une constante de torsion C et de masse négligeable et dont l’autre extrémité
2023 الدورة العادية
- الموضوع-
est fixée à un support. À d’équilibre, le ressort est non déformé.
On écarte le pendule de sa position d’équilibre d’un petit angle 0 =
15
puis on le lâche avec une vitesse initiale 0 à un instant t = 0 . La
position du pendule est repérée par l’angle formée par la tige avec la
verticale passant par O .
3
مدة الإنجاز
7
المعامل
المادة
الفيز ياء و ال�كيمياء
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية
الشعبة أو المسلك
Données :
Pour les petites oscillations : Cos 1 −
2
;
2
INSTRUCTIONS GENERALES
Sin
m = 100 g ; g = 10ms −2 ; OG = d = 0,1m
0, 5
1) En appliquant la relation fondamentale de la dynamique trouver l’équation différentielle du mouvement.
2.
t +
T0
2) La solution de l’équation différentielle s’écrit sous la forme : (t ) = m . cos
• Le candidat peut traiter les exercices de l’épreuve suivant l’ordre qui lui convient ;
• L’utilisation de la couleur rouge lors de la rédaction des solutions est à éviter.
0,25
2-1) Trouver l’expression de T0 la période propre des oscillations.
0, 5
2-2) En projetant la deuxième loi de Newton à un instant t sur la base de Freinet, trouver l’expression de la composante
.
• L’utilisation de la calculatrice non programmable est autorisée ;
..
tangentielle RT de l’action de l’axe sur le pendule on fonction de et .En déduire sa valeur à la position d’équilibre.
3) On considère l’état de référence de l’énergie potentielle de pesanteur, le plan horizontal qui
COMPOSANTES DU SUJET
se trouve à une hauteur h au-dessous de G0 , et l’état de référence de l’énergie potentielle de
0,25
torsion lorsque le ressort est non déformé.
3-1) Exprimer l’énergie potentielle totale du système en fonction de : m , g , , h , d et C .
3-2) La courbe de la figure ci contre montre les variations de l’énergie potentielle totale du système en fonction du
temps. Trouver :
L’épreuve est composée de quatre exercices indépendants entre eux et répartis suivant les domaines comme
suit :
0,25
a) La valeur de h
0,25
b) La constante de torsion C du ressort spiral
0,25
c) L’amplitude des oscillations m
Exercice 1
Chimie
7 points
0, 5
d) La vitesse angulaire maximale, et en déduire le moment
Exercice 2
Ondes et Nucléaire
3 points
Exercice 3
Electricite
4.75 points
Exercice 4
Mecanique
5.25points
d’inertie J de la tige par rapport à l’axe .
0,25
e) La valeur de .
7
************************************Bon courage***********************************
1
aebc
Prof.Zakaryae Chriki
Exercice 1
Chimie
7 points
Les parties 1 et 2 sont indépendantes
Partie ӏ : L’électrolyse d’une solution aqueuse de chlorure d’or (III)
On étudie dans cette partie l’électrolyse d’une solution aqueuse de chlorure d’or (III) pour déposer une
fine couche d’or métallique sur une plaque de cuivre.
On plonge totalement une plaque de cuivre dans une solution aqueuse de chlorure d’or (III)
Au 3+
(aq) + 3Cl(aq) et on la relie à l’un des pôles d’un générateur électrique G , puis on relie l’autre pôle de
G à une électrode de graphite immergée dans la même solution.
Le générateur débite un courant électrique d’intensité constante I =50 mA , pendant une durée t .
Au cours de cette électrolyse, on observe un dépôt métallique d’or sur la plaque du cuivre et un
dégagement gazeux de dichlore Cl2(g) au niveau de l’électrode de graphite.
Données :
3+
Les couples mis en jeu : Au (aq) /Au (s) et Cl2(g) / Cl(aq) ;
aebc
Prof.Zakaryae Chriki
Pour vérifier la valeur de la concentration C b
pH
de la solution aqueuse Sb , on réalise le dosage
pH-métrique d’un volume Vb 15mL de la
12
solution aqueuse Sb par une solution aqueuse
Cl(aq)
Sa d’acide chlorhydrique H3O(aq)
de
concentration Ca 102 mol.L1 . La courbe de
la figure ci-contre représente les variations du
pH du milieu réactionnel en fonction du
volume versé Va de la solution Sa.
2.1. Ecrire l’équation de la réaction du
dosage.
2.2. Déterminer graphiquement les
coordonnées (VaE , pHE ) du point
10
8
6
4
2
0
3
d’équivalence.
2.3. En déduire la concentration C b .
La masse molaire de l’or : M(Au)=197g.mol ;
-1
1F = 9,65.104 C.mol-1 .
1. Faire un schéma du dispositif expérimental utilisé pour cette électrolyse, en précisant l’anode et
le sens du courant dans le circuit extérieur de l’électrolyseur.
2. Ecrire l’équation de la réaction chimique ayant lieu au niveau de chaque électrode ainsi que
l’équation bilan.
3. Trouver, en minutes (min), la durée t nécessaire au dépôt d’une masse d’or m(Au) = 0,031g .
Partie 2 : Etude de quelques propriétés d’une solution aqueuse de méthylamine
La méthylamine de formule semi-développée CH3 NH 2 est utilisée dans l’industrie
pharmaceutique comme constituant de plusieurs produits tels que des antispasmodiques ou des
anesthésiques ou comme matière première pour la fabrication des insecticides.
Dans cette partie, on se propose d’étudier quelques propriétés d’une solution aqueuse de
méthylamine.
1. Etude d’une solution aqueuse de méthylamine
On prépare un volume V 1L d’une solution aqueuse Sb de méthylamine de concentration
Cb 102 mol.L1 . La mesure du pH de la solution Sb à 25 C donne pH=11,3 .
Donnée :
- Le produit ionique de l’eau à 25 C: K e 1014 .
1.1. Donner la définition d’une base selon Bronsted.
1.2. Ecrire l’équation de la réaction de la méthylamine avec l’eau.
1.3. Calculer le taux d’avancement final de cette réaction. Que peut-on déduire ?
1.4. Montrer que le quotient de la réaction Qr,éq à l’équilibre s’écrit ainsi: Qr,éq
Cb .2
.
1
Calculer sa valeur.
1.5. Trouver l’expression de la constante d’acidité K A du couple CH3 NH3 (aq) / CH3 NH2(aq) en
fonction de Qr,éq et K e puis vérifier que pK A 10,7 .
2. Dosage d’une solution aqueuse de méthylamine
6
9
12
15
21
Va(mL)
2.4. Choisir, parmi les indicateurs colorés suivants, l’indicateur adéquat pour réaliser ce dosage.
Justifier votre réponse.
Indicateur coloré Hélianthine Bleu de bromothymol Rouge de crésol Phénolphtaléine
3,0 - 4,6
6,0 - 7,6
7,2 - 8,8
8,2 – 10,0
Zone de virage
CH3 NH 2(aq)
2.5. Déterminer le quotient
pour le volume Va1 20, 4 mL de la solution Sa versée.
CH3 NH3(aq)
En déduire l’espèce chimique prédominante.
V
2.6 Sachant que lorsque VA AE on a pH pK A . Déterminer graphiquement la valeur du pK A .
2
Ondes et Nucléaire
3 points
Les parties 1 et 2 sont indépendantes
Partie 1 : Propagation d’une onde mécanique
On crée, à un instant choisi comme origine des dates t = 0, en un point S de la surface de l’eau
une onde mécanique progressive
yM (mm)
sinusoïdale de fréquence N. La
courbe de la figure ci-contre
3
représente les variations en
t (ms)
fonction du temps de l’élongation
0
10
35
45
25
yM d’un point M du milieu de
propagation situé à la distance
-3
L = 2,5 cm du point S.
Exercice 2
-6
Recopier le numéro de la question et écrire, parmi les quatre réponses proposées, la réponse juste
sans aucune justification ni explication.
1. La fréquence de l’onde est:
N 25Hz
N 50 Hz
N 100 Hz D
N 200 Hz
A
B
C
2. Le point M reprend le même mouvement de S avec un retard temporel de valeur :
0,1s
0,02s
0, 01s
0, 2s
A
B
C
D
2
18
3
aebc
Prof.Zakaryae Chriki
3. La célérité de l’onde à la surface de l’eau est:
A
v 2,5m.s1
4. La longueur d’onde est :
5cm
A
B
B
v 0, 25m.s1
2,5cm
v 25m.s1
C
0,5m
C
D
v 0, 4 m.s1
0, 25cm
D
Partie 2 : Datation au carbone 14
On se propose dans cette partie de déterminer l’âge approximatif d’un morceau de bois ancien à
l’aide de la datation au carbone 14.
La désintégration du noyau de carbone 14 ( 146 C) est de type .
Données :
14
- La masse du noyau de carbone 14 : m( 6 C) =13,99995u ;
- La masse du neutron : mn =1,00866 u ;
- La masse du proton : mp =1,00728u ;
- 1u = 931,5MeV.c-2 ;
C
14
6
ohmique (figure 2). La droite (T) étant la
tangente à la courbe au point d’abscisse t = 0 .
1.1. Recopier le schéma de la figure 1 et
0,25
indiquer comment est branché le système
d’acquisition informatisé pour visualiser la
tension u R (t) . (le branchement du système
d’acquisition est identique à celui de
l’oscilloscope).
1.2. Montrer que l’équation différentielle
0,5
vérifiée par la tension u R (t) s’écrit sous la
C +10 e + 145 B
B
14
6
C 42 He + 104 Be
D
14
6
uR(V)
(T)
10
C1
8
6
4
2
0
1
1.6. On refait la même expérience en ajustant
l’inductance de la bobine sur la valeur
L L1 2L0 . Un système d’acquisition
C -10 e + 147 N
C -10 e 145 B
2. Calculer, en MeV, l’énergie de liaison E du noyau de carbone 14.
2
3
informatisé permet de suivre l’évolution de la
tension u R (t) dans les deux cas: L L0 et L L1 .
C3
C1
8
C2
6
4
2
l’évolution de la tension u R (t) dans le cas où L L1 . Justifier votre réponse.
Déterminer, en ans, l’âge approximatif t1 du morceau de bois ancien.
2. Oscillations libres dans un circuit RLC série
On se propose dans cet exercice d’étudier:
- La réponse d’un dipôle RL à un échelon de tension;
- Les oscillations libres dans un circuit RLC série;
- La réception d’une onde modulée en amplitude.
1. Réponse d’un dipôle RL à un échelon de tension
On réalise le montage expérimental schématisé sur la figure 1.
Ce montage est constitué :
- d’un générateur idéal de tension de force électromotrice E=10V;
- d’une bobine d’inductance L réglable et de résistance r;
- d’un conducteur ohmique de résistance R 490 ;
- d’un interrupteur K.
4
0
2
10
t(ms)
(L,r)
On réalise le montage représenté sur le schéma de la figure 4.
Figure 4
- la bobine précédente où l’inductance est
(L,r)
R
8
C
ajustée à la valeur : L 1H ;
E
6
K
- un condensateur de capacité C initialement chargé ;
K
4
Figure 3
Ce montage comprend :
i
t(ms)
C4
carbone 14 dans un morceau de bois récent de même masse vaut a 0 = 418Bq .
4.75 points
6
10
Choisir parmi les courbes C2, C3 et C4
représentées sur la figure 3, celle qui représente
Electricite
5
uR(V)
3. Le taux de carbone 14 reste le même dans les tissus des êtres vivants. Ce taux diminue
progressivement, suivant la loi de décroissance radioactive, après la mort de ces êtres vivants.
L’activité du carbone 14 dans un morceau de bois ancien est a1 =318Bq , tandis que l’activité du
Exercice 3
4
Figure 2
du R (R r)
ER
.
uR
dt
L0
L0
bornes du conducteur ohmique quand le régime
permanent est atteint.
1.4. En déduire la valeur de la résistance r de la
bobine.
1.5. Vérifier que L0 0,5H .
1.2. L’équation de désintégration du carbone 14 est:
14
6
choisi comme origine des dates t = 0 .
Un système d’acquisition informatisé permet de
visualiser la courbe C1 représentant l’évolution
de la tension u R (t) aux bornes du conducteur
1.3. Déterminer graphiquement la tension U 0 aux
1. Recopier le numéro de la question et écrire, parmi les quatre réponses proposées, la réponse
juste sans aucune justification ni explication.
1.1. Le noyau de carbone 14 se compose de:
14 protons et 6 neutrons
8 protons et 6 neutrons
A
B
6 protons et 8 neutrons
6 protons et 14 neutrons
C
D
A
On ajuste l’inductance de la bobine sur la valeur L L0 et on ferme le circuit à un instant
forme :
- La demi-vie du carbone 14: t1/2 =5730ans .
aebc
Prof.Zakaryae Chriki
Figure 1
5
aebc
Prof.Zakaryae Chriki
- un interrupteur K.
aebc
Prof.Zakaryae Chriki
17,5
q (mC)
La courbe de la figure 5 représente
;
OA = 4 m
;
m = 2 kg
;
f 2N.
1. Etude du mouvement sur la portion OA
l’évolution de la charge q(t) du condensateur
2.1. Etablir l’équation différentielle vérifiée
2
On considère que G est confondu avec l’origine O de l’axe (O, i ) à l’instant t = 0 et que sa vitesse est
1
nulle à cet instant. Le solide (S) est soumis, sur la portion OA, à une force motrice F constante,
parallèle à la ligne de plus grande pente du plan incliné et dirigée vers le
haut (figure 1).
x(m)
4
1.1. Montrer que l’équation différentielle du mouvement s’écrit ainsi:
0,5
.
par la charge q(t).
0
2.2. Sachant que la pseudopériode est
0,75
0,04
approximativement égale à la période propre
-1
T0 des oscillations, déterminer la capacité C
-2
0,08
0,12
0,16
0,2
t (s)
d2 x F f
g sin . 0,5
2
dt 2
m
1.2. La courbe de la figure2 représente les variations de x en fonction de t2 . 0,5
1.2.1. En exploitant la courbe de la figure 2, déterminer l’accélération a1x
0
du centre d’inertie G. 0,5
du condensateur. (On prend 2 10 ).
Figure 5
3 . Réception d’une onde modulée en amplitude
Pour recevoir une onde radio, modulée en amplitude et de fréquence f 0 =171 kHz , on utilise le
2
Figure 2
4 t2(s2)
1.2.2. Montrer que l’intensité de la force F est : F 12 N .
montage représenté par le schéma simplifié de la figure 6.
1.2.3. Vérifier que la vitesse de G lors de son passage par le point A est : VA 4 m.s1 .
2. Etude du mouvement sur la portion AB
Antenne
L
C1
Amplification
A
D
C2
B
E
R
C
On élimine la force F à l’instant où G passe par le point A.
Pour étudier le mouvement de G sur la portion AB, on choisit l’instant de passage de G par le point A
comme nouvelle origine des dates t 0 .
2.1. Déterminer l’accélération a 2x de G sur la portion AB.
R2
2.2. Sachant que la vitesse de G s’annule au point B, trouver la distance AB.
M
Partie 2
Partie 1
Partie II : Mouvement d’une particule chargée dans un champ magnétique uniforme
Une particule de charge q e et de masse m pénètre en O avec une vitesse horizontale V0 dans une
zone où règne un champ magnétique B uniforme, perpendiculaire au plan vertical (π) (figure 2). La
trajectoire de la particule est un demi-cercle de centre O’ et de diamètre OP(figure 2).
B
O V0
L’intensité du poids de la particule est négligeable devant celle de la force de Lorentz
M
qui s’exerce sur celle-ci.
O’
vM
1-Donner l’expression vectorielle de la force de Lorentz qui s’exerce sur la particule
au point M de sa trajectoire (figure 2).
P
()
2-Par application de la deuxième loi de Newton, montrer que le mouvement de la
Figure 2
particule est circulaire uniforme dans la zone où règne le champ B .
3-Exprimer le diamètre OP en fonction de m , e , B et V0 . Calculer sa valeur.
Partie 3
Figure 6
La partie 1 de ce dispositif est constituée d’un condensateur de capacité C1 85,4 pF et d’une
bobine d’inductance L réglable.
3.1. Quel est le rôle de chacune des deux parties 1 et 3 de ce montage ?
3.2. Déterminer la valeur de l’inductance L de la bobine qui permet de recevoir l’onde radio de
fréquence f 0 . (On prend 2 10 ).
Exercice 4
Mecanique
5.25points
Les parties 1 et 2 sont indépendantes
Partie 1 : Etude du mouvement d’un solide sur un plan incliné
Un solide (S), de masse m et de centre d’inertie G, se déplace avec frottement sur un plan incliné
d’un angle par rapport à l’horizontale.
B
On étudie le mouvement de la montée du solide (S) de la
A
position O à la position B (figure 1).
F
Les frottements sont modélisés par une force f constante
ayant une intensité f .
On étudie le mouvement du centre d’inertie G dans le repère
(O, i ) lié à un référentiel terrestre supposé galiléen.
O
i
x
On donne :
m =1,67.10-27 kg
;
e 1,60.1019 C ;
(S)
G
Figure1 G
On repère à chaque instant la position de G sur le plan incliné par son abscisse x.
Données : accélération de la pesanteur g = 10 m.s-2 ;
6
7
V0 106 m.s 1
;
B 0,1T .
Barème
Exercice 1
L’acide benzoïque C6H5COOH est un solide blanc utilisé comme produit conservateur dans
certains produits alimentaires, en particulier les boissons, en raison de ses caractéristiques
comme un fongicide et un antidote à la bactérie. Il entre dans la préparation de certains
types de composés organiques utilises pour la fabrication des parfums. Il est connu sous le
code E210
Les données :
La masse molaire de l’acide benzoïque : M(C6H5COOH)=122g/mol
Les conductivités molaires ioniques
: λ H O+ = 35mS.m².mol -1 ; λ C H COO- = 3, 24mS.m².mol -1
3
L’usage de la calculatrice scientifique non programmable est autorisé.
6
5
0,5
IEtude de la réaction de l’acide benzoïque avec l’eau :
On considère une solution aqueuse (S) d’acide benzoïque de volume V=200mL et de
concentration molaire en acide benzoïque C = 5.10-3mol / L. la mesure de la conductivité de la
solution (S) a donné la valeur
σ = 2,03.10-2S.m-1.
1- Etablir le tableau d’avancement de la réaction d’acide benzoïque et l’eau.
1
2- Trouver l’expression de xéq l’avancement de la réaction en fonction de σ ; λ H 3O + ;
λ C H COO- et V. Calculer sa valeur.
6
1
On donnera les expressions littérales avant de passer aux applications numériques.
Le sujet comporte 4 exercices
Qr;éq =
0,5
Exercice I (7 points) :
- Quelques utilisations de l’acide benzoïque.
- Etude d’une pile aluminium/cuivre.
Exercice II (3 points) :
- Détermination de la célérité d’une onde sonore.
- Propagation d’une onde lumineuse.
Exercice III (5 points) :
- Étude de la réponse d’un dipôle RC à un échelon de tension ascendant.
- Étude des oscillations électriques libres et échange énergétique.
Exercice IV (5 points) :
- Étude du mouvement d’un skieur.
5
3- Montrer que l'expression de Qr ;éq le quotient de la réaction a l’équilibre ; s’écrit :
0,5
1
xéq ²
.
V.(CV - xéq )
4- Déduire la valeur de pKA la constante d’acidité de la couple C6H5COOH/C6H5COOII- Détermination de la masse de l'acide benzoïque contenu dans une
boisson gazeuse
L’étiquette sur la bouteille d’une boisson gazeuse indique l'existence de 0,15g d'acide benzoïque
dans un litre de boisson. Pour vérifier cette information, on dose un volume VA = 50mL de la
+
+ HO(aq)
) de concentration
boisson par une solution aqueuse d'hydroxyde de sodium (Na(aq)
molaire CB = 10-2 mol / L .
Le volume de la solution d'hydroxyde de sodium ajouté à l’équivalence est : VBE = 6 mL.
1- Ecrire l'équation de la réaction du dosage
2- Calculer la valeur de la masse m de l'acide benzoïque contenue dans le volume V0 = 1L de
boisson. Est-ce que ce résultat est en accord avec la valeur de l’étiquette.
Deuxième partie :
On réalise la pile Aluminium –Zinc en plongeant une
plaque d’aluminium dans un bécher contenant un volume
V =100mL d’une solution aqueuse de chlorure
3+
-
d’aluminium (A (aq) + 3C (aq) ) de concentration molaire
-2
initiale C1 = A 3+
(aq) i = 4, 5.10 mol / L et une plaque de
zinc dans un autre bécher contenant un volume V
=100mL d’une solution aqueuse de sulfate de zinc
2+
2(Zn(aq)
+ SO4(aq)
) de concentration molaire initiale
2+
= 4, 5.10-2 mol / L . On relie les deux solutions par un pont salin. On monte entre les
C2 = Zn(aq)
i
- Étude d’un système mécanique oscillant.
pôles de la pile, un conducteur ohmique (D), un ampèremètre et un interrupteur K (figure1).
La vitesse de propagation de la lumière dans le vide et l’air : c=3.108m/s2
Données :
La masse de la partie de la plaque d’aluminium immergée dans la solution de chlorure
d’aluminium, à l’instant de la fermeture du circuit, est m0 =1,35g.
La masse molaire de l’aluminium M(Al)=27g.mol-1.
La constante de Faraday : 1ℱ = 9,65.104𝐶. 𝑚𝑜𝑙-1
La constante d’équilibre associée à la réaction :
2+
2A (s) + 3Cu(aq)
1
0,75
0,75
0,25
0,5
0,5
90
2A 3+
(aq) + 3Cu (s) est K= 10 à 25°C.
On ferme l’interrupteur K à l’instant t =0; un courant d’intensité considérée constante : I=10mA
circule dans le circuit.
1- En utilisant le critère d’évolution spontanée ; donner la représentation conventionnelle
de la pile étudiée.
2- Trouver, lorsque la pile est totalement épuisée :
2.1. La concentration des ions aluminium dans la solution de chlorure d’aluminium.
2.2. La durée t du fonctionnement de la pile.
0,5
0,5
Exercice 3 :
Exercice 2 :
Détermination de la célérité d’une onde sonore
Pour déterminer la célérité des ondes sonores dans l’air on réalise le montage expérimental
de la figure 1
0,25
0,5
La distance séparant les deux microphones R1 et R2 est d
Les deux oscillogrammes de la figure 2 représentent le les variations de la tension
aux bornes de chaque microphone pour une distance d1=20cm.
La sensibilité horizontale pour les deux voies est : SH=0,2 ms/div
1- Définir la longueur d’onde λ .
2- On écarte le microphone R2 horizontalement jusqu’à ce que les deux courbes deviennent en
phase une nouvelle fois et pour la deuxième fois, et la distance entre R1 et R2 devienne
d2=88 cm, calculer la célérité de propagation des ondes sonores.
Deuxième partie : Propagation d’une onde lumineuse
1- Détermination du diamètre d’un fil de pêche :
Le fil de pèche est fabrique a partir du nylon qui supporte une grande résistance au poisson
pèche, son diamètre est très petit pour ne pas être vue
par les poissons.
Pour déterminer le diamètre a d’un fil de pêche, on
l’éclaire a l’aide d’une source laser de longueur d’onde
λ0, sur un écran situe à une distance D du fil on obtient
des taches lumineuses, la largeur de la tache centrale est
L (voir figure).
Les données : λ0=623,8nm - D=3m - L=7,5cm.
1.1.Donner le nom du phénomène observe sur la figure.
1.2.Trouver la valeur de a en fonction de D, L et λ0 dans le cas ou θ est petite. Calculer la valeur
de a.
1.3.On remplace le laser par un autre de longueur d’onde λ’ et on obtient une tache centrale de
largeur L’=8 cm. Exprimer λ’ en fonction de λ0, L et L’, calculer λ’
1- La longueur d’onde d’une onde lumineuse dans le verre :
La source laze précédent envoie un faisceau lumineux monochromatique de longueur d’onde λ0 sur
la face d’un prisme de verre d’indice de réfraction n=1,58.
2.1. Calculer la vitesse v de propagation du faisceau lumineux dans le prisme.
2.2. Trouver la valeur de la longueur d’onde λ1 des faisceaux lumineux dans le prisme.
0,25
0,5
0,5
0,5
Les circuits électriques ou électroniques comportent des condensateurs et des bobines dont les
comportements diffèrent selon leurs usages.
Cet exercice vise :
►
L’étude de la réponse d'un dipôle RC à un échelon de tension ascendant ;
►
L’étude des oscillations électriques libres et l'échange énergétique dans un circuit RLC
série.
On réalise le montage électrique représenté dans la figure (1) constitué des éléments suivants
:
✓ Un générateur idéal de tension de force électromotrice E
✓ Un condensateur de capacité C initialement non chargé ;
✓ Une bobine de l’inductance L et de résistance interne
r = 8Ω.
✓ Deux conducteurs ohmiques de résistances respectives
R1=6KΩ et R2.
✓ Un interrupteur K.
I. Étude de la réponse d'un dipôle RC à un échelon de
tension ascendant :
À l'instant t =0s, on place l'interrupteur en position (1). La figure (2) représente la variation de la
tension uc(t) aux bornes du condensateur.
1- Etablir que l’équation différentielle vérifiée par la tension
uc(t).
2- La solution de cette équation différentielle est :
-
t
uC (t) = A.e τ + B trouver l’expression de chacune des
constantes A, B et τ, en fonction des paramètres du circuit.
3- En exploitant la courbe de la figure 2 Trouver la valeur de
la capacité de condensateur C.
4- Trouver l’expression de l’intensité du courant électrique en
fonction de E ;R ; τ et t. Calculer sa valeur à l’instant t=0.
II. Étude des oscillations électriques libres et échange énergétique :
Lorsque le régime permanent est atteint, on bascule l'interrupteur K en position (2) à l'instant t0=0.
La courbe de la figure (3) représente la variation de la tension uc(t) aux bornes du condensateur.
0,5
0,5
0,5
0,25
0,5
0,5
0,5
0,5
0,5
0,5
1- Justifier la nature des oscillations électriques dans le circuit en vu énergétique.
2- En considérant que la pseudo-période T est égale à la période propre de l'oscillateur (LC),
déterminer la valeur de l'inductance L de la bobine (On prend 𝜋2 =10).
5T
3- Calculer l’énergie dissipée par effet Joule entre les instants t1 = 0 et t 2 =
.
2
4- Pour entretenir les oscillations, on monte en série avec le condensateur et la bobine (b),
précédemment étudiés, un générateur (G) qui délivre une tension proportionnelle à l’intensité
du courant électrique : uG(t)=k.i(t)
4.1. Etablir l’équation différentielle vérifiée par la charge q(t).
4.2. On obtient des oscillations électriques sinusoïdales lorsque la constante k prend la valeur
k=58 dans le système d’unités internationales. En déduire la valeur de la résistance électrique
R2.
4.3. Démontrer que l’énergie totale du circuit Etot est constante.
C
4.4. Montre que : I max = E.
avec Imax l’intensité maximale du circuit.
L
Exercice 4 :
Première partie : Etude du mouvement d’un skieur
La pratique du sport du ski, dans les stations des montagnes, attire de plus en plus
l’intention des jeunes marocains, parce qu’elle intègre les qualités du plaisir et l’aventure.
Le but de cet exercice est d’étudier le mouvement du centre d’inertie d’un skieur et ses
accessoires sur le circuit du ski.
La figure ci-dessous, représente un circuit de ski
constitué de deux parties :
Partie A’B’ rectiligne et inclinée d’un angle α par
rapport au plan horizontal ;
Partie B’C’ rectiligne et horizontale.
Données :
g = 9,8 m.s-2;
Longueur de la partie A’B’ :A’B’ = 80 m ;
Masse du skieur et ses accessoires : m = 60 kg ;
L’angle d’inclinaison : α =18°.
1- Etude du mouvement du skieur et ses accessoires sur la partie inclinée sans frottements.
On étudie le mouvement du centre d’inertie G du système (S), formé du skieur et ses accessoires,
dans le repère (A,𝒊⃗ ′ ,𝒋⃗⃗′ ) lié à la terre et supposé galiléen.
0,5
0,5
A un instant t = 0, choisi comme origine des temps, le système (S) part sans vitesse initiale d’une
position où G coïncide avec A.
Le mouvement de G se fait suivant la ligne de plus grande pente du plan incliné AB, tel que :
AB = A’B’.
Par application de la deuxième loi de Newton, trouver :
1-1- La valeur de l’accélération aG du mouvement du centre d’inertie G.
1-2- L’intensité R de la force modélisant l’action du plan incliné sur (S).
1-3- La valeur vB de la vitesse de G au passage par la position B.
2- Etude du mouvement du skieur et ses accessoires sur la partie horizontale avec frottements.
Le mouvement de G se fait sur la partie BC, tel que : BC = B’C’.
On étudie le mouvement du centre d’inertie G du système (S) formé du skieur et ses accessoires
dans le repère
(B,𝒊) lié à la terre et supposé galiléen. On prend xG= 0, à un instant t = 0, considéré comme
nouvelle origine des dates.
Le système subit au cours de son mouvement deux types de frottements.
Frottements dus au contact entre la partie B’C’ et le système (S), modélisés par une force
⃗𝒇𝟏 = −𝟔𝒊
constante
⃗ 𝟐 = −𝟎. 𝟎𝟔𝑽𝟐 𝒊 ,où V représente la
Frottements dus à l’action de l’air, modélisés par la force :𝒇
vitesse du centre d’inertie G.
2-1- Par application de la deuxième loi de
Newton, montrer que l’équation différentielle
vérifiée par la vitesse v, s’écrit sous la forme
𝒅𝑽
: 𝒅𝒕 + 𝟏𝟎−𝟑 𝑽𝟐 + 𝟎. 𝟏 = 𝟎
2-2- En exploitant le tableau ci-contre, et en
utilisant la méthode d’Euler, calculer les valeurs : ai+1 et vi+2..
Deuxième partie : Etude d’un système mécanique oscillant
Le pendule de torsion permet de déterminer quelques grandeurs physiques
caractéristiques de la matière, comme la constante de torsion des matériaux solides
déformables, et les moments d’inertie des oscillateurs mécaniques.
On étudiera de façon simplifiée, la méthode de détermination de la constante de torsion
d’un fil métallique, et quelques grandeurs dynamiques et cinématiques, en exploitant les
diagrammes d’énergie du pendule de torsion.
Le pendule de torsion se compose d’un fil de torsion vertical de constante
de torsion C, et d’une barre AB homogène, de moment d’inertie
JΔ= 2,4.10-3kg.m2
par rapport à un axe vertical (Δ) colinéaire au fil et
passant par le centre d’inertie G de la barre.
On tourne la barre, horizontalement, dans le sens positif, autour de (Δ),
d’un angle θm= 0,4 rad par rapport à la position d’équilibre, et on la lâche
sans vitesse initiale à un instant t = 0, considéré comme origine des temps.
On repère la position de la barre à chaque instant par son abscisse angulaire
θ par rapport à sa position d’équilibre (Figure 1)
On étudie le mouvement du pendule dans un repère lié à la terre et supposé
galiléen.
Figure 1
page
0,5
0,5
0,5
0,5
7
La position d’équilibre est choisie comme état de référence de l’énergie potentielle de torsion, et le
plan horizontal passant par G comme état de référence de l’énergie potentielle de pesanteur.
On néglige tous les frottements.
Les courbes (a) et (b) de la figure 2, représentent les
variations, en fonction de l’abscisse angulaire θ, des
énergies : potentielle Ep et cinétique EC, de
l’oscillateur.
1- Affecter, à chaque courbe, l’énergie correspondante.
Justifier.
2- Déterminer la valeur de la constante de torsion C du
fil métallique.
3- Trouver la valeur absolue de la vitesse angulaire à
l’instant de passage de l’oscillateur par une position
d’abscisse angulaire θ1= 0,2 rad. Figure 2
4- Calculer le travail du couple de torsion WC lorsque
Figure 2
l’oscillateur passe de la position d’équilibre repérée par l’abscisse
angulaire θ = 0, à la position repérée par l’abscisse angulaire θ1.
1
3 امتحان وطني تجر يبي رقم
للبكالور يا
المسالك الدولية
2023 الدورة العادية
- الموضوع-
3
مدة الإنجاز
7
المعامل
المادة
الفيز ياء و ال�كيمياء
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية
الشعبة أو المسلك
INSTRUCTIONS GENERALES
Fin
• L’utilisation de la calculatrice non programmable est autorisée ;
• Le candidat peut traiter les exercices de l’épreuve suivant l’ordre qui lui convient ;
• L’utilisation de la couleur rouge lors de la rédaction des solutions est à éviter.
COMPOSANTES DU SUJET
L’épreuve est composée de quatre exercices indépendants entre eux et répartis suivant les domaines comme
suit :
Exercice 1
Chimie
7 points
Exercice 2
Ondes et Nucléaire
3 points
Exercice 3
Electricite
4.75 points
Exercice 4
Mecanique
5.25points
1
aebc
Prof.Zakaryae Chriki
Exercice 1
Chimie
aebc
Prof.Zakaryae Chriki
7 points
On réalise quatre expériences dont les conditions expérimentales sont décrites dans le tableau
ci-dessous. n0 (CH3COOH) et n 0 (R OH) représentent respectivement les quantités de matière
Etude de la réaction entre les ions hydrogénocarbonate et l’acide acétylsalicylique
L’équation de la réaction chimique entre les ions hydrogénocarbonate HCO3(aq)
et l’acide
initiales à l’instant t 0 de l’acide éthanoïque et de l’alcool.
acétylsalicylique s’écrit :
L’expérience
C9 H8O4(aq) + HCO3(aq)
C9 H7O4(aq)
+ CO2(g) + H2O( )
Afin de suivre l’évolution de cette réaction, on introduit dans un ballon, un volume V = 10 mL d’une
+
+ HCO3(aq)
solution aqueuse d’hydrogénocarbonate de sodium Na (aq)
dont la concentration initiale
effective des ions hydrogénocarbonate est : HCO3 = C = 0,5mol.L-1 puis à un instant choisi comme
0
n0 (CH3COOH) (mol)
n 0 (R OH) (mol)
Température
(a)
0,6
0,6
1
(b)
0,6
0,6
2 1
(c)
0,6
0,6
2
(d)
0,3
0,6
1
Catalyseur
Aucun
Aucun
Quelques gouttes
d’acide sulfurique
Aucun
origine des dates (t = 0) , on ajoute à la solution une quantité d’acide acétylsalicylique de masse
m = 0,5 g .(On considère que le volume du mélange réactionnel reste constant V = 10 mL ).
La courbe de la figure ci-dessous représente l’évolution temporelle de l’avancement de la réaction x.
1. Montrer que les quantités
x (mmol)
de matière initiales des
réactifs sont :
(T)
n 0 (C9H8O4 ) 2,8 mmol et
n 0 (HCO3 ) = 5mmol .
2
2. Dresser le tableau
descriptif d’avancement de la
réaction.
3. Trouver la valeur de
l’avancement maximal x max .
4. Calculer la vitesse
volumique de la réaction, en
mol.L-1.s-1 , à l’instant
Les courbes (1) , (2) , (3) et (4) de la figure ci-dessous représentent l’évolution temporelle de la quantité
de matière n e de CH3COOR formé.
3-1-Indiquer, en justifiant, la courbe correspondant à l’expérience(c).
3-2-Indiquer, en justifiant, si la proposition suivante est vraie ou fausse :
Le temps de demi-réaction correspondant à
l’expérience (b) est : t1/2 13min .
n e (mol)
3-3- Pour la courbe (1) correspondant à l’une des
expériences, déterminer, en unité mol.L1.min 1 , la
vitesse volumique de la réaction à l’instant t 0
1
t(s)
0
055
055
( (T) représente la tangente à la courbe (1) à t 0 ).
On prendra le volume du mélange réactionnel
V 62mL .
3-4-Pour l’expérience correspondant à la courbe
(1), trouver l’instant où le quotient de réaction
Q r 1, 6 .
( 2)
( 3)
( 1)
0,1
Suivi temporel d’une transformation chimique
On étudie la cinétique de la réaction entre l’acide éthanoïque avec un alcool primaire R-OH.
CH 3COOR H 2 O .
L’équation de la réaction qui se produit s’écrit : CH 3COOH R OH
On réalise quatre expériences dont les conditions expérimentales sont décrites dans le tableau
ci-dessous. n0 (CH3COOH) et n 0 (R OH) représentent respectivement les quantités de matière
initiales à l’instant t 0 de l’acide éthanoïque et de l’alcool.
n 0 (R OH) (mol)
Température
(a)
0,6
0,6
1
(b)
0,6
0,6
2 1
(c)
0,6
0,6
2
(d)
0,3
0,6
1
2
t(min)
Étude d’une réaction d’ estérification
Donnée :
- La masse molaire de l’acide acétylsalicylique : M(C9 H8O4 ) =180 g.mol-1 .
n0 (CH3COOH) (mol)
( 4)
0,2
t = 100 s . (T) représente la tangente à la courbe à l’instant t = 100 s .
5. Déterminer graphiquement le temps de demi réaction t1/2 .
L’expérience
(T)
Catalyseur
Aucun
Aucun
Quelques gouttes
d’acide sulfurique
Aucun
0
10
20
On réalise expérimentalement l'estérification de l’acide éthanoïque C2 H4O2 avec l’éthanol C2 H6O .
1. Écrire, en utilisant les formules semi-développées, l’équation chimique de cette estérification.
Nommer l’ester formé.
2. Le mélange initial est constitué de n 0 = 1 mol d'acide et n 0 = 1 mol d'alcool et quelques gouttes
d'acide sulfurique concentré à température constante. Une fois l’équilibre chimique atteint, la
quantité de matière d'ester formé est n éq (ester) = 0, 67 mol .
2.1. Déterminer le rendement de cette synthèse.
2.2. Calculer la valeur de la constante d’équilibre K associée à l’équation chimique de cette
estérification.
2.3. À l’état d’équilibre précédant, on ajoute au système chimique 1 mol d’acide éthanoïque. On
obtient un nouvel état initial du système chimique dont la composition est: ni (acide) = 1,33 mol ;
n i (alcool) = 0,33 mol ; ni (ester) = ni (eau) = 0, 67 mol .
2.3.1. Calculer la valeur du quotient de réaction Q r,i à cet état initial.
2.3.2. Déterminer le sens d’évolution de cette réaction. Justifier.
2.3.3. Proposer une autre méthode permettant de déplacer l’état d’équilibre du système dans le sens
direct.
3
aebc
Prof.Zakaryae Chriki
Exercice 2
Ondes et Nucléaire
3 points
1-1-Montrer que l’équation différentielle vérifiée par la tension uC (t) s’écrit :
Partie I : Ondes : Propagation d’une onde à la surface de l’eau
2- K1 étant ouvert et K 2 fermé :
x(cm)
1,5
0
1/1-1-Définir la longueur d’onde pour une onde progressive
sinusoïdale.
A un instant t la charge du condensateur est q(t) .
2-1- Exprimer à un instant t, l’énergie totale e du circuit LC en fonction de q(t) , L, C et i l’intensité du
courant.(0,5 pt)
2-2- Sachant que l’énergie totale e est constante, trouver l’équation
différentielle vérifiée par la charge q(t) .(0,5 pt)
1-3- Calculer la célérité v de cette onde.
2-On peut considérer que la célérité des ondes à la surface de l’eau varie avec la profondeur h de l’eau
dans la cuve comme suit : v = g.h avec g intensité de la pesanteur.
Radioactivité de l’astate 211
L’astate est un élément radioactif qui existe en faible quantité dans la croute terrestre. L’isotope
At
b
de l’astate se désintègre en un noyau de bismuth 207
83 Bi en émettant une particule a X .
1-Donner la composition du noyau 211
85 At .
0
1
a0
e .
E 2 et une sortie S.
3- La courbe de la figure ci-contre représente l’évolution au cours
du temps de l’activité d’un échantillon d’astate contenant
N 0 4.1022 noyaux de 211
85 At à l’instant t 0 .
3-1- Déterminer graphiquement la demi-vie t1/2 du noyau 211
85 At en
t(h)
7,2
14,4
21,6
Electricite
4.75 points
On réalise le montage représenté sur la figure1 comportant :
-un générateur de tension G de f.e.m. U0 10 V ;
K1
-un conducteur ohmique de résistance R 1k ;
K2
R
-un condensateur de capacité C 10 F initialement déchargé ;
- deux interrupteurs K1 et K 2 ;
i
-une bobine d’inductance L et de résistance négligeable.
U0
G
uC
L
C
1- K 2 étant ouvert et K1 fermé :
A un instant choisi comme origine des dates (t = 0) , on ferme
l’interrupteur K1 . K 2 reste ouvert.
4
Figure 1
5
Figure 2
1
E1
E2
X
S
us
u2
- sur l’entrée E2 une tension u2(t) ayant pour expression
u 2 (t) = U0 +s(t) où s(t) = Sm cos(2πfs .t) est la tension
modulante et U0 est la composante continue de cette
tension.
On obtient à la sortie S du multiplieur X une tension
us(t) modulée en amplitude.
On visualise la tension u1(t) sur la voie A de
l’oscilloscope et la tension u2(t) sur la voie B
(figure2).
Données : Sensibilité verticale : 1V / div
jusqu’à l’instant t 2t1/2 .
Exercice 3
0
-5
u1
On applique :
- sur l’entrée E1 une tension u1(t) ayant pour expression
u1 (t) = Pmcos(2πFp .t) .
0
i(10 2 A)
Modulation d’amplitude d’un signal
Pour obtenir un signal modulé en amplitude, on réalise le
montage représenté sur le schéma de la figure 1 où le
multiplieur X est un circuit intégré possédant deux entrées E1 et
Activité a(Bq)
expliquant la méthode utilisée.
3-2-Trouver le nombre de particules ba X émises à partir de t 0
2
la bobine en fonction de l’intensité i du courant.
2-3-1- En exploitant la courbe de la figure 2, déterminer la valeur
de L.(0,75 pt)
2-3-2-Vérifier que la valeur de la période propre du circuit LC est
T0 6,3ms .(0,5 pt)
longueur d’onde 1 de l’onde.
211
85
E m (10 4 J)
2-3- Une étude expérimentale a permis d’obtenir la courbe de la
figure 2 représentant la variation de l’énergie E m emmagasinée par
On ajoute dans la cuve de l’eau de telle façon que la profondeur d’eau devienne h1 4 h . Trouver la
2- Ecrire l’équation de désintégration de l’astate 211 en identifiant
la particule X parmi les particules suivantes : 01 e , 42 He et
Le condensateur étant totalement chargé, on ouvre K1 et on ferme K 2 à un instant choisi comme
nouvelle origine des dates (t = 0) .
3
1-2- Déterminer graphiquement la longueur d’onde de cette onde rectiligne.
Partie II: Transformations nucléaires :
du C (t) 1
U
u C (t) 0 .(0, 5 pt)
dt
1-2- Calculer la valeur de la constante de temps pour le dipôle RC.(0,25 pt)
1-3-Calculer l’énergie maximale E 0 emmagasinée dans le condensateur une fois chargé totalement.(0,5 pt)
On provoque, à l’instant t 0 , une onde rectiligne sinusoïdale de fréquence N 50 Hz à la surface libre
de l’eau contenue dans une cuve à ondes. La profondeur de l’eau
dans la cuve est h.
Le schéma de la figure ci-contre représente la coupe verticale de la
surface de l’eau à un instant t1 .
aebc
Prof.Zakaryae Chriki
2
u2(t)
u1(t)
Sensibilité horizontale : 2 ms / div
1) Définir la modulation d’amplitude.
2) Déterminer graphiquement :
2.1) les fréquences Fp et fs.
2.2) la valeur de Sm et celle de U0.
3) La modulation réalisée dans ce cas sera-t-elle de bonne qualité ? Justifier votre réponse.
5
aebc
Prof.Zakaryae Chriki
Exercice 4
Mecanique
5.25points
La figure ci-contre représente le schéma simplifié d’un jeu qui consiste à faire tomber une petite
bille (C) de masse m dans un petit trou N.
On comprime un ressort et on pose la bille au point O,
puis on lâche le ressort à un instant choisi comme origine
v
(C) i
B i1 B
des dates t = 0. A cet instant, la bille prend une vitesse
O
initiale v 0 horizontale et glisse sur une gouttière OB
x
j1
située à une hauteur h par rapport au niveau horizontal
passant par le point N.
h
oscillations pour différentes valeurs de l'angle m .
Figure (3)
Les résultats obtenus sont donnés dans le tableau suivant :
m (en degré)
5
8
10
12
15
20
t (s)
10,00 10,00 10,00 10,00 10,02 10,04
h = 1,6 m.
1. Etude du mouvement de la bille sur la gouttière horizontale OB
Lors de son mouvement horizontal, la bille subit l’action d’une force de frottement f de la part
de la gouttière. Cette force a une direction horizontale, un sens opposé à celui du mouvement et
une intensité constante f.
Pour étudier le mouvement de la bille, on choisit le repère (O, i ) lié à un référentiel terrestre
supposé galiléen.
1.1. En appliquant la deuxième loi de Newton, vérifier que l’équation différentielle du mouvement de
d2x
f
.
dt 2
m
sans vitesse initiale à l'instant t 0 0 . On mesure la durée t de 10
y
la bille s’écrit ainsi:
Partie 2 : Étude du mouvement d'oscillations d'un système
On constitue avec le système (S) un pendule pesant. Le système peut
tourner sans frottement autour d'un axe ( ') horizontal passant par son
extrémité M (figure 3). On désigne par J ' le moment d'inertie de (S)
par rapport à ( ') .
On écarte (S) de sa position d'équilibre d'un angle m et on l'abandonne
N
En arrivant au point B avec une vitesse v B , la bille quitte
la gouttière et tombe dans le trou N.
Données :
L’accélération de pesanteur: g = 9,8 m.s-2 ;
v0 2 m.s1
;
m = 0,2 kg
;
aebc
Prof.Zakaryae Chriki
0,7
1.2. Sachant que l’accélération de la bille est a x = -3m.s-2 , déterminer l’intensité f de la force de
frottement.
1.3. Ecrire l’expression numérique de l’équation de la vitesse v(t).
On rappelle qu’à l’instant t = 0, la vitesse de la bille est : v v0 .
1.4. Sachant que vB 1m.s1 , déduire la durée tB mise par la bille pour parcourir la distance OB.
2. Etude de la chute libre de la bille
La bille quitte le point B avec une vitesse horizontale vB 1m.s1 et tombe dans le trou N. On
30
10,10
40
10,15
60
10,34
1. Que peut-on déduire de ces résultats ?
2. En appliquant la relation fondamentale de la dynamique de rotation au système (S) , montrer que
M.g.L
l'équation différentielle du mouvement de (S) s'écrit :
.sin 0 .
2.J '
3. Exprimer la période propre T0 pour des oscillations de faible amplitude.
4. Calculer la valeur de J ' (on prend 2 10 ).
) . On choisit le plan horizontal
20
contenant le centre d'inertie du système (S) à l'état d'équilibre comme état de référence de l'énergie
potentielle de pesanteur.
La figure (4) représente les variations en
fonction du temps de l'énergie potentielle de
pesanteur E PP et de l'énergie cinétique E C du
pendule.
5.1. Identifier la courbe qui correspond à E PP .
Justifier.
5.2. Déterminer la valeur de l'énergie
mécanique E m du pendule.
5.3. Calculer la valeur de la vitesse angulaire
1 du pendule à l'instant t1 1,75 s . 5
5. Le pendule effectue des oscillations de faible amplitude (m
étudie le mouvement de chute libre de la bille dans le repère (B, i 1 , j 1 ) lié à un référentiel terrestre
supposé galiléen.(voir figure).
On prend l’instant de passage de la bille au point B comme nouvelle origine des temps t 0 et le
point B comme origine des espaces.
2.1. En appliquant la deuxième loi de Newton, montrer que les équations horaires du mouvement de
1
la bille s’écrivent ainsi : x(t) vB t et y(t) = g t 2 .
2
2.2. En déduire l’expression littérale de l’équation y = f(x) de la trajectoire de la bille.
2.3. Trouver la valeur de l’abscisse x N du point N.
6
50
10,24
Figure (4)
7
page
8
1
aebc
Prof.Zakaryae Chriki
Exercice 1
4 امتحان وطني تجر يبي رقم
المسالك الدولية
mélange réactionnel ayant un volume V0 = 100mL.
Il se produit, sous une température constante, une réaction modélisée par l’équation chimique suivante :
2023 الدورة العادية
- الموضوعمدة الإنجاز
7
المعامل
7 points
À un instant choisi comme origine des dates t = 0, on introduit, en excès, l’éthanoate d’éthyle dans un
ballon contenant une quantité de matière n 0 (HO ) 103 mol d’ions hydroxyde. On obtient un
للبكالور يا
3
Chimie
Etude cinétique d’une réaction chimique
CH3COOC2 H5(aq) HO(aq)
CH3COO(aq)
C2 H5OH(aq)
المادة
الفيز ياء و ال�كيمياء
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية
الشعبة أو المسلك
INSTRUCTIONS GENERALES
1) Dresser le tableau d’avancement de cette réaction et déterminer la valeur de l’avancement final xf
sachant que cette réaction est totale.
(S.m-1)
2) On mesure, à chaque instant, la conductivité du
mélange réactionnel.
0,25
La courbe de la figure1 donne les variations de la
conductivité du mélange réactionnel en fonction du temps. 0,2
La droite (T) représente la tangente à la courbe au point
0,15
d’abscisse t1 = 4 min .
L’expression de la conductivité du mélange réactionnel
en fonction de l’avancement x de la réaction est :
σ = 0, 25 -160.x où est exprimée en S.m-1 et x en mol.
• L’utilisation de la calculatrice non programmable est autorisée ;
0,1
(T)
0,05
2.1) Définir le temps de demi-réaction t1/ 2 .
• Le candidat peut traiter les exercices de l’épreuve suivant l’ordre qui lui convient ;
• L’utilisation de la couleur rouge lors de la rédaction des solutions est à éviter.
2.2) A l’aide de l’expression f (x) et de la courbe de la
0
4
8
12
16
figure1, déterminer la valeur de t1/ 2 .
2.3) Montrer que la vitesse volumique de la réaction à un instant t s’écrit sous la forme : v 3
1
2.4) Déterminer, en mol.m .min , la valeur v1 de cette vitesse à l’instant t1= 4 min.
20
t (min)
1
d
. .
160.V0 dt
L’eau de javel est un produit chimique d’utilisation courante. C’est un désinfectant très efficace
contre les contaminations bactériennes et virales.
Le principe actif de l’eau de javel est dû à l’ion hypochlorite ClO . Cet ion a à la fois un caractère
oxydant et un caractère basique.
Dans cette partie de l’exercice on étudiera :
COMPOSANTES DU SUJET
L’épreuve est composée de quatre exercices indépendants entre eux et répartis suivant les domaines comme
suit :
- des réactions acido-basiques faisant intervenir le couple HClO(aq) / ClO(aq)
.
Etude de quelques solutions aqueuses faisant intervenir le couple HClO(aq) / ClO(aq)
Données : - Toutes les mesures sont effectuées à 250 C ;
- Le produit ionique de l’eau : K e 1014 ;
est : K A 5.108 .
- La constante d’acidité du couple HClO(aq) / ClO(aq)
Exercice 1
Chimie
7 points
Exercice 2
Ondes et Nucléaire
3 points
Exercice 3
Electricite
4.75 points
Exercice 4
Mecanique
5.25points
1
La mesure du pH d’une solution aqueuse(S) d’acide hypochloreux HClO de concentration molaire C
et de volume V donne pH 5,5 .
2-1- Ecrire l’équation chimique modélisant la réaction de l’acide hypochloreux avec l’eau.
2-2-Trouver l’expression de la concentration molaire C en fonction du pH et de K A .Calculer sa valeur.
2-3-On définit la proportion de l’espèce basique ClO dans une solution par :
ClO
KA
éq
. Montrer que (ClO )
.
(ClO )
K A 10 pH
ClO HClOéq
éq
2-4- La courbe de la figure2 représente l’évolution en fonction du pH de la proportion de l’une des
formes basique ou acide (exprimée en pourcentage) du couple HClO(aq) / ClO(aq)
.
2
aebc
Prof.Zakaryae Chriki
2-4-1- A quelle forme du couple HClO(aq) / ClO est associée cette courbe ?
2-4-2-En utilisant le graphe de la figure 1 , identifier , en justifiant, l’espèce prédominante du couple
HClO(aq) / ClO(aq)
dans la
1
100
40
0
pH
0
0
5
concentration molaire Cb Ca . Le pH de la solution obtenue est pH 7,3 .
2-5-1- Déterminer la valeur de la constante d’équilibre K associée à l’équation de la réaction qui se produit .
HClOéq
2-5-2 -En se basant sur le graphe de la figure 2, calculer la valeur du rapport
. Que peut-on en déduire ?
ClO
éq
Partie II :Cadmiage d’une pièce métallique
Pour protéger l'acier contre la corrosion, on peut le recouvrir par un métal, tel que le cadmium.
Le cadmiage consiste à déposer une couche de cadmium par électrolyse sur une plaque.
2
Données : -Le couple : Cd(aq) / Cd(s) ;
-Le faraday : 1F= 9,65.104 C.mol-1 ;
K
- Masse molaire du cadmium : M(Cd) 112, 4g.mol1 ;
A
A
- Masse volumique du cadmium : 8,7 g.cm3 .
Par électrolyse, on veut recouvrir une plaque (P) en
acier par le cadmium. Pour cela on réalise le montage
représenté sur le schéma de la figure ci-contre. On
ferme le circuit à l’instant t 0 . Lors de cette
électrolyse on constate que la plaque en cadmium
s’use.
Plaque(P)
en acier
Plaque en
cadmium
Solution aqueuse acidifiée de cyanure
2
de cadmium Cd(aq) 2CN(aq)
Au cours de l’électrolyse, l’intensité du courant est
maintenue constante I = 2,50 A . La durée de passage
du courant, à partir de l’instant de la fermeture du circuit, est Δt = 30 min .
1-Ecrire l’équation de la réaction qui se produit au niveau de l’anode.
2-Trouver l’expression de la masse du cadmium déposé sur la plaque (P) , en fonction de Δt , I , M(Cd) et F .
Calculer sa valeur.
3-On considère que le cadmium se dépose uniformément et équitablement sur les deux faces de la
plaque(P) d’acier. Celle ci est rectangulaire, de longueur L 10 cm et de largeur 9 cm et d’épaisseur
négligeable.
Déterminer la valeur de l’épaisseur e du cadmium déposé sur une face de la plaque (P) pendant
la durée t .
3
Ondes et Nucléaire
Exercice 2
3 points
Partie I : Ondes : Propagation d’une onde à la surface de l’eau
%
solution (S).
2-5- On mélange un
volume Va d’une
solution d’acide
hypochloreux de
concentration molaire
Ca avec un volume Vb
d’une solution
d’hydroxyde de sodium
Na (aq)
HO(aq)
de
aebc
Prof.Zakaryae Chriki
(aq)
Etude de la diffraction de la lumière :
La diffraction de la lumière met en évidence l’aspect ondulatoire de la lumière. De nombreuses
applications dans des domaines tels que l’industrie, les nouvelles technologies… sont basées
sur ce phénomène.
Cet exercice se propose de déterminer la longueur d’onde d’une radiation émise par une source laser.
Une source laser émet une radiation rouge, de longueur d’onde λ R , vers une fente horizontale de
largeur a = 0,3mm . On observe, sur un écran situé à une distance D = 2 m de la fente, des taches
lumineuses réparties sur une ligne verticale.
La tache centrale a une largeur LR =8,5mm ( figure ci-dessous) .
Ecran
Fente
θ
Laser
L
D
1. On propose quatre expressions pour la longueur d’onde d’une onde lumineuse diffractée.
Choisir, en se basant sur une analyse dimensionnelle, l’expression juste :
a.L.D
a.L
a
2.L
■ λ=
■ λ=
■ λ=
■ λ=
2
2.D
L.D
a.D
2. Recopier le numéro de la question et répondre par vrai ou faux.
Les facteurs, intervenant dans la diffraction d’une radiation, varient ainsi :
2.1. l’écart angulaire θ augmente si la longueur d’onde de la radiation émise augmente.
2.2. la largeur L de la tache centrale est proportionnelle à la largeur a de la fente.
3. Déterminer la longueur d’onde λR de la radiation émise par cette source laser.
4. On remplace la source de radiation rouge par une source de radiation bleue ayant une longueur
d’onde λB = 450 nm. Comparer les largeurs LR et LB des deux taches centrales obtenues
successivement avec les radiations rouge et bleue.
Partie II: Transformations nucléaires
La radioactivité est un phénomène naturel et durable
produit par des sources radioactives. Suite à des
désintégrations en chaine, un nucléide peut se
transformer en d’autres jusqu’à obtention d’un
nucléide stable, formant ainsi une famille radioactive.
Selon leurs durées de vie, ces sources peuvent avoir
des avantages et des inconvénients.
Le diagramme ci-contre donne quelques nucléides
appartenant à la famille radioactive de l’uranium.
Données :
m( 212
Bi ) = 211,94562 u ; m( 20881Tl ) = 207,93745 u ; m( ) = 4, 00150 u ; 1u = 931,5 MeV .c -2
83
Énergies de liaison : E ( 212
; E ( ZA X ) = 1636,1 MeV
82 Pb) = 1654, 2 MeV
212
212
1. Préciser en justifiant, si les nucléides 82 Pb et 83 Bi sont des isotopes. 0,25
2. Identifier en justifiant le type de la désintégration (1) (voir diagramme). 0,5
4
aebc
Prof.Zakaryae Chriki
II- Etude du circuit RLC série
On charge totalement un condensateur de capacité C, puis on le monte en série,
à un instant choisi comme origine des dates (t=0), avec la bobine et le
conducteur ohmique précédents (figure 3).
Les courbes de la figure 4 représentent l’évolution de la tension u C (t) aux
208
noyau de bismuth 212
83 Bi en thallium 81Tl .
6. Soit une source radioactive contenant à l’instant (t0 = 0) , N 0 = 28, 4.1019 noyaux de bismuth 212
83 Bi
radioactif. Pendant la durée de 15min , un compteur a enregistré 4,484.1019 désintégrations.
6.1. Quelle est le nombre de noyaux de bismuth 212
83 Bi présent dans la source à l’instant t 1 = 15 min ?
Electricite
4.75 points
Les parties 1 et 2 sont indépendantes
Les condensateurs et les bobines jouent des rôles fondamentaux dans la plupart des appareils utilisés
dans la vie courante tels que les systèmes d’alarme, les dispositifs de diagnostic médical et les sondes
thermiques…
Cet exercice se propose de déterminer, dans sa première partie, les grandeurs caractéristiques d’une
bobine et d’un condensateur et d’étudier la modulation d’amplitude dans sa deuxième partie.
Partie 1- Etude du dipôle RL et du circuit RLC série
I – Etude du dipôle RL
On réalise le montage schématisé sur la figure 1, constitué des éléments suivants :
- un générateur idéal de tension de force électromotrice E 10 V ;
15
8
7,5
4
0
7,5
12,5
5
t (ms)
- 7,5
-4
- 15
-8
du R R+r
R.E
5,0
+
uR =
dt L
L
3. En déduire, qu’en régime permanent, la tension aux bornes
R.E
5,00
du conducteur ohmique a pour expression : U R
(R r)
4. Calculer la valeur de r. 5,0
5. Déterminer graphiquement la valeur de la constante de
temps . 5,00
i
électrique, déterminer la valeur de la capacité C. (On prend π 2 = 10 ).
3. A l’aide des deux courbes de la figure 4, calculer l’énergie totale Et1 du circuit à l’instant t1 9 ms .
R
uR
Partie 2 - modulation d’amplitude
Pour obtenir un signal sinusoïdal modulé en amplitude, on réalise le montage schématisé sur la
figure 5, où X représente un circuit intégré multiplieur, ayant
E1
deux entrées E1 et E 2 et une sortie S. On applique :
5
- à l’entrée E1 la tension u1 (t) d’expression
(T)
u1
E2
u1 (t) = U0 + U1cos(2πf1.t) avec U 0 la composante continue de
u 2 (t) = U2cos(2πf 2 .t) .
6
La tension, modulée en amplitude, obtenue à la sortie S du
4
X
Figure 5
multiplieur est u 3 (t) . Son expression est : u 3 (t) = 0,1 0,6cos(2π104 .t) + 0,8 cos(6π105 .t)
1. Déterminer la fréquence Fp de l’onde porteuse et la fréquence f m de l’onde modulante.
(1)
0,01
0,02
0,03
Figure 2
t (s)
2. Calculer le taux de modulation m.
3. La modulation est-elle bonne? Justifier votre réponse.
6
S
u3
u2
la tension.
- à l’entrée E 2 la tension u 2 (t) d’expression
(2)
2
t (ms)
uB
E
8
15
(L,r)
uB(V) ; uR (V)
0
10
1. Quel régime correspond aux courbes de la figure 4 ?
2. Sachant que la pseudo-période est approximativement égale à la période propre T0 de l’oscillateur
Figure1
10
Figure 3
Figure 4
K
aux bornes du conducteur ohmique ainsi que celle de la tension u B t aux
2. Montrer que l’équation différentielle vérifiée par la tension
u R (t) s’écrit ainsi:
R
- 22,5
- une bobine d’inductance L et de résistance r ;
l’évolution de la tension u R (t) .Justifier votre réponse. 5,0
C
0
2,5
- un conducteur ohmique de résistance R 40 ;
bornes de la bobine.
(T) représente la tangente à la courbe (2) à l’instant t = 0 .
1. Choisir, parmi les courbes (1) et (2), celle qui représente
(L,r)
uc (V)
22,5
- un interrupteur K.
On ferme l’interrupteur K à un instant choisi comme origine des dates
(t=0). A l’aide d’un système d’acquisition informatisé adéquat, on obtient
les deux courbes de la figure 2 représentant l’évolution de la tension u R (t)
uC
i (mA)
Bi peut-t-il être utilisé pour la datation d’un événement? Justifier.
Exercice 3
i
bornes du condensateur et celle de l’intensité i(t) du courant qui circule dans le
circuit.
6.2. Déterminer la période radioactive (demi-vie) t1/ 2 du bismuth 212
83 Bi .
6.3. Le nucléide de bismuth
6. Vérifier que L 0,5H .
3. Reconnaitre le nucléide ZA X .
A
4. Indiquer en justifiant le nucléide le plus stable parmi 212
82 Pb et Z X .
5. Déterminer, en unité ( MeV ) , la valeur de l’énergie libérée Elibérée = E par la désintégration d’un
212
83
aebc
Prof.Zakaryae Chriki
aebc
Prof.Zakaryae Chriki
Exercice 4
Mecanique
Les parties 1 et 2 sont indépendantes
Partie 1 - Mouvement d’un solide dans le champ de pesanteur
5.25points
Un réalisateur de cinéma souhaite faire réaliser à un cascadeur professionnel un saut pour un
film. Ce cascadeur doit sauter avec sa voiture sur la terrasse d’un immeuble. Pour cela, il utilise
un tremplin distant d’une distance d de l’immeuble et faisant un angle avec l’horizontale.
La masse du système {voiture + cascadeur} est m = 900 kg.
Etant un ancien élève du lycée, ce cascadeur va essayer d’utiliser ses vieux souvenirs de
mécanique pour réussir sa cascade.
Données
La poussée d’Archimède et les forces de frottement de l’air sont négligeables
1
Intensité de l'accélération de la pesanteur: g=9,8m.s-2 .
Distances sur la figure : OE=9m ; EF=20m ; BF=12m
1
sin ().cos ()= . sin (2.)
2
1 : Etude du mouvement entre les points O et B. On considère que :
Le saut commence lorsque le centre d’inertie G de l’ensemble {voiture + cascadeur} est en O.
A t = 0, le centre d’inertie G coïncide avec l’origine du repère O .
A l’instant où les roues de la voiture touchent la terrasse, le centre d’inertie G est en B.
1-1- En appliquant la deuxième loi de Newton sur l’ensemble {voiture + cascadeur}, établir les
équations horaires paramétriques x(t) et y(t) du mouvement du centre d’inertie G entre les
positions O et B.
1-2- Etablir alors l’équation cartésienne y = f(x) de la trajectoire à partir du point O du centre
d’inertie G.
1-3- Le cascadeur souhaite atteindre la terrasse avec une vitesse horizontale. Avec quel point
particulier de la trajectoire doit alors coïncider le point B ?
1-4- Exprimer les coordonnées du sommet S de la trajectoire de G en fonction de et V0 .
1-5- A quelles conditions portant sur et V0 le sommet de la trajectoire coïncide-t-il avec le
point B. La valeur de V0 devra être exprimée en m.s-1.
aebc
Prof.Zakaryae Chriki
Partie 2 - Etude énergétique d’un pendule de torsion
Cette partie de l’exercice se propose de déterminer la constante de
torsion d’un fil métallique à l’aide d’une étude énergétique d’un
pendule de torsion.
Un pendule de torsion est constitué d'un disque homogène S suspendu
en son centre d’inertie par un fil métallique vertical de constante de
torsion C (figure 3).
On fait tourner le disque horizontalement, de sa position d’équilibre,
dans le sens positif d'un angle θm = 0,5rad , autour de l’axe ()
fil métallique
disque S
θ
+
matérialisé par le fil métallique, puis on l'abandonne sans vitesse
()
initiale à un instant choisi comme origine des dates (t = 0). Il effectue
3
Figure
alors, un mouvement de rotation sinusoïdal.
On étudie le mouvement du pendule dans un référentiel terrestre considéré galiléen.
A la date t, l’angle de rotation du disque est
Ept(J)
On prend le plan horizontal confondu avec le
plan du disque comme référence de l'énergie
potentielle de pesanteur, et la position
d’équilibre du disque ( comme référence
0,04
de l’énergie potentielle de torsion.
Le graphe de la figure 4 représente les
0,03
variations de l’énergie potentielle de torsion
Ept en fonction du temps.
0,02
En exploitant la courbe de la figure 4 :
0,01
1. Déterminer l’énergie potentielle de torsion
maximale E pt max et déduire la constante de
torsion C.
2. sachant que l’énergie mécanique E m du
0
0,1
0,2
0,3
0,4
0,5
Figure 4
pendule étudié se conserve, montrer que Em 0,05J .
3. Trouver la valeur de l’énergie cinétique E c1 du pendule à l’instant t1 = 0,3s .
1-6- Définir la chute libre.
7
support
8
0,6
t (s)
page
1
– الموضوع2022 الدورة العادية- امتحان وطني تجر يبي البكالور يا
5 امتحان وطني تجر يبي رقم
6
للبكالور يا
المسالك الدولية
.من انجاز ذ
محمد سعيد
3
مدة الإنجاز
7
المعامل
EA-01
2
6
Chimie :
Groupe scolaire AZ
2022 الدورة العادية
- الموضوع-
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية- الفيز ياء: مادة-
γ
الصفحة
Première partie (4,5 points) : Réaction d’esterification :
La formule semi-développée d’un ester est :
le groupement R peut être une chaine carbonée ou un atome d’hydrogène, par contre le groupement R0 est forcément une chaine carbonée.
المادة
الفيز ياء و ال�كيمياء
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية
Pour étudier la réaction d’estérification, on réalise dans une fiole jaugée un mélange formé de
0,500 mol d’acide éthanoïque CH3 COOH et 0, 500 mol de butane-2-ol et quelques gouttes
d’acide sulfurique.
Le volume total du mélange est V = 100 mL.
الشعبة أو المسلك
Après avoir agité le mélange on le partage en quantités égales dans 10 tubes à essais numérotés
de 1 à 10 et on les scèle puis on les met à t = 0 dans un bain marie de température constante
60◦ C.
Données :
- Densité de l’alcool utilisé : d = 0, 79 ;
- La masse molaire de l’alcool : M(al) = 74, 0 g.mol−1 ;
- La masse molaire de l’acide : M(ac) = 60, 0 g.mol−1 ;
- La constante pK A du couple CH3 COOH/CH3 COO− à 25◦ C : pKA = 4, 8 ;
- Le produit ionique de l’eau à 25◦ C : pKe = 14.
INSTRUCTIONS GENERALES
• L’utilisation de la calculatrice non programmable est autorisée ;
• Le candidat peut traiter les exercices de l’épreuve suivant l’ordre qui lui convient ;
• L’utilisation de la couleur rouge lors de la rédaction des solutions est à éviter.
0.5
0.5
COMPOSANTES DU SUJET
0.5
1 Réaction d’estérification
a En utilisant les formules semi-développées , écrire l’équation de la réaction d’estérification qui se produit dans un tube à essai et donner le nom de l’ester formé .
b Calculer le volume de l’alcool et la masse de l’acide qui ont été mélangés dans la fiole
jaugée.
c Dresser le tableau d’avancement de la réaction qui a lieu dans chaque tube à essai et
exprimer la quantité de matière de l’ester formé n(ester)t à un instant donné t en fonction de
la quantité de matière d’acide restant n(ac)r
2 Dosage de l’acide restant .
Pour doser l’acide restant à un instant t , dans le tube à essai numéro 1 on le verse dans un
erlenmeyer jaugé puis on le dilue en ajoutant de l’eau distillée froide jusqu’à obtenir un mélange
(S) de volume V = 100 mL . On prend 10mL du mélange (S) et on le verse dans un bêcher
et on le dose avec une solution d’hydroxyde de sodium de concentration Cb = 1, 0 mol.L−1 .
(on ne tient pas compte , lors du dosage, des ions H3 O+ provenant de l’acide sulfurique )
L’épreuve est composée de quatre exercices indépendants entre eux et répartis suivant les domaines comme
suit :
0.25
Exercice 1
Chimie
7 points
0.25
Exercice 2
Nucléaire
3 points
0.5
Exercice 3
Electricite
5 points
Exercice 4
Mecanique
5points
0.5
Écrire l’équation de la réaction du dosage.
Donner
l’expression
de
la
constante
d’acidité
KA
du
couple
CH3 COOH/CH3 COO− en fonction des concentrations.
c Déduire la constante d’équilibre K associée à l’équation de la réaction du dosage et
calculer sa valeur à 25◦ C.
d Le volume de la solution d’hydroxyde de sodium nécessaire pour obtenir l’équivalence
est Vb = 4, 0 mL.
Déduire la quantité de matière d’ester formé dans le tube à essais numéro 1 .
a
b
3 Sens d’évolution du système chimique.
Le dosage de l’acide restant dans les tubes précédents à différents instant a permis de tracer la
courbe x = f (t) dont x est l’avancement de la réaction d’estérification, à un instant t, dans
un tube à essai. (figure 1)
– الموضوع2022 الدورة العادية- امتحان وطني تجر يبي البكالور يا
1
EA-01
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية- الفيز ياء: مادة-
γ
0.5
الصفحة
3
6
calculer la constante d’équilibre K 0 associée à la réaction d’estérification.
b calculer la quantité de matière d’acide éthanoïque na qu’il faut ajouter à un tube à
essai dans les mêmes conditions expérimentales précédentes pour que le rendement final de la
synthèse de l’ester à la fin de la réaction soit r = 90%.
Deuxième partie (2,5 points) : Électrolyse :
a
– الموضوع2022 الدورة العادية- امتحان وطني تجر يبي البكالور يا
a
0.5
b Calculer l’activité de l’échantillon à l’instant t = 3.109 ans.
0.5
0.5
0.5
•Masse molaire :M (Cr) = 52 g · mol−1
• Constante ale Faraday : F = 9, 65.104 c/mol
•Le volume molaire du gaz dans les conditions de l’expérience :
0.5
2 Écrire l’équation de la réaction à chaque électrode et l’équation bilan lors de l’électrolyse.
0.75
3 Calculer la masse m du chrome déposé sur la cathode pendant la durée ∆t.
0.75
4 Calculer Le volume V du gaz formé pendant la durée ∆t.
3 Des analyses faites sur une roche ancienne montre qu’elle contient une masse m1 = 1g
d’Uranium 238 , et une masse m2 = 10mg de Thorium 234 . On suppose que le thorium dans
cette roche provient uniquement de la désintégration de l’uranium 238 avec le temps. !
t1
m2 · M (U )
2
a Montrer que l’âge de la roche minérale est : t =
· ln 1 +
ln(2)
m1 · M (T h)
b Calculer t en ans sachant que M 234 Th = 234 g · mol−1 et M 238 U = 238g.
mol−1
c Calculer l’énergie libérée par la roche depuis sa formation jusqu’à’à l’instant t.
• Générateur idéal de courant
• Condensateur de capacité C, initialement déchargé.
• Conducteur ohmique de résistance R.
• Micro-ampèremètre.
• Interrupteur K.
On place l’interrupteur K en position (1) à un instant de
date t = 0. Le microampèremètre indique I0 = 20µA.
Vm = 25L · mol−1
1 Parmi les deux électrodes A et B, préciser l’anode. Justifier la réponse.
4
6
Physique :2
Les deux parties I et II sont indépendantes.
I- On réalise le montage expérimental ci-contre constitué des éléments suivants :
0.5
EA-01
9
Montrer que la demi-vie de 238
92 U est t1/2 = 4, 5.10 ans.
0.5
+
−
On réalise l’électrolyse d’une solution aqueuse de nitrate de chrome III Cr3(aq
) + 3NO3(aq ) ,
en mettant cette solution dans un électrolyseur et en faisant circuler un courant continu d’intensité I = 50mA entre les deux électrodes (A) et (B ) de l’électrolyseur pendant la durée
∆t = 1h30min.
On observe pendant l’électrolyse la formation d’un dépôt métallique de chrome sur l’électrode
(A) et un dégagement gazeux au niveau de l’électrode (B ).
+
Données : •Les couples Ox/Red : Cr 3(aq
et O 2(g ) /H 2 O (l) et H 2 O (l) /H 2(g )
) /Cr (s)
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية- الفيز ياء: مادة-
γ
الصفحة
Un système de saisie informatique convenable permet d’obtenir la courbe représentant les variations de la charge q du condensateur en fonction de la tension uAB entre ses bornes( figure
2 ).
Physique :1
Les géologues et les astronomes utilisent la méthode de la datation d’uranium-thorium pour
déterminer l’âge des roches anciennes et des météorites.
Le but de cet exercice est l’étude du nucléide uranium 238
92 U, et la détermination approchée de
l’âge d’une roche volcanique. Données :
0.5
234
El (X ) = 28, 28MeV; El 238
92 U = 1754, 67MeV; El 90 Th = 1178, 50MeV
238
1 Le nucléide d’uranium 92 U se transforme en nucléide de thorium 234
90 Th, trouver la particule
émise et définir ce type de radioactivité.
2 La figure ci-dessous représente les variations de ln(N ) en fonction du temps t, avec N le
nombre de noyaux d’uranium 238 restant dans un échantillon à l’instant t.
0.25
0.5
0.5
0.5
0.75
1 Déterminer graphiquement la valeur de la capacité C du condensateur.
2 Déterminer la durée nécessaire pour que la tension aux bornes du condensateur prends la
valeur uc = 6 V.
3 Quand la tension aux bornes du condensateur prends la valeur uc = U0 , on bascule
l’interrupteur K en position (2) à un instant choisi comme nouvelle origine des dates (t = 0).
La courbe de la figure -3-représente les variations de ln (uc ) en fonction du temps.
a Établir l’équation différentielle vérifiée par la tension uc(t)
La solution de cette équation différentielle est uc (t) = U0 · e−kt .
Trouver l’expression de k en fonction de R et C.
c En exploitant la courbe, déterminer les valeurs de U0 et R.
b
– الموضوع2022 الدورة العادية- امتحان وطني تجر يبي البكالور يا
γ
0.75
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية- الفيز ياء: مادة-
الصفحة
EA-01
5
6
– الموضوع2022 الدورة العادية- امتحان وطني تجر يبي البكالور يا
γ
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية- الفيز ياء: مادة-
الصفحة
EA-01
6
6
d Soient t1 et t t2 deux instants où la tension uC arrive aux valeurs uc (t1 ) = 90%U0
et uc (t2 ) = 10%U0 .
Calculer l’énergie dissipée par effet joule dans le circuit entre ces deux instants t t1 et t 2 .
II- on réalise le montage de la figure 4 qui comprend :
• Un générateur de force électromotrice E = 12 V et dont
la résistance interne est négligeable.
• Un conducteur ohmique de résistance R = 200Ω.
• Une bobine d’inductance réglable L et de résistance
négligeable.
• Un condensateur de capacité C 0 = 0, 5µF.
• Un interrupteur K à deux positions.
Lorsque le condensateur est complètement chargé, on bascule l’interrupteur dans la position
(2) à un instant considéré comme origine du temps et on visualise la courbe représentant les
variations de la tension aux bornes du condensateur uc’ en fonction du temps (figure 5) l’aide
d’un dispositif approprié.
1
0.75
0.5
0.75
0.75
0.5
0.25
0.25
0.25
0.5
1 Établir l’équation différentielle que vérifie la tension uc0 (†) aux bornes du condensateur en
fonction du temps.
2 Déterminer graphiquement la valeur de la pseudo-période T .
3 On considère que la valeur T est égale à la période propre To de l’oscillateur LC. En déduire
la valeur L.
4 Quelle est la forme de l’énergie emmagasinée dans le circuit à l’instant t = 6 ms. Justifier.
5 Sachant qu’à l’instant t = 4 ms la valeur l’énergie totale emmagasinée dans le circuit vaut
ET = 7, 5µJ, et en exploitant la courbe de la figure-5-, déterminer la valeur de la tension UR
aux bornes du conducteur ohmique à cet instant.
Physique :3
On considère un système (S ) formé de :
•Une poulie homogène de rayon r = 5cm pouvant tourner autour d’un axe ∆.
•Une tige homogène M N de longueur M N = 2L = 40cm , de milieu O est fixée sur le
diamètre de la poulie comme l’indique la figure ci-dessus.
Le moment d’inertie du système {P oulie + T ige} est J∆ .
•Un fil inextensible de masse négligeable enroulé sur la poulie. À l’autre extrémité est accroché
un solide (C ) de masse m = 0, 8Kg pouvant glisser sans frottement le long de la ligne de
plus grande pente d’un plan incliné faisant un angle α = 30◦ avec l’horizontale.
On considère le fil ne glisse pas sur la gorge de la poulie.On lâche le système (S ) sans vitesse
initiale à l’instant t = 0.
On repère la position de solide C, à un instant t, par l’abscisse x dans le repère (O.~i), et on
considère que xG = 0 à l’instant t = 0.
0.5
0.75
1 En réalisant une étude dynamique , trouver l’expression de l’accélération du solide (C ) en
fonction de α, r, g, m,et J∆ .
2 La figure (1) représente les variations de carré de la vitesse du solide (C ) en fonction de
x :V 2 = f (x)
a Déterminer la valeur de a et déduire la valeur de l’accéleration angulaire θ̈ de système
{P oulie + T ige}
b Calculer la valeur de J∆ .
3 Au point B d’abscisse xB = 0, 8m le solide (C ) se détache du fil et continue son mouvement
de chute dans le champ de la pesanteur pour tomber en un point I sur le plan horizontal (π )
situé à une distance h = 1m du point B.
−−→ −
−
→
a Déterminer dans le repère (BX · BY )les coordonnées du point I.
b Calculer la vitesse linéaire de l’extrémité M de la tige juste après le détachement de
solide C du fil.
4 Quand le solide (S) s’est détaché du fil, la poulie a effectué plusieurs tours avant de s’arrêter
sous l’effet d’un couple de frottement de moment Mc = −7, 5 · 10−2 N .m :
a Calculer l’accélération angulaire θ̈ de système {P oulie + T ige} .
b Quel est le nombre de tours effectués par le système {P oulie + T ige} ?
page
8
1
aebc
Prof.Zakaryae Chriki
Exercice 1
5 امتحان وطني تجر يبي رقم
Dans un ballon vide , on verse un volume VA =75,0ml dune solution concentrée d’acide
Chlorhydrique(H3O+ + Cl−) de concentration en ions oxonium CA=0,4mol/L . À l’instant initial, on
introduit une masse de m=0,6g de Zinc en poudre . Très rapidement, on ferme ce ballon avec un
bouchon percé qui permet de relier, par un tuyau, le contenu du ballon avec un manomètre. On note,
régulièrement, la valeur de la pression indiquée sur le manomètre figure 1.
المسالك الدولية
2023 الدورة العادية
- الموضوعمدة الإنجاز
7
المعامل
7 points
Les parties 1 et 2 sont indépendantes
للبكالور يا
3
Chimie
المادة
الفيز ياء و ال�كيمياء
• Le candidat peut traiter les exercices de l’épreuve suivant l’ordre qui lui convient ;
Données :
•
La masse molaire du zinc : M(Zn)=65,4g/mol
•
Équation d’état des gaz parfaits : P.V = 𝒏𝑮.R.T , nG correspondant à la quantité de matière de gaz
•
Les couples interviennent sont : Zn2+ /Zn(S) et H3O+ / H2 (g) .
•
On considère que tous les gaz se comportent, au cours de l’expérience, comme des gaz parfaits
1 . Citer une technique qui permet de suivre l’évolution temporelle de cette réaction.
2 . Ecrire l’équation bilan de la réaction étudié.
3 . Calculer ni(H3O+) la quantité de matière initiale des ions oxonium et ni(Zn) la quantité de matière
initiale de zinc .
4. Dresser le tableau d’avancement de cette transformation , en considérant x comme l’avancement de
cette transformation et xmax son avancement maximal . Quelle le réactif limitant.
5. En appliquant l’équation d’état d’un gaz parfait et en utilisant le tableau d’avancement , trouver l’
expression de l’avancement x à l’instant t en fonction de R, T, V et P la pression de H2 à l’instant t .
• L’utilisation de la couleur rouge lors de la rédaction des solutions est à éviter.
6. Soit Pmax la pression maximale de H2 , montrer que 𝐱(𝐭) = 𝒙𝒎𝒂𝒙 .
شعبة العلوم التجر يبية مسلك العلوم الفيز يائية
الشعبة أو المسلك
INSTRUCTIONS GENERALES
• L’utilisation de la calculatrice non programmable est autorisée ;
𝑷(𝒕)
𝑷𝒎𝒂𝒙
7. Cette expérience nous a permis de tracer la courbe dans la figure 2 qui représente la variation de P(t)
la pression de H2 en fonction du temps t .
7.1.Montrer que l’expression de la pression 𝑷(𝒕) à l’instant de t1/2 s’écrit :𝑷(t1/2) =
la valeur de t1/2 .
COMPOSANTES DU SUJET
7.2. Monter que l’expression de la vitesse volumique s’écrit: 𝒗(t) =
L’épreuve est composée de quatre exercices indépendants entre eux et répartis suivant les domaines comme
suit :
Exercice 1
Chimie
7 points
Exercice 2
Ondes
3 points
Exercice 3
Electricite
4.75 points
Exercice 4
Mecanique
5.25points
1
𝑷𝒎𝒂𝒙
,et déduire
𝟐
𝒙𝒎𝒂𝒙 𝒅𝑷(𝒕)
𝑽.𝑷𝒎𝒂𝒙
𝒅𝒕
7.3.Vérifier que la valeur la vitesse volumique de la réaction à l’instant t0 =0 est :
𝒗𝟎= 1,93. 10-3 mol.L-1.min -1
1
2
Pour synthétiser l’éthanoate d’éthyle, un technicien de laboratoire a préparé une série de tubes à
essai contenant chacun un volume V = 34,5 mL d’éthanol pur et 0,6 mol de l’acide éthanoïque.
Après avoir scellé ces tubes, il les a placés simultanément dans un bain-marie régulé à 100°C .
Pour suivre l’évolution du système chimique aux divers instants t, le technicien sort un tube du
bain- marie et le place dans de l’eau glacée, puis il dose la quantité d’acide restante dans ce tube
par une solution d’hydroxyde de sodium de concentration connue.
2
aebc
Prof.Zakaryae Chriki
La courbe de la figure ci-dessous représente l’évolution de la quantité de matière n de l’acide
éthanoïque restante dans le tube en fonction du temps.
Avec P la pression du gaz au repos 𝜸 = 1,4 et ρ=
𝒎
v
la masse volumique du gaz
les valeurs sont en bon accord avec Les valeurs déterminées expérimentalement on admet que ce gaz vérifie la
loi des gaz parfaits c’est-à-dire : P .V= n.R .T
n (mol)
Données :
- La masse molaire de l’éthanol:
M (C2 H 5OH) = 46 g.mol - 1 ;
aebc
Prof.Zakaryae Chriki
Où V et le volume occupé par une masse m de gaz de masse molaire M sous la pression P à la température
absolue T.
0,4
- La masse volumique de
l’ éthanol : ! = 0,8g.cm-3 .
1 . L’onde sonore est une onde:
❖ Electromagnétique ou mécanique ? Justifier la réponse.
❖ Transversale ou longitudinale ? Justifier la réponse.
0,2
2 . Montrer que l’expression de la célérité s’écrit sous la forme suivante : 𝐕 =
!
"
#$
#%
t (h)
1 .Quel est l’objectif de l’utilisation de l’ eauglacée avant la réalisation du dosage?
2 .La figure ci-dessous représente le montageexpérimental utilisé pour effectuer un dosageacidebase. Nommer les éléments numérotés sur cette figure.
(1)
𝜸.𝑹.𝑻
M
Cette relation peut être utilisée pour répondre à les questions suivantes .
3 . Comparer sans calcul la célérité du son dans le gaz dihydrogène H et là célérité du son dans le gaz
2
dioxygène O2 à la température 20 °c sachant que M(O2)> M(H2) .
4 . La célérité du son dans l'air à la température θ est
Fig:1
V = 340m /s .Calculer T sachant que la masse molaire
de l'air est M(air)=29g/mol et R = 8,31 SI.
5 . Pour comparer les célérités des ultrasons dans l'eau et
d
dans l'air on utilise le dispositif suivant figure 1 :
Les ultrasons sont des ondes acoustiques dans la célérité et
la même que celle du son audible.
les deux émetteurs d'ultrasons sont synchronisés.
Les voix À et B sont reliés à la carte d'acquisition
d'un ordinateur ; elles ont le même coefficient d’amplification. on a obtenu les signaux suivants
pH-m tre
4.74
(2)
5.1.Quelle est la différence entre onde sonore et onde ultrasonore ?
(3)
Au cours d'une expérience on a trouvé la valeur
3 .Montrer que le mélange réactionnel dans chaque tube est équimolaire à l’état initial.
4 .Ecrire, en utili sant les formules semi développées, l’ équation de la réaction produite dans chaquetube.
5 . Déterminer, à l’équil ibre, la composition du mélange réactionnel dans chaquetube.
6 . Montrer que la valeur de la constante d’équilibre est K = 4 .
7 . Le technicien a réalisé de nouveaula même expérience à la même température, en mélangeant
cette fois dans chaquetube 0,4mol d’éthanol et 0,1 mol d’acide éthanoïque.
Trouver, dans ce cas, le rendement r de la réaction .
8 . Pour obtenir 100% comme rendement de la synthèse d’éthanoate d’éthyle, le technicien utilise
l’ anhydride éthanoïque au lieu de l’acide éthanoïque.
Ecrire, en utili sant les formules semi développées, l’ équation de la réaction produite.
1t2`+B+2 k
PM/2b
j TQBMib
3DUWLH,2QGHV
Un modèle de calcul de la célérité du son dans un gaz diatomique ou¶air
dans
donne
l la relation suivante :
½ä|
!
L
3
Fig:2
du retard temporel τ entre les deux ondes reçues
t = 1,14ms pour une distance d = 50cm entre l'émetteur et
le récepteur .
5.2.En exploitant la figure 2 déterminer la sensibilité
horizontale Sh
5.3. Montrer que l’expression de t s’écrit sous la forme:
τ = d .(
1
1
- ).
Vair Veau
5.4.Calculer Veau la célérité des ultrasons dans l'eau. On donne Vair = 340 m/s.
Exercice 3
Electricite
4.75 points
Les parties 1 ,2 et 3 sont indépendantes
1. En utilisant un générateur de courant
Un premier groupe d’élèves d’une classe réalise, sous les directives du professeur, le montage
expérimental de la figure 1 (page suivante) constitué des éléments suivants:
- un générateur idéal de courant qui alimente le circuit par un courant électrique d'intensité I0 ;
- un conducteur ohmique de résistance R ;
- deux condensateurs (c1) et (c2) montés en parallèle, respectivement de capacités C1 = 7, 5 mF et C 2 inconnue ;
4
aebc
Prof.Zakaryae Chriki
- un interrupteur K.
À l’instant t 0 = 0 , un élève ferme le circuit. A l'aide d'un système d’acquisition informatisé, le
groupe d’élèves obtient la courbe des variations de la charge q du condensateur équivalent à
l’association des deux condensateurs (c1) et (c2) en fonction de la tension u AB (figure 2).
q(mC)
1
K
I0
A
C1
Pour déterminer l’inductance L d’une bobine de résistance négligeable, on
utilise le montage représenté dans la figure (1), comprenant cette bobine, un
conducteur ohmique de résistance R=1,5.103 Ω , un GBF qui délivre une
tension triangulaire de période T et un interrupteur K . On ferme
l’interrupteur K à l’instant t0 =0 , et on visualise à l’aide d’un oscilloscope
la tension uAM(t) aux bornes de la bobine, et la tension uBM(t) aux bornes du
conducteur ohmique. On obtient l’oscillogramme de la figure (2)
- sensibilité verticale des deux voies de l’oscilloscope : 2V.div-1 .
- balayage horizontale 0,2 ms.div-1
1. Quel est le rôle de la bobine lors de la fermeture du circuit ?
L du
2. Montrer que les tensions uAM(t) et uBM(t) sont liées par la relation uAM=- . BM.
R dt
3. En utilisant la figure 1déduire
.
la valeur de L
2
C2
20
R
10
B
0
1
u AB (V)
2
1. Quel est l’intérêt de monter des condensateurs en parallèle ?
2. En exploitant la courbe de la figure 2, déterminer la valeur de la capacité C eq du
condensateur équivalent aux deux condensateurs (c1) et (c2) .
3. En déduire la valeur de la capacité C 2 .
2. En étudiant la réponse du dipôle RC à un échelon de tension
Un deuxième groupe d’élèves de la même classe réalise le montage représenté par la figure 3 constitué par :
- Un générateur idéal de tension de force électromotrice E ;
- Un conducteur ohmique de résistance R = 1600 W ; - Le condensateur précédent de capacité C 2 ;
- Un interrupteur K à double position.
Après avoir chargé totalement le condensateur, un élève bascule l’interrupteur K sur la position
(2) à l'instant t 0 = 0 . A l'aide d'un système d’acquisition informatisé, le groupe d’élèves obtient la
courbe des variations de la tension uC2 (t) aux bornes du condensateur (figure 4).
K
(1)
3
(2)
4
u C2 (V)
9
E
C2
u C2
.
R
i
0
8
4
12
t (ms)
1.Établir l'équation différentielle vérifiée par la tension uC2 (t) au cours de la décharge du condensateur.
-
aebc
Prof.Zakaryae Chriki
t
2.La solution de cette équation différentielle est de la forme u C2 (t) = E.e t . Trouver
l’expression de la constante de temps t en fonction de R et C 2 .
3. Déterminer de nouveau la valeur de la capacité C 2 .
L
GBF
M
R
B
2
YB
de deux condensateurs , montés en série, de capacité C 10 F et C0 .Déterminer la valeur de C0 .
L’étude électrique ou énergétique de quelques dipôles permet de déterminer certains paramètres
qui les caractérisent, et de se rendre compte de leurs effets sur les phénomènes dont ces dipôles
sont siège.
6
1
A
YA
3- Modulation d’amplitude d’un signal sinusoïdal
Afin d’obtenir un signal modulé en amplitude, on utilise un circuit intégré multiplieur X (fig.6).
On applique à l’entrée :
- E1 : la tension u1 (t) s(t) U0 avec s(t) Sm .cos(2.fS.t) représentant le signal informatif et
U 0 une composante continue de la tension.
E1
- E 2 : une tension sinusoïdale représentant la porteuse
X
u 2 (t) Um .cos(2.FP .t) .
E2
;
u
(t)
La tension de sortie u s (t) obtenue est us (t) k.u1 (t).u 2 (t)
1
u 2 (t)
k est une constante qui dépend du circuit intégré X.
1
Rappel: cos(a).cos(b) cos(a b) cos(a b)
2
Amplitude(V)
1. Montrer que u s (t) s’écrit sous la forme :
A.m
A.m
u s (t)
.cos(2.f1.t) A.cos(2.f 2 .t)
.cos(2.f 3.t)
2
2
où m est le taux de modulation et A une constante.
2. La figure 7 représente le spectre de fréquences formé
1
de trois raies de la tension modulée u s (t) . Déterminer m
et la fréquence f s .La modulation est-elle bonne ?
0,5
3. Pour une bonne réception du signal modulée, on utilise
0
un circuit bouchon(circuit d’accord) formé d’une bobine
5
5,5
6
d’inductance L0 60 mH et de résistance négligeable et
2. Le dipole RL
5
i
6 ئ
S
u s (t)
7
f(kHz)
aebc
Prof.Zakaryae Chriki
Exercice 4
Mecanique
5.25points
Partie II : Détermination du rayon de l’orbite de la lune autour de la terre.
Le but de cette partie est de déterminer la distance Terre-Lune à partir de l’étude du mouvement de la
Terre autour du Soleil et du mouvement de la Lune autour de la Terre.
Dans chaque cas, l’étude du mouvement se fait dans un référentiel considéré galiléen.
On considère que :
- le Soleil, la Terre et la Lune présentent une répartition de masse à symétrie sphérique.
- la Lune n’est soumise qu’à la force de gravitation universelle appliquée par la Terre .
- la Terre n’est soumise qu’à la force de gravitation universelle appliquée par le Soleil .
Données :
La période de révolution du centre d’inertie G de la Terre autour du soleil : T 365, 25 jours ,
La période de révolution du centre d’inertie G ' de la Lune autour de la Terre : T ' 27,32 jours ,
On considère que :- dans le référentiel héliocentrique , la trajectoire du centre G est assimilée à un
Partie I :
Zakaryae chriki et Myriam ont décidé de vérifier expérimentalement la déduction de Newton, pour cela ils
ont utilisé deux billes en verre (a) et (b) ayant le même volume V et la même masse m .
Ils abandonnent les deux billes au même instant t 0 et sans vitesse initiale d’une même hauteur h
du sol (fig 1) .
1
; l’air
- Zakaryae chrikia lâché la bille (a) dans
- Myriam a lâché la bille (b) dans un tube transparent contenant
de l’eau de hauteur h (fig 1).
A l’aide d’un dispositif convenable Zakaryae et Myriam ont obtenu
les résultats suivants :
- La bille (a) atteint le sol à l’instant t a 0, 41s ;
- La bille (b) atteint le sol à l’instant t b 1,1s .
Données : accélération de la pesanteur
m 6,0.103 kg
;
O
cercle de rayon R=1,49.108 km centré sur le centre d’inertie du soleil .
eau
-dans le référentiel géocentrique, la trajectoire du centre G ' est assimilée à un cercle
de rayon r centré sur le centre G .
M
On note : M la masse du Soleil, m la masse de la Terre et m' celle de la Lune. On prend
3,35.10 5
m
1- Définir le référentiel géocentrique.
2- Choisir la proposition juste parmi les affirmations suivantes :
a-La constante de gravitation universelle s’exprime en m.s2 .
b-Le vecteur accélération du centre G de la terre est tangent à son orbite circulaire autour du Soleil.
c-Dans un mouvement circulaire uniforme, le vecteur accélération a une direction constante.
d-La vitesse du mouvement circulaire uniforme d’une planète autour du Soleil ne dépend pas de la
masse de la planète.
3-Donner l’expression vectorielle de la force d’attraction gravitationnelle exercée par le soleil sur la
Terre, dans la base de Freinet (u , n ) .
4-En appliquant la deuxième loi de Newton, montrer que le mouvement du centre d’inertie G de la
Terre autour du soleil est circulaire uniforme.
5-Etablir la relation traduisant la troisième loi de Kepler relative au mouvement du centre d’inertie G
de la Terre autour du soleil.
6 -Trouver l’expression du rayon r en fonction de m , M , T , T ' et R et calculer sa valeur.
g 9,80m.s2 ;
V 2,57.106 m3 ;
3
la masse volumique de l’eau 1000kg.m .
On suppose que la bille (a) n’est soumise au cours de sa chute dans
y
l’air qu’ à son poids.
(b)
est soumise au cours de sa chute dans l’eau à :
La bille
- Son poids d’intensité P mg ; - La poussé d’Archimède d’intensité FA .g.V
le sol
;
2
- La force de frottement fluide d’intensité f K.v avec K une constante positive et v vitesse du
centre d’inertie de la bille .
1- Étude du mouvement de la bille a dans l’air
1. Établir l’équation différentielle que vitrifie la vitesse du centre d’inertie de la bille (a)
au cours de la chute.
2. Calculer la valeur de la hauteur h .
2- Étude du mouvement de la bille
b dans l’eau
Myriam a enregistré à l’aide d’un dispositif convenable L’évolution de la vitesse de la bille (b) au
cours du temps ; Elle a obtenu le graphe représenté dans la figure 2.
3. Établir l’équation différentielle vérifiée par la vitesse du centre d’inertie de la bille (b) au cours de
sa chute dans l’eau en fonction des donnés du texte.
4. A l’aide du graphe de la figure 2,déterminer la valeur
de la constant K.
5. Trouver l’expression de l’accélération a0 du centre
1
aebc
Prof.Zakaryae Chriki
v(m.s1 )
2
0,85
d’inertie de la bille ( b) à l’instant t = 0 en fonction de
0,6
g , V , et m . Déterminer le temps caractéristique
du mouvement de la bille ( b) .
0,4
3- la différence entre les durées de chute
Zakaryae chriki et Myriam ont répété leur expérience dans les
Conditions précédentes mais cette fois la hauteur
0,2
D’eau dans le tube est H = 2h .Zakaraye et Myriam ont libéré
des deux billes (a) et (b) sans vitesse initiale au même
0
instant t 0 du même hauteur H = 2h.
t(s )
0,2
0,4
0,6
0,8
1
1,2
6.Exprimer t qui sépare l’arrivé des deux billes (a) et (b) au sol en fonction de t a , t b , g, h et v .
Calculer la valeur de t
7
8
llmi.llM
1'11rtù· J: .fr11tlulsr l'arfimr de pom111N 111fi1·cs :
111.
Clzùnie (7 points)
f :,:t/uwoale de J-méll1j•llmtyle es/ 1111 eslar prése11/e 11olamme11/ dans les 0111111es 111Îlres.
5 011 udt•lfr lfOrt:uble el stî frrible /oxù·ité per111elle11I te
Les /m,:r Jutr/Ù!s sont i11rh1J1emln11tcs.
b
f>,,rtù· 1 .· l~twlc dl! la .rnlu1io11 d'acù/<' ad {vlwlio lùpœ ,·
1
I.
i S11
ulili.ré daus de 110111urcu.--:
L'acide ,u·/ (1•/solitylù111c dcfo111111/c C.,f/ 0 0 ◄ ,·011r,11c sous le 110111 de l'aspiri11c es/
métlirrmttm ls pour ses p,vpriétés a111algiq11os el tt11li-ùiflm11111nloires.
278 ml d'e\\l cli s1illée pour
: 011 cli ~~,.,1 t1 t 1111 ço mprimé cl'llspirine de· mns:-e m == 500 mg clnns le ,·olume V =
C1 .
1
co11c<·1llrntio1
de
)
S
lll'
11n:tyls11licyü
d'ncid1..·
1
; o l>tenir 11 11 t· :- ul uti o11 ,1t1111..•mc1
: L:1 co11du n iYi 1é de l:1 solntion (S 1) Ynu'. o = 64 mS m - •
: ll!ll.mi...a_;_
.;. :-1:, ,,c molnin.· d'ncicle nc~cyhnlicylique: M(C9 11 0 O4 ) == 180 D· mol-
·
0
•
((fr).
0.2:i pt
0."":i pt
l pt
co11ce11trn tiou C2 •
.\ fo ntrer gne le t:mx d'n-n1nceme nt finnl
Don
Co1J1posé
0.2.5 pt
0,8
1. L :rire l'égn:Hion chimique modélisnnt ln tmnsformntion nynnt lien entre l':1cide (A) et l'nlcool (B)
rn 11tilis:1nt les fommles semi dé,eloppées. Donner le nom de l':1cide {A) et de l':1lcool (B) .
.).
f
On fefoit ln même expérience nnon•tenu, on mélnnge le Yolume V' 0 , = 57, 2 mL cle l'ncide (A)
:1\·,·c Je même Yolume Ya 1
= 22 mL de l':llcool (B).
' ..: . Après :1~rntion et .refroidissement du mélnnge, on sèche le solide- obtenu (Ester) er on
rnt"s11rr sa tn,l$Sf', on trouve alors m 0 P 23,4 [J.
=
C:1lcnler l:i v:1lenr exp~rimentnle rexp du re nclf'menr, et comp:uer certf' \·:1lenr :n-ec ct'lle rlf' h
gnes tio n 3.1. Comment expliquer ln différence ?
1
i À3
-
~-,-or,__..-_..~-rr-
.
= Àcr = 7, 63
=i=·n=::ts)~==============~ -j
if'liys·ique 1;:c=2==po
Ou pl:1n· dt·11x é111ettc.·urs/ n:cepteurs <l'uhrnsons :HL'-
d'nmmo11.i:1c Nll 3 caqJ de ln concenrrntion
cie""clùc-nu:e métlwle d'ammouiu m.
! D:111 s un b t: dkr, on mélnnge mi Yohune.!_d e ln solnrion (S)
1
2
volume V d';solutio n (S')
----
1,05
-
mélh_ylc rl',1111JJJ01IÙ1J11 (CH 3NRJ(nq) + Cl(aqJ•
-
130
1. 1. Qnel est le rendement r de ln rénction de ce c:1s?
111:
: mobU·c C = 2 1q- mol.L- nvec le même
.
j (CH 3 NH{(u•i>+ Cl(uq)) de mëme concenrrnri on molnii:e,f,;
88
rendement de 1:t réaction.
0,5 pt
0,5 pt
Pr,rlir• 2: Étudf! de li1 rém:iirm 't!!Jln~ /,;111,mw111.r1c,·('f d1/rw11n1111 éthvle d'm1111wnir1
aqueuse de chlururc
! É111tle tic la riadicm cuire 1111esolulio11 aqueuse d'am111011iac Nll 3 caq) avec IITUJ sululio11
2
60
.-\ b lu1 de b ré:1ctiou de b syuthèse, ou close la quantité de matière rcstnntc de l'acide en utilisant
:,.o l11tio11 d'hydroxyde êtë sodium, ~11 trouve quc nr = 10 mmol. Cnku~n \·:1k·ur r tlu
~-!)
C ,1ul11ctit·it~s molni.i:es ioniques:\ 25 °C en (mS. m .mol- ) :
.Îlz =).Nu:= 7,35
)., = ).CH3NHâ = 5, 87
L'étlumoate de J-méll1J•lb11{1•le
J\1asse /!olumique e11 (g.mL- )
0.75 pt
2)
II.
,t.
L'alcool (B)
1
r de ln solutiou (S est sons ln forme :
: no,mée.s ;
L'acide (A)
J\tfossc molaire Cil (g. ·
C 1kuler s :1 \·:tlcur.
-
.
~---
.
0,5 pt
.1
l: xpl'ime r, b consrnnre d'éqnilibre K nssocié :, l'éqn:1tion de hl ré:iction en foncrjon
2
<111r b ,·:1le-11r de K 3, 1142.10- • RNronver ln ,•fileur der.
=
011 em· oi v ~i,1111!1.rnémt'lll llllt' sah-e d'1ùtrn$Olls
{1
.il. 2
cle T. S:1ch:lllt
É1netteur
US2
us 1
. exlrt'rnitl: ~ de de1L-. 111bc:s idenrjgues, de longueur
Î
Eli précisant les expressions de a en fonction de .À. 1 , ). 2 et C rt d<.> fJ en fonction ck A1 ,
e t À3 • Calculer la valeur de T.
Énietteur
! L = 4, 2 cm qui contiennent de l':,i.r. (Figure
! Le prtmic-r rnbe esr mointenu 11 9 1 = +23 °C et le
: secoml :'1 0 2 = -5 °C gâter: 11 un système d'isobtion
.' tltcrmo~t :1 1._: ,
22 mS. m- 1•
· L:1 mc-s 11rc· dl' l:i conducr.i,rité dn milicn ré:1ctjouoel :\ l'équilibre donne ln Y:1lenr u = 137,
N H J{nq) ·
bnse
ln
er
Hfcaq)
N
l~niœ J'éqn.'ltion de ln téncrion nciclo-basiqne ei1tre l'ncicle CH 3
0,25 pr
:
s'écrit
i:énction
ln
de
T
:\fo111n·r qt1 e l\·xpression du rnux d'n,·:111ceme.ul fi.n:11
1 pt
T = Cl.<J -
~
: ("OJIC<.'lll 1t··, <"I Oil chauffe lé mhrngc ré:lctiound :\ une tcmpfr:lt\lfC' constante.
1
T2=.!!_(
C2 ~FT« 2
·
;
M
=
2
~
~ )'ncide (.·\ ) :1,·ec , 11 1 ,·olume V01 = 22 ml de l'nlcool (B) Oil :1joute 9nel9ues gouttes d':1cicle snlfuri9ut'
Pt1 i~ c:1lc.:11lt·r ~:1 valt·ur. Co11dt1rl'.
E xp1:imcr ln co11stanlc d'équilibre Ken fonction de 1'1 c.•t C1 , puis c:1kulcr sa ,·a.leur.
solution (S2) de
:\ 25 °C, ou dilue b solution (S 1) d'acide ncétylsnlicy! rqucïlJ fo~s , ou obtient uuc
O,ï5 pt
yH3
' ou me'] nuge un vo1mue V11 c = 11,43 mL de
:: Pom sy 11 t11t'.1iser l'f1h:1nontt 3-méthd de butr1 nu 1nb oi::,tou:e,
m 1 , 11101- 1 ) :
-
0 •.2:i pt
~
°'o-CH2-CH2-CH-CH 3
.
Co 11duni,·it~s molnires ioniques 1\ 25 °C cn
3, 6
Àc9ll10◄ À.1130+ == 3 5
C:drnln l:1 co11n·11trntion C1 •
i
É ni1t· J't:c1u:\IÎ0 11 de la r~nction euu:e l'ncidc.- ac:ét;,·lsnlicylit1ue 11\'t'C l'eim.
-,
1 <1, C1 , .il.u 30 + et ).c., 11104 -.
E ~:p r i111cr le 1:111x d ':n·:111cèmc:11t G11:1l r 1 eu fou.ctiou de ln couce11trntio1
.,
.;.
cH 3 -c
fonnnl,· ,rm i-déw·loppée t>$t:
11/t uer comme arôme daus les bonbons.
. c..>
Iso/atio11
0
thenn.ique
~
+
-1
L
L
Il
<::t>
clans ch:1q11l· [ubt".
Le s é111c11<"11r~ t·t Lt:ct>pteurs sout reliés :t llll SYstèm e
recus
: d':1c9ui si 1ion t711i emegistre les signmL..._ émis
•
~
: i1 l'1111tr<" n;t Ir-mit~. ~
;t
~~
Récepteur
us 1
Récepteur
Figure J
US 2
JI
vY.P.ï.
..
Gyt~•A
gJ I lJ b~i 0 +J 1
.
i Q
1
L.1 ~çnsi bilité horizo ntnlc : Sh = 1511s. div- .
L. 1 ç,· !t=riré clu son d ,1ns l'nir est proportionndlt• i1 ,/J
L
.
1111
__. ,..
0.5 pt
0 .. 25 pt
T1011wr lt•~ l'Xpt'l"S~Îons ch· A' 8 1•1 T clt•s COllSl:tlll ~ À clrtt't11lÎIH'I' 1•11 fonction
1 pt
1
1
'
•
u11 (t)=A.c
. Jllll
-!.
0..2Sp1
Figure 2
T+B
"•: I ,n[111io11 dt• l'.l'lll' l: (Jll lltÎOII diftrll'lllÎcik.
l .11 j11sriti:1111 ln 1i-1loml", t' l t•n cxploit:1111 lt'!i combes cléi-e rmitH'r ln \·:ileur dt• :
-
1 '. Li fo rce rlrctromotrjçç f
' l'l'$i~r:111rc r de- ht lmhi11e-.
l ~ r-~
..l ; L:1 ,-:1lc-11 r dt" l'L11cl11ction L
0,.25 pl
0,.25 pl
clt·s p111~1111i-r1t·~ cl11
t
:1111
0 1 C'I 02 .
L~1~~ltrnso11 cst-ellc- trnn!"-·ersnlc où
lu 11gi tmli1111le ? justitic.>r.
E xp îi mcr le rt>t111xl tempon~l .dt cntœ les deux
, <:ct' ptin11s en t'oncrion <le l , 111 et v 1 •
D<: ln111ÎJ1c1 grn phiqucmcnl le 1~l111cl tt·mpu1d ..dt
(b) n i ~011 \
1·. E
club
, un 11 1, po111 l)llt"
note , L· t l'z r<'~pcct·in:•mcnt l,1 célérité des nltmsons pour ln
11
·
·
\ [111111,·1 ljlll ' l\:q11:11io 11 diiïi.:1t·ntit-lle n :1ilit: pnr l:1 lt<mio11 11. 1111x borni:l> de: ln l>ubi11l·
b
R + ,. x dt + ub = R + r
; ft'lllpér.ttlll t'
0,25 pl
~. :yJJJ.
1111
tT l.1 1c1 11pl~rn ttu-c :1bsolnC')
11
1\ I'' •ll ' l".
i.1 (01 1\ll' :
; D.mw.é.a :
:
l,ln 11t1in p.11111i Ir, ro111hl"~ (C1) rl (C2 ) n ·llr q11 i rn11t·~1>o11d ;i ln trmio11 11 pp1op1 i1:1·. ,lmrilirr
ll.25 }'I
.
Rnr;me i Oil obtin i l le- _l!1.1pliique !' lli,·,11it (Figt1rt" 2):
.
2023 ôl..o oJg.>
2023 '?Lo ÔJ9.l
••
T
:
••
••
D<= tn111ÏJ1t·r Il':- ,·:1IC'urs des célérités v, et Vz.
l pt
l~ 9/lJI
;-~
Partit- ! : 1?111tl1· dt' ln 11wdulatin11 t'I la dh11odulati011 d'11111Mit11dl'.
P/!_)1siq_ue II (f,5 poùits)_
011 prnt lm11smellrc uue i11fom1tttio11 ,1 gmude distmtce, eu 111od11/a11/ l'm11plit11de r/'1111e
1
Neclro111a~11éliquc qui se propage d 1111 émclltmrà 1111 réccptmr.
; Pm1if, I : É111dr tfp la rron11sP r!u diofJ/e RL d h:/rp/nn 11srnu/1111I rie trmsirm
: 011 1é:1L~c le- 1t1 0 11t:1gc éki:t1·iquc s1ù,·:u1t schém:11..isé snr Li ligure 1
• t ·1i _g i11~û1tenr de te_nsion idé:11 de force électromotrice E,
.;. l. 11c- ho bine (b) d'i11ducrio11 L et de résisrnnce interne r
:
50 fi,
,+ l ·n ,·û11d11cte11r ohmique de résistnnce R
1'/odr,latirm:
I.
Ati11 d'oht, ·1111 1111 ~ign:11 modnl~ d'ampli111de, on
milisc 1111 ci1rni t i111t:gn~ multiplicnc X clc
5 1.
l'OII St:\lllt ' 1·.1l.ll' [t•1istiq11t' k =
;
=
,+
E,.--- -- .....
amie
s
o. v-
l' Il,· dio de-.
:-\ l'aidt' d'1 1n c; HF Oil :1 ppliq11t> :i l't>utrc.>t>;
+ l . n ii 1 t cu1.1p tcnr K
:
; •.\. b d:ll c l = Os co11sidéré comme origi1-1e des d:nes, 011 forme
E1 : Li po ncmc vp(t) = 'Um. cos(2rr. F. t)
R
-
: l'i111e-n11 1,1 ,· 1n /{ .
/ 1\ foidc d'1111 ~~·stètllC" d':tcqnisiriou u1fomrntisé, 011 obti<.'Jlt ln courb<·
: sUÎY:uH<.' g ui l'ep1·ésc1He les yn.n.ations des tensions Ut,(t) et uR(t) nux
; bornes dr Li bobine er dn co11d11cteur ohmique. ~ue 2)-..
.-h n · l.1 lé'11sio11 mocl11ln11të
s(t) = 3. cos(2rr. Ll)
et 'll 0 tc-11s1on de clL~cabgt•.
L1 tem ion :ic'.'i.1 sortie u,(t) est obtenue
Figure J
u,(t)
f 2 : l.1 1n1~io11 v,(t) = s(t) + U 0
Figure J
u,(t) = k . v,(t) . v,,(t)
.\ f.,11t rn <Jllé' ln tr-11sio11 u,(t) s'hrit ~om l:i formr- :
ll,25 pl
u,r(t) =
Al 1 + m. cos(2rr. f. t) ]. cos(2rr. F. t)
cl \Ht'ciser l'expression de A et celle dl.' m Il" tanx de moclnbtion.
nn \'Î~11,1lise ln lè'11sion de sortie .!!:,_(t) :1 l':1îcle d'un oscilloscope.
-
U 11 obtic-111 ci-dt"ssous l'os<:illogrnmme clc b figure 2
1 V. cllv-•
~ Sm.si/Ji/il; t't'rlimlt:
1
- .
~ -;--- 1-- -1-- 1
----
20 /lS . div- 1
"- Smsi/Jilitl hnrltn11/alr:
Df té"1rni11er l:i 911:1li1~ de b morlubtion .
' ' Dc:rc-nniner le· ~ ,·nti1rs dt• 1c·11~iom 'l.1 0 l"I 'U., .
'
--
0,5 pt
0.5 pl
·
·
1.
-· .
1
!., .
(1,25 pl
i :-1 . : :·- 1_ / - - -1 ·-· - 1· .
f. '
,, . ~ -+-1- -----:+ ll- 1- - - - _ . ·- 1- · :_r1 - ---- -•- ->--- t(111s)
-· !
j
l
_, : t .
0
1 •
!
1
• • 1
.- -
-
-
1
• - •
1
1 1
1
Figme2
, ...._ t
1
<:.ilnilt-1
b lo11g1w1u d'omle). cl'1111t· onde ~lrctromng11~tiguc m o dulé en :rn1plitnclc t·in-oréc.
U11 t!u1111r c = 3.10' m.s- 1 .
·
~ Î ( 0-P. 'ill ~i bgJ I J_b 'io+ II)
___:d:.:__J
2023 i.5lo OJ9J
r) ('-y_Y. P_.·_;1I_Y_.j b ~ 10_ l.:> ï n.p 1)
• •_ .
2023 9LD OJ9J
0
Bmi""
....__
____,_
1 1
1
--L
"' .. r . -,
1
f
'
..
• 1
1
1
ll . j
1
1
'
'
,_ -
1
'
,;
~
-
'
.1
, l 1
I , 1
1
1 1 1
1
t
j'
+ ._ '
1
1
1
-
1 "
1
I
r
~
'
L
1
1
,'1
!'
j
- .
'1
-
l-
1
-·
1
1
1
1
1
,. !
1
1:
' -'
l
1
1
l:
r.
1
.
'
f
•
1 1 1
1
1 1
'
1
l
j''
j 1
1
; ! ! '. 1.
l 1
Physique III (!,J poiuls)
l
1
- -: Î
t
l ·1
j
I •
j
,j
-
,_
l
j
.
'
,-. • j
1
1
1
tï
t.
1
1
1
..'
.
l>
Partit· / : (:_ /11(/t• ,Ir l'o.rdllalelfr dt! /01:l'Îrm
homogènr (S) s11spr11cl11
· li n prnd11 l,· d,· to1sio11 t•~t ro11s1itll~ d'1111 c!isq11t>
111c.-t:1lli9nt' ,·erlic,,I dt' comlnlHt' dt'
t'll ~011 rrn1 1l· d'i1H·11ic.- p:1r un liJ
i
l rl
· torsio11 C I tig111t· 1).
d'étpùlilm.•,
011 t':lit tul1111,•f lt• discJllt' horizonti,lc.-mc.-nt, dc.- s:1 position
(1Xt' (L1) 111ntérinlist:
l
de
nntom
O.,,,
nngle
pt'tÎt
· tLlm lt· s,· :1, 1)ositif d'un
- i11iti11lc- ,i 1111 imtnnt
: p;ll' lt· til 111,:t,llliqm·, puis 011 l'nbnnclonnc.- s1rns ,·itc.-ssc.
t
-• • l ,
1
1
1
'1
1
· choisi co111111c origint' <lc.-s cfotc.-s (t = 0).
,i l'nx<' (.d) .
Soir J.1 l,· ,nornent d'iMliÎt• du p<'ndule pnr rnpport
rid terrestre
rëf~n.•11
u11
cl1111s
pend11lt>
d11
11.•11t
011 ~t11di,· le- 111om·t'11
: comidt:1,: t.!.1lil,:t·11 .
dntc- t par l'ul>scis st."
. 011 1c-p(·1c- l.1 p<->~itiun du pc-mlult• :', 1111 ius1a111 de
, :lllf!Ul:iÎr ,· 0 .
. On p1t'11d le- 11l.111 horizout11I conîo11d11 :wec le
pbu du di~,p1c comme l-êt'c.-rcncc.- de l'énel'gic.. pote1uidl ,· de pt's:rntenr, et fo positio11 d'équilibre
- -
s(t) , ou utilise: uu récepte ur rnd.io form é par uuc d i:w.1e
Pour c :i p 1n le ~igrntl lls(t) ali.i1 d 'c.xtr:ùre le sigual
2
)
pht!-i eurs étages. (Figuœ-3). (On prendra : rr = 10
élc-ct roni,1uc ro n5ti t11~
Figure J
---------- 1
1
1
.
L
1
R,,
1
1
1
1
1
·- -- -- -- ---- --0,5 pl
0.5 pt
1
1
1
1
1
1
1
:________ .&f'.!Nld:
Étage 2
Étage 1
0.5 pt
M
0.5 pl
P:1 1 une étt1Clc.- énergétique, étnbfü
1
0.25 pl
0.5 pl
_6___.....,
ll,L1)
I'
'
~\:rri1 sous b forme:
0
O(l) = 0m.
1
50
E,,,.,.,u
; ~- La période: propre 1 0 •
.1. L111 ~)'~ lèmc de snisic i11form11tig11c conve11:1ble
pt· 1111ec d':i,·où· le grnphe de ln figure 3
2
1tï1rt'~e11!;111t iJ2 = {(0 ) :it·cc OérnJll ,·itcssc
., ngubirc à l'iustnnt t. Détcmûnc.-r Jn ,·nlc.-tu: de.- :
1. I . Le moment d'inertie J6 •
-l.~ L:1 l'omtaul<.' d<." torsion C par deux
figure J
ONt/11(
_7___ ~
- {-~ ,_~
-- -- -
--1-+- -
' ~ - -- ~
I+!= - , -
K
.
1
.
-
1~
-
1
'
1
,.
',- rl--L ~~
' 1'
=t
-1-~
.
1 1
-+Y-
1 1
Til:
. . .
t
1 1
-r,- - r 1
"! i"-- ·
1
-·- ~
t 1
t 1
.. j _ - - 1 ~
-
..
- ·§ r+- iliLL
:cr.
. . l-
I l'
1
-
1
'
1
'.-
,--
0
(} e. vlsoschool.ma î
t(ms)
Figure 2
cos(~: l + tp)
méthod es
Ol'I IINl
1
figure 1
1
Dire-nninrr grnphiguement l11 Y:1leur de :
l<'
i . 1. L'énc-rgit· porc.-ntiellr de torsion mnximn
0.5 pt
{) e.vlsa~chiiili!iiJ
···.·.·,·,.·.·.··:::::;_/
j
l't>gn:1tio11 différcutiellc du
111 011\"èJllCllt.
L, solut.iou de l'équaciou cliffércutidlc
où T0 rst ln pél'ioclc.- prop1'e du pelldulc .
Dttl'rm iuer l'expression de T0 •
Étage 3
Do1111e r le nom et le rôle." de d rn que rt:1ge.
s:1teur de c:1pncité C0 :1just:1b le c-11tre lt's deu x
f. t~ 1>rc-mi t>r étnge est une :1ssocin tio11 d'un llll conde11
. .\Io111 l t' f q11c12 pF :n-ec 1111e bo bine cl 'indu ct:1nce l 0 = 300 mH
1·:1b1rs C0 ,., 1,. = 2 pF et Co.mu =
.
(t)
tts
sigo:tl
le
tionner
sélec
lc- conde11 s:1tenr C0 permet de
!'t1 1ili~:11~
lrn 1 de
sacha n t que." R = 35 kn. T rn un·r la bo1111c n
Pu111 ;l\"Ou· llll C bonne dét ec tion d'rnn·loppe
pF
4
;
pF
400
;
pF
800
;
l.1 c.1 p.1ci 1é C p:1r111i les c:1p :1 <.~tés sui,·:111 tt's : 8 uf
-lb t+
- .: ..
· · -- ~·~
:- :-rr· . · .--:--:•-.-
: du temp~0,5 P1
1
1
c,
Disque
: du disCJll<" (0 = 0) comme référence clt' l'énel'gie
. pott' ntidl ,· de 10rsio11.
ns
: Le gr;1plw d,· b tignre 2 œprése ute les ,·nrintio
foncriou
en
E,,
rorsio11
de
elle
. de 1't'11r1.t:ir potè'11ti
l)/111n dulatin11:
----- - ------~
Fil métallique
1
Figure 2
JI.
Support
1
.
ïll
••
••
g.JI 0b ï o~I
2023 9l..o ÔJg.>
r llaLœ P, otù ~ ~ 1-/udc ,ùc 11ww'fwc111
du ccutœ cl'ùwtt'c G d'un obus (SJ. .
l'Oual
1,
~ r:- ~
-
II H' cu 111111 t· s111 le: sc h l'111 11 n -d t•ss u u s .
ll'1111e ill' 11 w 11 111n11l'
, ,.l. :
/:l .Il Jl :l\ .Jll , : 1I l 11 ,1
111 ·
111 clc- 1,, m ni 1t11g 11 e d'1111 e l1:1111 e 11 r dt' Il ::: 1000
2500
:::
Cc nu <, ,· 11 1 ,, 111 1 11 œ 11, · 11• :i 11111• d i~ tm H"l" dt· rl 1
11
1
1
Va fo nnn11 un 11 glc- cr
Lt's o bu, 1,,, , 1,.11 J,· n,w 11 c:- 0 11 1 m1,· ,·iœi:-H· i11i1inlc• v 0 :::. 250 m . s- , lt• , -ec te u r vitt•s sC"
_
-
V
>11;
!1, V - 18D
c.9 ,1.1~ o~ -+ 1o ~ \9 J-14
O.
J1.n.IULl\ :_,i'__;
1
1111,,, 1,ir,; <11' l.1 J)t'!-:rnr,, ur: B = 10 nt . s- i
J'~
><
a..~)(
o; H3 cr+
--------
' "Î ~ nt.1 p1:!f l 1,i-1-1 ~ V
~f ~\,,.[~of? +'\iarc~1-,oy/f
s::
1
'
J)'
t
1 pt
E11
1
0..25 pl
J pt
1 0.75 pl
1
1
r-. f+-
[ f!Jrl J7/::. cc; H~
du
:1ppli9u:u1t la deuxième loi de Newton, ét:1blir les dem; équ:nions bomires x(t) er y(t)
11 1o m·Nnt'IH
de l'obus.
l'éqmttion de la trnjecroi.re de l'obus.
de tirer s11r
Quelles sont les angles 111U1111rnl a'"'" cr m:1xinrnl «mu• d'angle de tir qui lui permNti:out
uJ1 11;n·ire cnucm.i de l':mtcc côté de la montagne ?
i1 gudli:s
::,; Li cot~ Est de l'île se situe :i d 1 = 300 m du plnn ve1ticnl du sonuuet de b mo11t:1gue,
tirs?
les
é,·iter
pour
di51 ;wccs de fa côte Es/ uu uaYirc euncul.Î peut naviguer
f: 11 dtcluire
f _)i
o-=- r1~J? (~, + \)
~c.
{~rt) =-
\J
~/ + ~L
l
1
!
1~
~ IV z.. m~ IL
n cs lLe St1pp osé g:ililèr n .
L\ ·rnd c ,1-i ,11 0 1wc11H·11t t· ~t t•IÏt.-c-tn,:,. cfo11!- un l'cpè-n.• :R(O, Ï,}) lit: t 1111 rél~rr u tid te
:,,:1
~o '(t1b 3
-
11\"N.' lÏ1 L•1i. ,, ,1t.dc.
Oil uc-!; L~,· l.1 1~ !-i~ t1111CT de- !'Air t't ln po11s5éc d'.Archimèdt'.
,·, ,1111 11 <' origi m" ctt's d :i tt•~ t = 0, l'inst:ll\l du tir de l'obus du poi11t
0 11 p1
_
r=- __t_ = rtt;~J.v:
/
~L
11
C, ,y
1
t.r/
k : f4flrt-ay-Jf
'C
os-~Ji
îi :: {Kt+q~~ -k,
.z. c2
Ct;, He, lit)!
,, 'î, li-
. [ '917';- °4-"
Ji ,: [+y1:Jf ='77, ~
cc;H8 0yJ=
~
~ :-
s-r~~ ?l ';:;'
-
t
ç1 _ t, c1
::. e1 1 - r; J
C
~ r/C1 =- );f b, ;~,..y
~('1 -'"r;)
1- r1
-r/~/
ci\'f u~
s)
F :::- S
C'2..
fC, = k,
vs, <z. :::- c,
F
/
(( - ::= t".ez. C2-
1 - ~•
2
'?:'z_(l = k ( 1 - 'Ci)
~Ç ii l< - /< t"z
-çc,
+ 1<
L.!:.A
~.t- _
K = t::)
L....::J
2.
4~b-VttC
=- i/- -4(~)(-I<)
.: K; '1'- r ~ K.. = -1, lt -1 •1; ~
- (,( + Vl< 2+4Kc
~Cz...
~ )L~ i;-t.oJ
10
t Lf-L( /<C t
4- C z._
"'°1L
- -k-
~CL
k;; ro•,NHe4'. [Nkq!J{
J(
(C1k'lf')f ~ lNJii}f'
k ~
/'
(-&-f
(M-V~~
I
fi"~ -~ - = ~ / ::. -?;
~ -~
't1 - ~
1-"C
Vk ( 1-, );: ~
_a-?' V1 - n. ( A1 -f ~2)
~ 3 - ~/
~-r :fk =~
il3 -- ~ J
fr<:: C-t <Œ
~ = 't(1 ,t fi<)
rJ
h(~3-1)
~ V;
~l -t ~L
Al-~J
V=
( vr =Yi-+ vl
Z::olcr- -~
~=-
~
Yr,:::,2¼
Vr
~ (~3-~I)
~ = ~ 1 ~~z.
~3-1\
i- =-
ry· .t)H(
-
~t-+ h =-
_
Z~ 1311 2l .~
foff0r)1)
::-
l'llii, ... J
~3 - ~1
~'iJ{ - ~,-+ ~2
<i (1-1 ) A3 -~
r?ltr+ar
~
Œ
1t-Y K
=- tJ11 J.:: 1r ½
o
~o
4:i,- c oH
\
+ c1 -
'
c,i; -
/
c1-'1'f ~ .._-
~
/+G.~ ~ ~-6F-'l }
/
11;
---- ~
01J _
°' 0
C l-( -
t
é l{ - CH - CIiJ
t
C
-----,,
l
;4'112..
O
Y'il'J / ::: 01 ,l h1.Q
/ hl{ : - 4. ,;:;- t m4
/
Vle"f': l'i t'J : ~
/
• n( fiC)r- = nt' - ~
z/ = l'JJ,'a-- 1-YJ(0.tk/tJ ,
)r
=01
=0 1 13m~
xâo-o ~bS-1/c
C ;~
f{ = (€)1". .e (f4o {
tIJ 7f
( 17 )p
~
4-
~
k~
O;
I(
'n ffl/-== ~ -= "1 2
'1 1 4
t:- '1'
/67 .e - ~ (1- - ~
hM
f :=
nrPJ)
1..
r : ntl(f ¼
o11~
J
ne(.p
y I :=
~C /k,
C~ / -
, ,t_{e) =- O; Z h"/8(_
J -1-».I~ A.fr,,,,.,~
i
l ,t-c . v,:;_c J ~- 110 r~X 'C41( /l'J
-
c.. ;--
.,
cr-t Hz
ù
-
L
,
O;,e -1.:?~-rf
2..
~7/C/1-i:;/
~ ( o) 2. - 111? -r-2,l)
=c::,
~18 -1/18.rf f
~18i,/-1-0;8;:. (J
3z/ -
tJ ::(.~i~Y- '1(0i8X~-= l);il'-J
fiiÎIJ ~~1/1mAj
xdT1 ~ -08r
°'
) -6
~17.. : : : 1~8 m,I.
b1
"?21. < Xm.
X? :: c-1 ~88111~
...
),-1/
.
.,;..
•
H
,1
~é -:. ,,__..
L
6t-
'e,<f := Jttg
~~
'-
~~ = 01 2 mJ
~~ = rl~ï : .b?t):; 2.J1'f C Ô/ 1ernJ...
f
M{~) '1Jo
(ï,i<() ::- D;
v,
48 =- ,3o ¼
v,.,
-- VI\ - Vz..
6t : \Jl
--L
- 1
y2- . V1
vî. -Vz.
T~
~J( ( ~ - 1 )
v2 • VI\
~ V~
01L
1
~r =
!'t1f -1° Y1~o
,rJ '
-= Y1~6¼
_ê) ~
I fti..d.t. ~ ~ ~ ~ -G
1
,;
v1 ~ L
~
I
v2- :: .b:.
V~ >Vz.
/Ill.
ë~
~
,r:;=
VTj > vT;..
(ë2.
/JI:- := r, - Zj
I
-.
.
1/
If'+- =-
S>\'-
Cl
11.(.. ) ~ 0 ~ ullec,
( ~V
?
-
.
-- L
~
1 ::-Ci
@1,) --, Ubcf-)
1(
1~ .=
é=-
-
Mb
~ - ~b
(~
l ,:!i. €-d(b) -t 1 ( Rtr): E
clt-
- L dJ.t k + E - ub "(R-+1) -= E
/2I? cJl
-t ~ ._ 3-f _ub0;Y) =E
,ç
-½ ~- _Ub(ekr) =- E • ~;r &"
-t~ _U1,(½:?~~~ -F~~-F
-
.
~ k. - Cj, ( / t t ) =- - Y Ei--
=---r
d.,f-
/_
c;U,11,
(2_ -tY
~
~
--t \J b
.=-
r f=
~ -f r
ub ~l ~ f?.. --t JJ e t t
~-é==c
~A.' :
--
L ~ f U1:, ( ~ +r ) =- r F
V,i(t)
u12 : E - vb
-
.
,µ b = f=
~JV11, :A--t}3::'f-
~)
?~)
Ub~:::. 4- .;: -0
Ui,.: ré :-1/~
f2--t-r
B: E - ,4 ~ E - y--Ç.
f+ r
= ~-t-Vf" -' rE
R -t--r
.:::- Q.t= -t
y,- ,.r
= /2-Ç.
fZ tv
U5 (f;~ k ~! ~J
Ut:: R F·
R -t r
r-=- R~ ~ R.
::: K{.Si/ ~ (/r,) (/ryi ~{ll!TA-)
.c 1<[3C-a-?(2m'{/-1-1Jr1J· ~ ~(~ft)
Urz~
f
~·f"o( ;
c
= )oS2..
t
''if'
KUM uo[i~(trr/f)
Uc
i-1J ~ (MFt)
~ fr [ m Wl (~ Jtr1) Cr?( ZM-F-f-)
~ KUrtt Uo
l-=- ë( Rr)
V" ('c):: o1 ~3 u~:: o;ô3.x 3 -= 1189V
'te J~J
IN'\
,,_
1
"
-
3
Uo
ri/ 1 l u~)( := 31 1X l.._ .: )11 V
u~ == ~11..é
tJ 1 'IV
n-1 r
u~ ~ );1 -01 Lj =°.IR6.
Y~=
~
l = L · t- J( 1ro) = ~ 1 ! 1-J
CJIV-'l..k -
V ~ 4U~
7'1~'1
'T> = GX 2o ' t.:" ,- =- t'2o . t_c-~_s
/.c_,, = 1s
2- ::::- 1 ' -- 133,3, ~3+L,,
I2-0. !.; 6
0
:=
1
~:::: , , eA : : 10000"~
v,'\(I)
/
f'.7>1~
~
-- ~
a
~ ~
- -- .
Uo =- (
'I
fn =- jM
U0 ::::..Shl..
M
,4 .:-
1
~~
tept,
A [ ..1. +m J
Vo\CVI.
= 31 1 .:: 1/1- f V
//
+ r;, r-r
If : )c ll;,t Vo
uri'- =
AJZ U 0
:
=o, !hl
r
~1rxie,
1/:;-
:or--Jy (fJ ~~ d~eè~~~~
_J
7p < tr <. ~
Fr
~L =~8911
,1 + J11..,
i;
-
J_ ( <:: Re.
lJo
u/>1-A'I( ==
--
v+
~,~s,;,,
@
jdtcft:wr tJ. lu
(!)
~ ir
em~V'-o
< ..i.
<'(e: <
1
Jr,.,1o 3.( loD 00 0
(<c
~
1
r2,A
< -- -, '1______
Jr, ll-'<8.31J
1
4.-:,~
e1 Sf'. ~- l)fi?e<( <" < ( J,,tt~ .
• 2sr1 ,,c- << c: , 111 " 2.4fF'
C : <-/ootp
Examen Blanc session -2023-
Royaume du maroc
Partie I:
Exercice1.
Chimie
Préparation du dichlore
L’eau de Javel est préparée industriellement par réaction entre le dichlore Cl2 et la soude
( Na+
+ HO(˘ aq) ). Le dichlore est obtenu par électrolyse d’une solution aqueuse de chlorure
( aq)
de sodium ( Na+
+ Cl(˘ aq) ).
( aq)
1. Quelle transformation subissent les ions chlorure lors de l’électrolyse ? Écrire la demiéquation associée à cette transformation.
2. Quel nom donne-t-on à l’électrode où a lieu cette transformation ?
ministère de l’éducation nationale
du préscolaire et des sports
3. Afin de préparer en 90 minutes la solution commercialisée dont l’étiquette est donnée cidessus, il faut obtenir 5, 25.10˘1 mol de dichlore à partir de la solution électrolysée. Déterminer l’intensité I du courant qui doit circuler dans l’électrolyseur si la transformation
est considérée comme totale
Examen Blanc Session Normale-2023-
Données : constante de FaradayF = 96500C/mol
Exercice2.
;
Le couple Cl2 /Cl −
Décomposition de l’eau de Javel
L’eau de Javel est une solution aqueuse d’hypochlorite de sodium (Na+ (aq)+ClO– (aq)).
L’ion hypochlorite est fortement oxydant. Il est, en particulier, susceptible d’oxyder l’eau
selon l’équation chimique :
DURÉE DE L’ÉPREUVE : 4 heures – COEFFICIENT : 7
−−
⇀
2 ClOaq – ↽
−
− O2g + 2 Claq –
Cette epreuve comporte 8 pages au format A4, en plus de cette page de garde
L’utilisation d’une calculatrice est autorisée
✔ Si au cours de l’épreuve, un candidat repère ce qui lui semble une erreur
d’énoncé, il le signalera sur sa copie et devra poursuivre sa composition en
expliquant les raisons des initiatives qu’il a été amené à prendre .
✔ On veillera à une présentation et une rédaction claires et soignées des
copies. Il convient en particulier de rappeler avec précision les références des
questions abordées.
✔ Toutes les réponses devront être très soigneusement justifiées.
✔ Si un résultat donné par l’énoncé est non démontré, il peut néanmoins être
admis pour les questions suivantes. Ainsi, les diverses parties du problème
sont relativement indépendantes entre elles.
Pour étudier la cinétique de la décomposition de l’eau de Javel, on prépare une solution S1
de concentration C1 diluée à partir de 25mL de la solution S0 de concentration C0 contenue
dans un berlingot récemment fabriqué. La réaction de décomposition s’effectue dans un
ballon de volume Vb = 1, 2L fermé. On mesure, à une température constante, la variation de
la pression ∆P due au dioxygène gazeux produit. Dans le ballon de volume Vb , on introduit
V1 = 100mL de la solution S1 , puis on déclenche le chronomètre à l’instant où l’on met le
catalyseur dans la solution.
1. montrer que la pression mesurée Pmes dans le ballon à une date t quelconque a pour
expression :
RT
Pmes = P0 + n(O2 )
Vb
La température est T = 290K
La pression initiale dans le ballon est P0 = 1, 00.105Pa
R la constante des gaz parfaits : R = 8, 31J/mol.K
2. On relève la pression Pmes dans le ballon à différentes dates afin de tracer la courbe
∆P = f (t)
✔ Tous les résultats numériques seront donnés avec un nombre de chiffres
significatifs compatibles avec les données fournies.
Page de garde
Tournez la page S.V.P
D.AYOUB
1/8
Tournez la page S.V.P
Examen Blanc session -20234.5
Examen Blanc session -2023-
Partie II:
∆P.104 ( Pa)
4
Exercice1.
3.5
3
2.5
2
1.5
1
0.5
t.102 (min)
1
2
3
4
5
6
7
8
9
(a) Donner la définition du temps de demi-réaction. Déterminer sa valeur
(b) Montrer que l’avancement x de la réaction, à une date quelconque, a pour expression :
x = 5, 0.10−7 ∆P
sachant que ∆P = Pmes − P0
(c) Déduire l’expression de la vitesse volumique de réaction et calculer sa valeur à t = 0
3. Conservation de l’eau de Javel
Le degré chlorométrique de l’eau de Javel correspond au volume de dichlore gazeux,
exprimé en litre, nécessaire à la préparation d’un litre d’eau de Javel suivant une transformation totale modélisée par l’équation chimique suivante :
−−
⇀
Cl2g + 2 HOaq – ↽
−
− H2 Ol + Claq – + ClOaq –
Dans les conditions de l’expérience, la quantité de matière de dichlore nécessaire à la
fabrication d’un litre d’eau de Javel à 48o est donc n(Cl2 ) = 2, 10mol.
(a) Déterminer la concentration molaire C0 en ions hypochlorite de l’eau de Javel contenue dans un berlingot.
En déduire la concentration C1 de la solution S1
(b) En utilisant la courbe ci-dessus déterminer la quantité de matière d’ions hypochlorite restant dans la solution après 10 minutes de décomposition ?
(c) Conclure quant à l’importance d’utiliser rapidement l’eau de Javel concentrée après
l’achat.
D.AYOUB
2/8
Tournez la page S.V.P
Physique
La scintigraphie du coeur
Deux causes peuvent être à l’origine de douleurs cardiaques :
- soit les cellules qui constituent le muscle cardiaque sont détruites (ce qui correspond à un
infarctus du myocarde)
- soit les cellules sont encore vivantes mais souffrent du manque d’oxygène dû à une réduction de l’irrigation sanguine (ce qui correspond à une ischémie coronaire). Pour son diagnostic, le cardiologue prescrit une scintigraphie myocardique au cours de laquelle du thallium
201 est injecté au patient par voie intraveineuse. En effet, cet élément radioactif, émetteur
gamma, n’est fixé que par les cellules vivantes du cœur et son rayonnement de faible énergie est alors détecté par une gamma-caméra à scintillations.
Données :
✔ constante radioactive du thallium 201 : λ Tl = 2, 6.10−6 s−1
✔célérité de la lumière dans le vide : c = 3, 0.108 m/s
✔constante de Planck : h = 6, 6210−34 J.s
✔ 1eV = 1, 6.10−19 J
1.
La désintégration du thallium 201
Le thallium naturel de nombre atomique Z=81 est composé de thallium 203 et de thallium
205, Lors de sa désintégration un des rayonnements émis possède une énergie de 135 keV.
1. indiquer la composition des deux noyaux
2. Calculer la longueur d’onde de ce rayonnement dans le vide.
3. le noyau fils est 201
80Hg, écrire l’équation de désintégration en identifiant son processus
2.
Scintigraphie myocardique
Lors d’une scintigraphie myocardique, on utilise une solution de chlorure de thallium 201
dont l’activité volumique Av est de 37MBq/mL−1 . Cet examen nécessite l’injection par voie
intraveineuse d’une solution d’activité A0 de 78MBq chez un individu de 70kg. On visualise
les premières images du cœur grâce à une gamma-caméra à scintillations quelques minutes
seulement après l’injection.
1. Calculer le volume V de solution d’activité A0 à injecter à un patient de 70 kg. En déduire
le nombre de noyaux au moment d’injection
2. On estime que les résultats de l’examen sont exploitables tant que l’activité du traceur
est supérieure à 3 MBq.Déterminer au bout de combien de jours une nouvelle injection
est nécessaire.
3. Après injection de la solution de chlorure de
thallium 201, l’examen médical consiste pour
le patient à produire un effort lors d’un exercice physique pendant lequel une gammacaméra prend des images de son cœur. Une
autre série d’images est prise deux heures
plus tard lorsque le patient est au repos. La figure montre les résultats d’une scintigraphie
myocardique effectuée sur trois patients différents A, B et C. Le patient A est en parfaite
santé.
D.AYOUB
3/8
Tournez la page S.V.P
Examen Blanc session -2023-
Examen Blanc session -2023-
En vous aidant du texte introductif, dire si le diagnostic médical pour les patient B et C
est une ischémie coronaire ou un infarctus du myocarde. Justifier. Les zones claires sur
les images représentent les cellules saines du cœur qui fixent le thallium 201.
Exercice2.
Système d’allumage classique dans un moteur à essence
●Rupteur ouvert
Lorsque le rupteur s’ouvre (à une date choisie pour origine des dates), il se produit une
étincelle à ses bornes. L’air devient alors conducteur et le rupteur se comporte comme un
conducteur ohmique de résistance de plusieurs mégaohms. Le circuit primaire peut alors
être modélisé selon le schéma
L’inflammation du mélange air-essence dans le moteur d’une voiture est provoquée par une
étincelle qui jaillit entre les bornes d’une bougie d’allumage. Cette étincelle apparaît lorsque
la valeur absolue de la tension aux bornes de la bougie est supérieure à 10 000 volts.
1. Quelle est l’effet de la bobine sur la rupture du courant ?
2. Etablir l’équation différentielle vérifiée par le courant i1 . Exprimer A,B et τ en fonction
L, R, r, EetI p1 pour que i1 (t) = A + B exp (− τt ) soit solution de l’équation différentielle
3. On donne l’allure de l’évolution de la valeur absolue de la tension u2 (t) définie dans
l’introduction. À partir de quelle date peut-on considérer qu’il n’y a plus d’étincelle aux
bornes de la bougie ?
16 |u2 |(kV)
E = 12V, tension aux bornes de la batterie, considérée comme un générateur idéal de tension. La bobine du circuit primaire est modélisée par une inductance pure L en série avec
une résistance r = 6Ω.
Le rupteur est un interrupteur commandé par le mouvement mécanique du moteur. Le rôle
du transformateur est d’obtenir une tension de sortie u2 aux bornes de la bougie très élevée. Les propriétés du transformateur sont telles que les grandeurs u2 et i1 sont liées par la
relation :
di
u2 = α 1
dt
où i1 est l’intensité du courant dans le circuit primaire et α une constante indépendante du
temps, positive.
14
12
10
8
6
4
1.
Étude du circuit primaire sans condensateur
2
● Rupteur fermé
Le circuit primaire peut être alors modélisé selon le schéma ci-dessous
t(ms)
1
2.
1. Montrer que l’équation différentielle vérifiée par l’intensité i1 s’écrit : didt1 + Lr i1 = EL
2. Exprimer I p1 le courant en régime permanent, calculer sa valeur. Peut-il y avoir une
étincelle aux bornes de la bougie en régime permanent ? Justifier
2
3
4
5
6
Étude du circuit primaire avec condensateur et rupteur ouvert
Pour que l’étincelle n’endommage pas le rupteur au moment de son ouverture, un condensateur est branché en dérivation aux bornes
du rupteur. Lorsque le rupteur s’ouvre, le circuit primaire peut alors être modélisé selon le
schéma :
L’allure de la variation temporelle de la tension u2 (t) réellement observée est représentée
ci-dessous :
D.AYOUB
4/8
Tournez la page S.V.P
D.AYOUB
5/8
Tournez la page S.V.P
Examen Blanc session -2023-
Examen Blanc session -2023Meryem, assise sur la balançoire, est lâchée à la date t0 = 0, sans vitesse initiale, d’un point
−
→−
→
A d’abscisse angulaire θ A = θm = 50o . Le repère d’étude choisi est (O, i , k ) .voir figure :
|u2 |(kV)
15
y
10
5
θ
t(ms)
2
4
6
8
10
12
14
16
18
20
L
22
−5
A
−10
B
−
→
j
−15
−
→
i
x
1. Qualifier le régime observé et expliquer pourquoi l’amplitude de la tension u2 (t) décroît
au cours du temps.
O
2. Expliquer pourquoi en présence du condensateur il y a un « train d’étincelles » aux
bornes de la bougie plutôt qu’une étincelle unique. Que peut-on conclure ?
1. En abscence des frottements visqueux établir l’équation différentielle du mouvement à
l’aide de la relation fondamentale de la dynamique
Exercice3.
Oscillations libre vers chute libre
Deux enfants, Karim (10 ans) et Meryem (7 ans) font de la balançoire. Pour simplifier l’étude
mécanique, le système S1 Meryem sur le siège, balançoire peut être modélisé par un pendule
simple de longueur L et de masse m1. De même, le système S2 Karim sur le siège, balançoire
peut être modélisé par un pendule simple de longueur L et de masse m2 > m1.
Toute l’étude mécanique est effectuée dans le référentiel terrestre considéré comme galiléen.
Données :
✔ longueur du pendule simple L = 1, 80m
✔ distance sol-extrémité du pendule à l’équilibre : OB = h = 0, 50m
✔ intensité de la pesanteur : g = 9, 8m/s2
1.
oscillations libres
Cette première partie permet de savoir si l’affirmation suivante de Karim est correcte : « Je
suis plus lourd que toi, je me balancerai donc plus rapidement ».
2. Pour les faibles amplitudes, l’équation du mouvement s’écrit θ (t) = θm cos( 2π
T0 + ϕ )
(a) Exprimer T0 et ϕ
(b) Calculer la valeur du période propre, que peut-dire sur l’affirmation de Karim
2.
Chute libre
Lors des oscillations, Sophie procède à une expérience en lâchant une bille de métal pendant
le mouvement de façon à ce qu’elle touche le sol loin du point O. Karim dit : « pour que
la bille aille loin du portique, tu dois la lâcher lorsque tu arrives tout en haut ». Meryem
répond : « non, la bille ira encore plus loin si je la lâche du point le plus bas car c’est là qu’elle
va le plus vite ». Dans toute la suite de l’exercice, on considère que la bille est assimilable
à un point matériel de masse m = 30g, que la position initiale de la bille avant la chute
est confondue avec l’extrémité du pendule simple et que le mouvement s’effectue dans un
champ de pesanteur uniforme en abscence des frottements et de la poussée d’Archimède
1. Quelle est la valeur de VA , vitesse de la bille au point A, si l’on considère que Meryem
lâche la bille sans lui donner d’impulsion ?
2. Quelle est la nature du mouvement
D.AYOUB
6/8
Tournez la page S.V.P
D.AYOUB
7/8
Tournez la page S.V.P
Examen Blanc session -20233. Déterminer l’abscisse x1 de la bille lorsqu’elle atteint le sol.
On étudie maintenant le cas où la bille est lâchée du point B. lors du deuxième passage
par la position d’équilibre, la bille est lachée à un instant pris comme origine des dates,
−
→
le vecteur vitesse en ce point est VB = 3, 6 i
3
ﻣﺎدة اﻟﻔﯾزﯾﺎء واﻟﻛﯾﻣﯾﺎء
7
- ﺧﯾﺎر ﻓرﻧﺳﯾﺔ- ﺷﻌﺑﺔ اﻟﻌﻠوم اﻟﺗﺟرﯾﺑﯾﺔ ﻣﺳﻠك اﻟﻌﻠوم اﻟﻔﯾزﯾﺎﺋﯾﺔ
4. Préciser les composantes du vecteur position et vecteur vitesse à t = 0
8
ﻋﺎدل ﻣﺷﻣﺎش.ذ
5. En appliquant la deuxième loi de Newton, montrer que l’équation de trajectoire s’écrit :
y( x ) = −
g 2
x +h
2VB2
6. Donner l’expression littérale de l’abscisse x2 de la bille lorsqu’elle atteint le sol et calculer
sa valeur. Comparer x1 et x2 et dire si Meryem a raison dans ce cas d’étude.
L’usage de la calculatrice scientifique non programmable est
autorisé
Le sujet comporte 4 exercices
✶✶✶ Fin ✶✶✶
On donnera les expressions littérales avant de passer aux applications
numériques
Chimie (7 points) :
- Partie 1 : Étude de la réaction d’acide nitreux avec l’eau.
- Partie 2 : Étude du dosage de la solution d’acide nitreux.
- Partie 3 : Synthèse de l’arôme de poire.
Physique I (2,5 points) :
- Diffraction d’une onde lumineuse.
Physique II (5,25 points) :
- Partie 1 : Détermination de la capacité d'un condensateur par deux
méthodes différentes.
- Partie 2 : Étude de la modulation d’amplitude.
Physique III (5,25 points) :
- Partie 1 : Étude de l’oscillateur élastique.
- Partie 2 : Étude de l’oscillateur pesant.
Réalisé par :
Prof MACHMACH Adil
Pr.Adil
D.AYOUB
8/8
Tournez la page S.V.P
Barème
Barème
Chimie (7 points)
Pr.Adil
On utilise l’acide nitreux pour préparer des produits chimiques utilisés dans plusieurs domaines industriels.
On s’intéresse dans cette partie à l’étude de l’acide nitreux à partir de sa réaction avec l’eau et aussi sa
réaction de titrage.
Données :
Toutes les mesures sont effectuées à 25 °C,
Le produit ionique de l’eau : 𝑲𝒆 = 𝟏𝟎"𝟏𝟒 ,
La constante d’acidité du couple 𝒑𝑲𝑨 &𝑯𝑵𝑶𝟐(𝒂𝒒) ⁄𝑵𝑶"𝟐(𝒂𝒒) + = 𝟑, 𝟑𝟓
Les indicateurs colorés :
I.
L’indicateur coloré
Hélianthine
Bleu de bromothymol
Bleu de thymol
Zone de virage
𝟑, 𝟏 − 𝟒, 𝟒
𝟔 − 𝟕, 𝟔
𝟖 − 𝟗, 𝟔
0,75 pt
0,5 pt
0,5 pt
𝑪𝑩
𝒑𝑯 = 𝒑𝑲𝒆 + 𝒍𝒐𝒈 J K
𝟑
III.
'𝟏
O
Sa formule semi-développée est :
CH3
C
O
CH2
CH2
CH3
Pour synthétiser l’éthanoate de propyle au laboratoire, on mélange un volume
𝑽𝒂𝒄 = 𝟏𝟏, 𝟒𝟐𝟗 𝒎𝑳 de l’acide (A) avec un volume 𝑽𝒂𝒍 = 𝟏𝟓 𝒎𝑳 de l’alcool (B), On
ajoute quelques gouttes d’acide sulfurique concentré et on chauffe à reflux le
Pr.Adil
mélange réactionnel pendant un certain temps.
Une réaction chimique se produit. (Voir la figure)
Données :
Composé organique
L’acide (A)
L’alcool (B)
L’éthanoate de propyle
Masse molaire en
𝟔𝟎
𝟔𝟎
𝟏𝟎𝟐
(𝒈. 𝒎𝒐𝒍'𝟏 )
Masse volumique en
𝟏, 𝟎𝟓
𝟎, 𝟖
−
(𝒈. 𝒎𝑳'𝟏 )
Partie 2 : Titrage de la solution aqueuse d’acide nitreux :
On réalise le titrage pH-métrique d’un volume 𝑽𝐀 = 𝟏𝟎 𝒎𝑳 de la solution d’acide nitreux par une solution
aqueuse d’hydroxyde de sodium 𝑵𝒂)(𝒂𝒒) + 𝑯𝑶'(𝒂𝒒) de concentration 𝑪𝑩 = 𝟐. 𝟏𝟎'𝟐 𝒎𝒐𝒍. 𝑳'𝟏 .
En suivant l’évolution du 𝒑𝑯 en fonction du volume 𝑽𝑩 d’hydroxyde de sodium versé, Les résultats obtenus
permettent de tracer la courbe de dosage 𝒑𝑯 = 𝒇( 𝑽𝑩 ).
Pr.Adil
0,5 pt
0,5 pt
0,5 pt
0,5 pt
0,5 pt
2
Partie 3 : Synthèse l’arôme de poire :
L’éthanoate de propyle est un ester à l'odeur caractéristique fruitée, il est caractérisé par
l’arôme et gout du poire, pour cela, il est utilisé dans l’industrie agro-alimentaire pour
donner cet arôme à quelques produits alimentaires.
On prépare une solution aqueuse (𝑺𝑨 ) d’acide nitreux de concentration molaire 𝑪𝐀 = 𝟏𝟎 𝒎𝒐𝒍. 𝑳 .
La mesure du 𝒑𝑯 de la solution (𝑺𝑨 ) donne 𝒑𝑯 = 𝟐, 𝟕𝟐
1. Écrire l’équation chimique modélisant la réaction de l’acide nitreux avec l’eau.
2. Trouver l’expression du taux d’avancement final 𝝉 de la réaction en fonction de 𝑪𝐀 et 𝒑𝑯.
Vérifier que 𝝉 = 𝟏𝟗 %.
3. Trouver l’expression de la constante d’équilibre 𝑲 associée à l’équation de la réaction en fonction
de 𝑪𝐀 et de 𝛕. Calculer sa valeur.
II.
Calculer sa valeur.
5. Parmi les indicateurs colorés indiqués dans le tableau ci-dessous, choisir celui qui conviendra le
mieux à ce dosage. Justifier votre réponse.
0,5 pt
Partie 1 : Réaction de l’acide nitreux avec l’eau :
'𝟐
0,25 pt
0,5 pt
1. Écrire l’équation de la réaction du dosage.
2. Déterminer graphiquement les coordonnées (𝑽𝑩𝑬 , 𝒑𝑯𝑬 )du point d’équivalence. En déduire la
concentration 𝑪𝐀 de la solution d’acide nitreux.
3. Déterminer le volume 𝑽𝑩𝟏 de la solution d’hydroxyde de sodium qu’on doit ajouter pour vérifier
la relation [𝑯𝑵𝑶𝟐 ] = 𝟐 [𝑵𝑶𝟐 " ]dans le mélange réactionnel.
4. Montrer que l’expression de 𝒑𝑯 du mélange lorsque le volume d’hydroxyde de sodium versé est
𝑽𝑩 = 𝟐 𝑽𝑩𝑬 s’écrit :
0,5 pt
0,5 pt
1. Écrire l’équation chimique modélisant la transformation ayant lieu entre l’acide (A) et l’alcool (B)
en utilisant les formules semi développées. Donner les noms des réactifs.
2. Nommer les éléments numérotés la figure.
3. À la fin de la réaction de la synthèse, il s’est formé la masse 𝒎𝒆𝒙𝒑 = 𝟏𝟑, 𝟔𝟔𝟖 𝒈 de l’éthanoate de
propyle. Calculer la valeur 𝒓 du rendement de la réaction.
4. Montrer que la valeur de la constante d’équilibre est 𝑲 ≈ 𝟒.
5. On réalise de nouveau la même expérience à la même température, en mélangeant cette fois le
volume 𝑽′𝒂𝒄 = 𝟓𝟕, 𝟐 𝒎𝑳 de l’acide (A) avec la quantité 𝒏𝟎 = 𝟎, 𝟐 𝒎𝒐𝒍 de l’alcool (B).
Quel est le rendement de la réaction de ce cas ?
3
Barème
0,5 pt
Barème
6. Pour obtient 100 % comme un rendement de la synthèse l’éthanoate de propyle, en utilisant cette
fois un autre réactif au lieu d’acide (A).
Écrire, en utilisant les formules semi-développées, l’équation de la réaction chimique produite
pour avoir ce rendement et nommer ce réactif.
Physique I (2,5 points)
Pr.Adil
Trouver l’expression de 𝒏𝑹 l’indice de réfraction de verre par rapport à la lumière
monochromatique rouge en fonction de 𝑳𝟏 et 𝑳. Calculer la valeur de 𝒏𝑹 .
0,5 pt
3. On remplace le faisceau de lumière monochromatique rouge par un faisceau de lumière
monochromatique violet de fréquence 𝝊𝑽 = 𝟔, 𝟖𝟖𝟎. 𝟏𝟎𝟏𝟒 𝑯𝒛, l’indice de réfraction de verre utilisé
par rapport cette lumière violette est 𝒏𝑽 = 𝟏, 𝟓𝟐𝟒.
L’indice de réfraction 𝒏 d’un milieu transparent pour une radiation monochromatique de
longueur d’onde 𝝀𝟎 dans l’air est modélisé par la relation :
0,75 pt
La fréquence d’une radiation lumineuse ne dépend pas du milieu de propagation ; elle dépend uniquement de la
fréquence de la source. La vitesse de propagation d’une onde lumineuse dans un milieu transparent est toujours plus
petite que la vitesse de sa propagation dans le vide et sa valeur dépend du milieu de propagation.
𝒏=𝑨+
Données :
- La célérité de la lumière dans l’air est 𝒄 = 𝟑 . 𝟏𝟎𝟖 𝒎. 𝒔'𝟏 .
- Pour des faibles écarts angulaires où 𝒕𝒂𝒏𝜽 ≈ 𝜽 avec 𝜽 exprimé en radian.
1. On réalise une expérience de diffraction à l’aide d’une lumière monochromatique rouge de
fréquence 𝝊𝑹 = 𝟒, 𝟔𝟏𝟓. 𝟏𝟎𝟏𝟒 𝑯𝒛.
On place à quelques centimètres de la source une fente verticale de largeur 𝒂.
La figure de diffraction est observée sur un écran vertical placé à une distance 𝑫 = 𝟑 𝒎 de la
fente. La figure de diffraction est constituée d’une série de taches situées sur une perpendiculaire
à la fente. La tache centrale est plus éclairée et plus large que les autres, sa largeur est
𝑳𝟎𝑹 = 𝟐, 𝟔 𝒎𝒎 . (Figure.1)
𝑩
𝝀𝟐𝟎
dont 𝑨 et 𝑩 sont des constantes qui dépendent du milieu.
Calculer la valeur de 𝑨 et celle de 𝑩 pour le verre utilisé.
Pr.Adil
Partie 1 :
Physique II (5,25 points)
Un professeur a consacré, avec ses élèves, une séance de travaux pratiques de physique pour :
Déterminer expérimentalement la valeur de la capacité d'un condensateur par deux méthodes différentes.
I.
Pr.Adil
En utilisant un générateur de courant :
Un premier groupe d’élèves d’une classe réalise, sous les directives
du professeur, le montage expérimental de la figure 1 constitué des
éléments suivants :
Pr.Adil
§ Un générateur idéal de courant qui alimente le circuit par un
courant électrique d'intensité 𝑰𝟎 = 𝟐, 𝟏 𝝁𝑨 ;
§ Un conducteur ohmique de résistance 𝑹 ;
§ Deux condensateurs (𝑪𝟏 ) et (𝑪𝟐 ) montés en série,
respectivement de capacités 𝑪𝟏 = 𝟔, 𝟐 𝝁𝑭 et 𝑪𝟐 inconnue ;
§ Un interrupteur 𝑲.
0,5 pt
0,25 pt
0,5 pt
1.1. Définir une onde électromagnétique.
1.2. Comment peut-on expérimentalement vérifier que la lumière monochromatique ?
1.3. Trouver l’expression de 𝒂 en fonction de 𝑳𝟎𝑹 , 𝑫 , 𝝊𝑹 et 𝒄 vitesse de la lumière dans l’air.
À l’instant 𝒕𝟎 = 𝟎𝒔 , un élève ferme le circuit.
À l'aide d'un système d’acquisition informatisé, le groupe
d’élèves obtient la courbe des variations de la tension 𝒖𝑨𝑩 du
condensateur équivalent à l’association des deux
condensateurs (𝑪𝟏 ) et (𝑪𝟐 ) en fonction du temps 𝒕
(figure 2).
Calculer largeur 𝒂.
2. On place entre la fente et l’écran un bloc de verre de forme parallélépipédique, de tel sort que le
faisceau de lumière monochromatique rouge se propageant dans les deux milieux l’air et le verre
en même temps. (Figure 2)
On donne : 𝑳 = 𝟐, 𝟏𝟔 𝒎𝒎 ; 𝑳𝟏 = 𝟏, 𝟑 𝒎𝒎
0,25 pt
Pr.Adil
0,5 pt
1. Quel est l’intérêt de monter des condensateurs
en série ?
2. Montrer que l’expression de la tension 𝒖𝑨𝑩
aux bornes du condensateur équivalent
s’écrit :
𝒖𝑨𝑩 =
𝑰𝟎
𝑪𝒆
.𝒕
Avec 𝑪7 la capacité du condensateur équivalent
aux deux condensateurs (𝑪𝟏 ) et (𝑪𝟐 ).
4
5
Pr.Adil
Barème
3. En exploitant la courbe de la figure 2. Montrer que la valeur de la capacité 𝑪𝟐 ≈ 𝟖 𝝁𝑭 .
4. Calculer l’énergie électrique 𝓔𝒆 stockée dans le condensateur équivalent à 𝒕 = 𝟑 𝒔.
0,5 pt
0,5 pt
II.
0,5 pt
0,5 pt
Un deuxième groupe d’élèves de la même classe réalise le montage
représenté par la figure 3 constitué par :
§ Un générateur de tension de force électromotrice 𝑬 = 𝟓 𝑽.
§ Deux conducteurs ohmiques de résistance 𝒓 = 𝟐𝟓 𝛀 et 𝑹
inconnue.
§ Le condensateur précédent de capacité 𝑪𝟐 déchargé
initialement.
§ Interrupteur 𝑲.
À un instant de date 𝒕 = 𝟎 , on ferme l’interrupteur 𝑲, un courant
d’intensité variable circule dans le circuit.
1. Établir l’équation différentielle vérifié par la tension 𝒖𝒄 aux
bornes de condensateur (𝑪𝟐 ).
2. La solution de l’équation différentielle s’écrit sous la
0,25 pt
0,25 pt
0,5 pt
9 , trouver les
Pr.Adil
Pr.Adil
0,25 pt
0,25 pt
𝒕
−𝝉
Physique III (5,25 points)
Pr.Adil
Partie 1 : Étude de l’oscillateur élastique :
On relie un corps solide (S), de masse 𝒎 = 𝟐𝟓𝟎 𝒈, à un ressort à spires non jointive, de masse négligeable et
de raideur 𝑲, et on fixe l’autre bout du ressort à un support fixe.
Le solide (S) peut glisser sans frottement sur un plan horizontal.
En étudiant la réponse du dipôle RC à un échelon de tension :
forme 𝒖𝒄 (𝒕) = 𝑨. 5𝟏 − 𝒆
0,25 pt
Barème
Pr.Adil
expressions de 𝑨 et 𝝉 en fonctions des paramètres du
circuit.
3. Déduire l’expression de la tension 𝒖𝑹 aux bornes du
conducteur ohmique 𝑹.
4. À l’aide d’un système d’acquisition informatisé permet
de tracer la courbe ci-contre la figure 4. Représentant
les variations de la tension 𝒖𝑹 = 𝒇(𝒕) . En utilisant la
courbe :
4.1. Vérifier que 𝑹 = 𝟏𝟎𝟎 𝛀.
4.2. Déterminer la capacité 𝑪𝟐 .
5. Montrer que 𝒕 = 𝝉. 𝒍𝒏(𝟏𝟎) est l’instant pour lequel
l’énergie électrique 𝓔𝒆 emmagasiné dans le
condensateur atteint 𝟖𝟏 % de sa valeur maximale.
0,5 pt
0,5 pt
0,5 pt
0,5 pt
On écarte le solide (S) de sa position d’équilibre de la distance 𝒙𝒎 , et on le libère sans vitesse initiale .
Pour étudier le mouvement de 𝑮, on choisit le référentiel galiléen 𝓡8𝑶, ⃗𝒊, : tel que la position de 𝑮 à l’origine
des dates est confondue avec l’origine 𝑶.
On repère la position de 𝑮 à l’instant t par l’abscisse 𝒙 dans le repère 𝓡8𝑶, 𝒊⃗, :.
1. En appliquant la deuxième loi de Newton sur le solide (S), établir l'équation différentielle du
mouvement. Déduire la nature de mouvement du solide (S).
2. La solution de l’équation différentielle est sous forme
𝟐𝝅
𝒙(𝒕) = 𝒙𝒎 . 𝒄𝒐𝒔 J . 𝒕 + 𝝋K
𝑻𝟎
établir l’expression de la période propre des oscillations.
3. Trouver en fonction de 𝒙𝒎 , 𝑲 et 𝒎 l’expression de la valeur absolue de la vitesse du centre
d’inertie du solide lorsqu’il passe par la position 𝒙 = 𝟎, 𝟓 𝒙𝒎 .
4. On prend comme état de référence de l’énergie potentielle élastique, la position d’équilibre et on
considère que l’énergie potentielle pesanteur du solide nulle.
4.1. Montrer que l’énergie mécanique de l’oscillateur se conserve.
4.2. En se basant sur la courbe suivante, déterminer la valeur de 𝒙𝒎 et celle de la période propre.
4.3. Déterminer les positions du centre d’inertie du solide lorsque 𝑬𝒄 = 𝟐 𝑬𝒑 .
Pr.Adil
Partie 2 :
0,5 pt
0,5 pt
0,5 pt
Cette partie de l’exercice vise à étudier la modulation d’amplitude.
L’expression de la tension modulée d’amplitude s’écrit sous la forme :
𝒖𝒔 (𝒕) = 𝟒* 𝟎, 𝟓. 𝒄𝒐𝒔(𝟒. 𝟏𝟎𝟒 𝝅𝒕) + 𝟎, 𝟕𝟓 6 𝒄𝒐𝒔( 𝟒. 𝟏𝟎𝟓 𝝅𝒕)
1. Déterminer la qualité de cette modulation.
2. Exprimer 𝒖𝒔 (𝒕) sous forme de la somme de trois fonctions sinusoïdales.
3. En choisissant l’échelle 𝟏 𝒄𝒎/𝑽, représenter le spectre des fréquences de cette tension modulée
d’amplitude.
6
7
Barème
0+
Partie 2 : Étude de l’oscillateur pesant :
Un pendule pesant est constitué d’une tige homogène 𝑶𝑨 de masse 𝒎 = 𝟏𝟎𝟎 𝒈,
de centre d’inertie 𝑮 et de longueur 𝑳 = 𝟑𝟓 𝒄𝒎 pouvant effectuer un mouvement
de rotation dans un plan vertical autour d’un axe horizontal (𝜟) passant par son
extrémité 𝑶 (figure 1).
Soit 𝑱∆ le moment d’inertie du pendule par rapport à l’axe (𝜟) .
On étudie le mouvement du pendule dans un repère lié à un référentiel terrestre
supposé galiléen.
On écarte la tige 𝑶𝑨 de sa position d’équilibre stable d’un petit angle 𝜽𝒎 = 𝟏𝟐°,
dans le sens positif, puis on la lance avec une vitesse angulaire initiale à l’instant
de date 𝒕 = 𝟎.
On repère la position du pendule à un instant de date 𝒕 par l’abscisse angulaire 𝜽.
Le centre 𝑮 est confondu avec 𝑮𝟎 quand le pendule passe par sa position
d’équilibre stable (figure 1).
On néglige tous les frottements et on choisit le plan horizontal passant par 𝑮𝟎
comme état de référence de l’énergie potentielle de pesanteur (𝑬𝒑𝒑 = 𝟎) .
Données :
L’intensité de pesanteur : 𝒈 = 𝟗, 𝟖 𝒎. 𝒔'𝟐
L’expression du moment d’inertie de la tige par rapport à l’axe (𝜟) est :
Pr.Adil
𝟏
𝑱∆ = 𝒎. 𝑳𝟐
𝟑
𝜽𝟐
0,5 pt
1. Trouver l’expression de l’énergie potentielle de pesanteur du pendule pesant à un instant t, dans
le cas des oscillations de faible amplitude, en fonction de 𝜽 , 𝑳 , 𝒎 et 𝒈 intensité de la pesanteur.
2. Par une étude énergétique, montrer que l’équation différentielle du mouvement s’écrit :
𝜽̈ +
𝟑𝒈
𝜽=𝟎
𝟐𝑳
3. La solution de l’équation différentielle s’écrit sous la forme :
𝟐𝝅
𝜽(𝒕) = 𝜽𝒎 . 𝒄𝒐𝒔 J 𝒕 + 𝝋K
𝑻𝟎
0,5 pt
0,5 pt
0,5 pt
4
المدة
7
المعامل
الفيزياء والكيمياء
العلوم الرياضية )أ( و)ب( خيار فرنسي
المادة
الشعبة أو المسلك
L’usage de la calculatrice scientifique non programmable est autorisé.
La formule littérale doit être donnée avant l’application numérique et le résultat
accompagné de son unité.
Les exercices peuvent être traités séparément selon le choix du candidat(e).
Pour les angles petits : 𝒄𝒐𝒔𝜽 ≈ 𝟏 − 𝟐 Où 𝜽 est exprimé en radian.
On prendra : 𝝅𝟐 = 𝟏𝟎
0,5 pt
اﻻمتحان التجريبي
المسالك الدولية – خيار فرنسية
2022 دورة يونيو
où 𝑻𝟎 est la période propre du pendule.
3.1. Déterminer l’expression de la période propre.
3.2. Calculer la longueur 𝒍 du pendule simple synchrone avec le pendule pesant étudié.
4. En se basant sur la conservation de l’énergie mécanique, exprimer la vitesse angulaire 𝜽̇(𝒕) à un
instant 𝒕 en fonction 𝜽(𝒕) de 𝜽𝒎 , et 𝜽̇é𝒒 la vitesse angulaire à la position d’équilibre.
Le sujet comporte quatre exercices : un exercice de chimie et trois exercices de physique.
Exercice 1 : Chimie (7 points)
-Partie 1 :À propos de l’acide méthanoïque.
-Partie 2 : Pile :Argent/Fer
Exercice 2 : Physique nucléaire (3points)
-Désintégration de l’iode
-la technique de scintigraphie pour les glandes surrénales
Exercice 3 : Transformations électriques :(5points)
-Partie1 : Réponse d’un dipôle RC à un échelon de tension
-Partie2 : Réponse d’un dipôle RL à un échelon de tension
-Partie3 : Dipôle RLC en régime forcée.
Exercice 4 : Mécanique (5points)
-Partie 1 : Etude du mouvement du centre de gravité d’une balle
-Partie 2 : Pendule de torsion
Page 1 sur 7
8
Exercice 1 :(7pts)
Partie 1 : Détermination de la concentration 𝑪𝑨 d’acide méthanoïque par deux méthodes
Première méthode :
On considère une solution aqueuse (SA) d’acide
méthanoïque de concentration 𝐶 et de pH=2,9 à 25°C
1-Ecrire l’équation de la réaction de l’acide méthanoïque et
l’eau. (0.25)
2-Déterminer l’expression du 𝝉 le taux d’avancement de la
réaction en fonction de [𝐻 𝑂 ] éq et 𝐶 (0.25)
𝐾 (𝐻𝐶𝑂𝑂𝐻⁄𝐻𝐶𝑂𝑂 ) en fonction 𝐶 𝑒𝑡 𝑝𝐻 (0.25)
4-On définit le pourcentage basique dans la solution par la
(
(
)
(
)
Hélianthine
Rouge de phénol
Zone de virage
3,1 - 4,4
6,8 - 8,4
phénolphtaléine
8,2
-
10
On donne : 𝐾 = 10
Partie 2 : Pile Argent/Fer
On trempe une électrode d’argent dans un bécher qui contient un
volume 𝑉 = 100𝑚𝐿 d’une solution de nitrate d’argent (𝐴𝑔( ) +
𝑁𝑂 ( ) ) de concentration molaire 𝐶 = 0,2 mol/L et on trempe une
électrode de fer dans un autre bécher qui contient un volume
𝑉 = 100𝑚𝐿 d’une solution de sulfate de fer (𝐹𝑒( ) + 𝑆𝑂 ( ) ) de
concentration molaire 𝐶 = 0,2 mol/L.
On relie les deux solutions par un pont salin et on monte en série les
pôles de la pile avec un conducteur ohmique , un ampèremètre et un
interrupteur .Lorsqu’on ferme le circuit un courant électrique
d’intensité I constante circule dans le circuit.
Données :
3-Donner l’expression de la constante d’acidité
relation : 𝛼(𝐻𝐶𝑂𝑂 ) =
Indicateur
)
Montrer que le pourcentage basique est :
𝛼(𝐻𝐶𝑂𝑂 ) =
(0. 5)
5-Les courbes de la figure 1 représente l’évolution du pourcentage des espèces acide et base du couple
𝐻𝐶𝑂𝑂𝐻⁄𝐻𝐶𝑂𝑂 )
5-1-Associer chaque courbe à l’espèce correspondante . (0.25)
1-Calculer 𝑄 , le quotient de la réaction initial du système chimique. (0.25)
5-2-A l’aide des courbes déterminer :
2-Déterminer en justifiant la réponse le sens d’évolution du système chimique au cours du fonctionnement de la
a-La constante d’acidité pKA (0.25)
b- Le taux d’avancement 𝝉
pile. (0.25)
(0.25)
3-Représenter le schéma conventionnel de la pile. (0.25)
6-Déduire la valeur de la concentration molaire 𝐶 . (0.5)
4-La courbe de la figure 3 représente les variations de la concentration des ions d’argent [𝐴𝑔 ] en fonction du
temp t .
Deuxième méthode :
Pour déterminer la concentration molaire de la solution
précédente par dosage acido-basique on prend un volume
𝑉 = 9,5𝑚𝐿 de la solution (SA) et on le dose par une
solution (SB) d’hydroxyde de sodium (𝑁𝑎 + 𝑂𝐻
de concentration 𝐶 = 2. 10 𝑚𝑜𝑙/𝐿 .
La courbe de la figure 2 représente les variations du pH en
fonction du volume versé 𝑉 .
4-1-Montrer que :
(0. 5)
4-2-A l’aide de la courbe déterminer la valeur de l’intensité I du courant électrique. (0. 5)
4-3-Montrer que l’expression 𝑄 , le quotient de la réaction à un instant t s’écrit sous la forme :
1-Ecrire l’équation du dosage. (0.25)
Puis calculer sa valeur à l’instant 𝑡 = 1000𝑠
(0.75)
2-Déterminer la constante d’équilibre associé à la réaction
du dosage et calculer sa valeur , déduire. (0.75)
3-Calculer la concentration molaire 𝐶 . (0.25)
4-Déterminer l’indicateur coloré convenable pour ce dosage. (0.25)
5-Déterminer le volume VB qu’il faut ajouter au mélange réactionnel pour que
(
)
(
)
= 1,6 (0. 5)
Page 2 sur 7
Page 3 sur 7
1-1-Montrer que la capacité Ce du condensateur équivalent aux deux condensateurs associés en série est :
Exercice 2 :(3points)
L’iode est considéré une matière essentielle dans la synthèse des hormones thyroïdiennes .cette hormone est
essentielle dans la croissance . Pour un individu normal 100mL du sang contiennent 10μg d’iode.
Chaque instant la tyroïde absorbe du sang la même quantité sous forme d’iodure et le secrète sous forme
d’hormones. La quantité d’iode dans le sang reste constante.
Grace à l’iode radioactif on suit le métabolisme d’iode et la mesure des hormones. Parmi les isotopes d’iode on
trouve
𝐼 𝑒𝑡
𝐼 un d’entre eux stable et l’autre radioactif 𝛽 .
(0.25)
1-2-Montrer que l’équation différentielle vérifiée par la tension u2 (t) entre les bornes du condensateur de
(0. 5)
capacité C2 s’écrit :
1-calculer l’énergie de liaison par nucléon pour chaque isotope et déduire l’isotope stable et l’isotope
radioactif. (0. 5)
2-écrire l’équation de désintégration de l’isotope radioactif sachant que le noyau fils est 𝑋𝑒 en précisant
A et Z. (0.25)
fonction des paramètres du circuit. (0. 5)
3-calculer l’énergie libérée par la désintégration de 𝑁 = 10 isotopes radioactifs. (0. 5)
4-pour suivre le métabolisme de l’iode
𝐼 et la mesure des hormones composées on utilise la téchnique de
scintigraphie pour les glandes surrénales en injectant le patient par une solution d’iode
𝐼 d’activité radioactive
37MBq.
4-1-quelle est la masse d’iode
𝐼 injectée.La mesure de l’activité radioactive de l’echantillon étudié à l’instant
𝑡 est 𝑎 = 24𝑀𝐵𝑞. (0. 5)
4-2-montrer que :
Calculer sa valeur en (J)
𝐼
𝑛
Sa masse(u)
130,9061
126,9044
1,00877
𝑒
54858.10
a- E . (0.25)
1-4-2- Montrer que C1 = 4 μF. (0.25)
calculer la durée nécessaire pour la désintégration de 99% d’iode 131. (0. 5)
𝐼
1-4-Les courbes de la figure 2, représentent l’évolution des
tensions u2 (t) et uR (t).
La droite (T) représente la tangente à la courbe représentant
u2 (t) à l’instant t = 0 .
1-4-1-Déterminer la valeur de :
b- u2 (t) et celle de u1 (t) en régime permanent. (0. 5)
(0.75)
5-On injecte un patient par l’iode 131 radioactif.
Noyau ou
particule
1-3-La solution de cette équation
différentielle s’écrit sous la forme :𝑢 (𝑡) = 𝐴(1 − 𝑒 )
.Déterminer l’expression de A et celle de 𝛼 en
𝑝
Xe
1,00722
130,9050
La demi-vie de l’iode radioactif est 𝑡 / = 8𝑗𝑜𝑢𝑟𝑠.
Exercice3 :(5points)
Partie1 : Réponse d’un dipôle RC à un échelon de tension
Les circuits RC, RL et RLC sont utilisés dans les montages électroniques des appareils électriques. On se
propose, dans cette partie, d’étudier le dipôle RC .
Le montage électrique schématisé sur la figure 1 comporte :
-un générateur idéal de tension de f.é.m E,
-deux condensateurs de capacité C1 et C2 = 2 μF ,
-un conducteur ohmique de résistance R=3kΩ
-un interrupteur K à double position.
On place l’interrupteur K dans la position (1) à un instant pris
comme origine des dates (t=0).
Partie2 : Réponse d’un dipôle RL à un échelon de tension
2-Pour déterminer l’inductance L et la résistance r d’une bobine (b) , on réalise le circuit électrique représenté
dans la figure 1 qui est formé de :
*la bobine (b).
*un conducteur ohmique (D) de résistance R=90Ω.
*interrupteur K.
*générateur (G) de tension continue de force électromotrice E=6V et de
résistance négligeable.
On ferme l’interrupteur K à t=0
2-1-déterminer l’équation différentielle vérifié par l’intensité du courant
𝑖 au cours de l’établissement du courant. (0.25)
2-2-la courbe de la figure 4 représente la fonction
=f(t) .
montrer que la valeur de l’inductance L=0,5H puis calculer la valeur
de la résistance 𝑟 de la bobine. (0. 5)
2-3-l’expression 𝒊(𝒕) = 𝑰𝑷 (𝟏 − 𝒆 𝒕⁄𝝉) est une solution de l’équation
différentielle telle que 𝝉 est la constante du temps déduire
l’expression 𝝉 en fonction de L , R et r. (0.25)
𝑳𝒅𝒊
2-4-exprimer en fonction du temps la grandeur 𝒅𝒕 au cours de
l’établissement du courant et calculer sa valeur à 𝑡 = 𝜏. (0.25)
Page 4 sur 7
Page 5 sur 7
Partie3 :Dipôle RLC en régime forcée
On monte en série entre deux points M et N la bobine (b) et le conducteur ohmique (D) précédant avec un
condensateur de capacité C
On applique entre le dipôle MN une tension alternative
sinusoïdale : 𝒖𝑴𝑵 (𝒕) = 𝑼√𝟐 𝒄𝒐𝒔(2𝝅𝑵𝒕 + 𝝋) sa tension efficace
Constante U=3V et sa fréquence N réglable et un courant d’intensité
𝒊(𝒕) = 𝑰√𝟐 𝒄𝒐𝒔(2𝝅𝑵𝒕) circule dans le circuit.
La figure3 représente les variations de l’impédance Z du circuit en
fonction de la fréquence N.
3-1-à l’aide de la figure5 déterminer à la résonance les valeurs de
l’impédance 𝑍 𝑒𝑡 𝑙𝑎 𝑓𝑟é𝑞𝑢𝑒𝑛𝑐𝑒 𝑁 et déduire la valeur de la
montrer que la valeur de la vitesse initiale est V0 = 13,6 m/s, et
capacité C du condensateur . on prend 𝜋 = 10 (0.75)
Montrer que l’équation de cette courbe s’écrit : (0. 5)
3-2-lorsqu’on règle la fréquence successivement sur les valeurs
que l’angle α est α = 17°. (0. 5)
3-Etablir l’équation de la trajectoire de G dans le repère (𝑂, 𝚤⃗, 𝚥⃗)
(0. 5)
4-Sachant que la balle n’est interceptée par aucun joueur, a-t-elle
vérifié les deux conditions nécessaires pour valider le service ?
Justifier. (0. 5)
5-On fait varier l’angle α . Soit (𝒞) la courbe qui limite l’ensemble
des points pouvant être atteint par cette balle Cette courbe porte le
nom de parabole de sûreté.
𝑰
𝑁 𝑒𝑡 𝑁 avec 𝑁 < 𝑁 l’intensité efficace prend la valeur 𝑰= 𝟎
√𝟐
telle que 𝑰𝟎 l’intensité efficace à la résonance , déterminer la largeur de la bande passante ∆𝑁 et calculer le
coefficient de qualité Q du circuit. (0. 5)
3-3-Calculer la puissance dissipée par effet joule à la résonance. (0.25)
Exercice 4 :(5points)
Partie1 : Etude du mouvement du centre de gravité d’une balle.
Pendant un match de volley-ball, un élève a enregistré une séquence vidéo du mouvement de la balle à partir de
l’instant de l’exécution du service à partir d’un point A situé à une hauteur H du sol. Le joueur ayant exécuté le
service se trouve à une distance d du filet (Figure 1).
Pour que le service soit bon, la balle doit vérifier les deux conditions suivantes :
Passer au-dessus du filet dont la partie supérieure se trouve à une hauteur h du sol ;
Tomber dans le terrain de l’adversaire de longueur D.
Données :
On néglige les dimensions de la balle ainsi que l’action de l’air.
On prendra l’intensité de la pesanteur : g = 10 m.s-2
H = 2,60 m , d = D = 9 m , h = 2,50 m.
On étudie le mouvement de la balle dans un repère orthonormée (𝑂, 𝚤⃗, 𝚥⃗) lié à la terre et supposé galiléen.
A l’instant t = 0, la balle se trouve en A et le vecteur vitesse initiale 𝑉⃗ constitue l’angle α avec l’horizontal.
(Figure 1)
Un traitement informatique de la vidéo avec un logiciel
convenable, a permis d’obtenir les courbes représentées sur
la figure 2.
Les courbes vx(t) et vy(t) représentent les variations des
composantes du vecteur vitesse du ballon dans le repère
(𝑂, 𝚤⃗, 𝚥⃗)
1-Par application de la deuxième loi de Newton, établir
l’expression de vx(t) en fonction de : V0, α, et l’expression
Partie2 :
On fixe au centre O d’une poulie (P) les extrémités de deux fils de torsion identiques et horizontales de masse
négligeables et ont même constante de torsion C. Les autres extrémités des fils sont fixes aux points M1 et M2.
On fixe en un point A du périmètre de la poulie et à une distance r de o un solide A de masse m=40g supposé
ponctuel.
Le moment d’inertie de la poulie et le solide A par rapport à l’axe (∆) qui est confondu avec les fils
est : 𝑱∆ = 𝑱𝟎 + 𝒎𝒓𝟐
À l’équilibre les fils ne sont pas tordus et le solide se trouve sur la ligne verticale passant par O.
𝝅
Partir de la position d’équilibre on fait tourner la poulie d’un angle 𝜽𝒎 = 𝟏𝟖 rad. dans le sens positif puis on la
lâche sans vitesse initiale à t=0.
On repère la position de A à l’instant t par l’abscisse angulaire 𝜃 formé par OA et la ligne verticale qui passe par
O. On considère le système (S) : {poulie ; le solide A ; fils de torsion }.
1-en se basant sur l’étude énergétique montrer que l’équation différentielle du mouvement de la poulie et le
solide A dans le cas des oscillations de faible amplitude s’écrit :
𝜃̈ +
∆
.𝜃 = 0
(0.75)
On choisit le plan horizontal qui passe par le point O comme référence de l’énergie potentielle de pesanteur et
l’état ou les fils ne sont pas tordus référence de l’énergie potentielle de torsion.
2-déterminer la constante C de torsion sachant que la durée de 10
oscillations est ∆t=8s. (0.5)
3-écrire l’équation horaire 𝜃(𝑡) du mouvement. (0.25)
4-montrer que l’énergie cinétique de la poulie s’écrit sous la forme :
𝑬𝑪 = 𝑲(𝜽𝟐𝒎 -𝜽𝟐 ) puis déduire. (0. 5)
L’expression de K en fonction de m ; g ; r et C.
5-trouver en fonction de K ; m ; g ; r et 𝜃 l’expression de l’énergie
mécanique 𝑬𝒎 du système. (0. 5)
𝜽𝟐
On prend 𝒄𝒐𝒔𝜽 = (𝟏 − 𝟐 ).
de vy(t) en fonction de : V0, α, g et t. (0. 5)
On donne : 𝑟 = 10𝑐𝑚 ; 𝐽 = 10 𝐾𝑔 ; 𝜋 = 10 ; 𝑔 = 10𝑚. 𝑠
2-En exploitant les deux courbes (Figure 2),
Page 6 sur 7
Page 7 sur 7