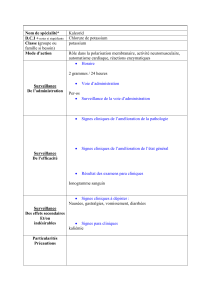
Feuille d'exercices Physique-Chimie : Constituants de l'atome
Telechargé par
achraf el bouziani

Exercice 1
Ionogramme plasmatique
Mesures
Valeurs limites
Sodium
3,24g/L
(3,10 ; 3,34)
Potassium
0,12g/L
(0,14 ; 0,22)
1. Examinant les résultats de son analyse de sang, préciser si les teneurs en ions sodium et potassium de ce
patient sont suffisantes.
2. Pour compenser le déficit observé. Le médecin prescrit un médicament. Sur la notice en peut lire :
Chlorure de potassium 600mg par comprimé soit 314mg de potassium.
Le patient peut également manger des aliments riches en potassium tel que le banane : 100g de banane contiennent
385mg de potassium.
3. Quelle masse de banane doit-il consommer pour absorber l’équivalent d’un comprimé ?
On suppose que tout le potassium présent dans le banane est assimilé par l’organisme.
Exercice 2
Les résultats d’analyses biochimiques d’un adulte donnent les résultats suivant :
- Urée : 3,5.10−1 g. L−1 - Glucose : 7,5.10−3 g. L−1
Les valeurs normales sont dans le sang :
- Urée : concentration comprise entre 3 et 8 mmol. L
−1 de formule brute CH4N2O.
- Glucose : concentration comprise entre 3 et 8 mmol. L
−1 de formule brute C6H12O6.
Ce patient soufre-t-il d’hyperglycémie (trop de glucose) ou d’insuffisance rénale (trop d’urée) ?
Donnée masse molaire (en g. mol−1) : M(C) = 12 ; M(O) = 16 ; M(H) = 1 ; M(N) = 14
Exercice 3
Pour déterminer la densité de l’éthanol ; on mesure à vide la masse d’une fiole jaugée de 50, 0ml , on trouve m1 =
61, 7g . On introduit de l’éthanol jusqu’au niveau du trait de jauge et on mesure la masse de la fiole jaugée
contenant de l’éthanol une deuxième fois, on trouve m2 = 101, 2g.
Sachant que la masse de 50ml d’eau est égale à 50g ; calculer d la densité de l’éthanol par rapport à l’eau.
Exercice 4
La teneur en ions nitrate NO−3 dans l’eau peut être déterminée simplement grâce à des bandelettes tests. Le résultat
de cette analyse pour une eau de robinet indique une teneur comprise entre : Cm1 = 10mg/l ; Cm2 = 25mg/l
1. Entre quelles limites se situe la masse d’ions nitrate absorbés par un enfant qui consomme, chaque jour, un
volume V = 1, 2l de cette eau ?
2. Sachant que la Dose Journalier Admissible (D,J,A ) des ions nitrate est égale à 3, 65mg par kg de masse corporelle ,
préciser si cet enfant , de masse m = 15kg court de risque en consommant cette eau ?
Exercice 5
Lors des orages, le diazote et le dioxygène réagissent pour donner le dioxyde d’azote NO2 . Celui - ci réagit avec l’eau
pour donner de l’acide nitrique HNO3 et du monoxyde d’azote NO.
1.Écrire les équations chimiques de ces réactions.
2. La masse moyenne d’acide nitrique apporté annuellement par les pluies acides est estimée à 7, 0 kg par hectare.
Déterminer la masse totale d’acide nitrique apporté ainsi chaque année sur le globe terrestre.
Données : Rayon terrestre RT = 6400km Surface S d’une sphère de rayon R, S = 4.π.R2 1 hectare =104m2
Professeur : SAID TAYOUBI
Année Scolaire : 2022/2021
Série 2 : les
constituants de l’atome
Etablissement : Lycée Aghbalou Qualifie
Option : Troisième Année collège
Matière : Physique-Chimie
1
/
1
100%