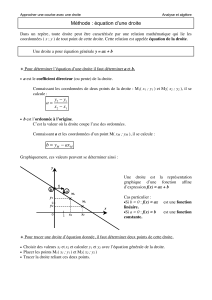
Exemple extrait du cours de NGUYEN
Chemical Engineering Thermodynamics II (CHE 303 Course Notes) T.K. Nguyen
Chemical and Materials Engineering Cal Poly Pomona (Winter 2009)
https://www.cpp.edu/~lllee/TK303.pdf
Déterminer la fugacité du CO2 à 310°K et 1.4.106 Pa en utilisant l’équation de Van der Waals
l’équation d’état s’écrit
avec : a = 0.3658 Pa.m6/mol2, b = 4.286.10-5 m3/mol
Solution
A partir de la définition la fugacité, nous avons
(E-1)
Comme l'équation d'état est donnée explicitement en termes de pression P, nous devons
réarranger l'équation ci-dessus pour que le terme vdP puisse être facilement intégré.
Pour un gaz parfait, nous avons
(E-2)
En retranchant l'équation (E-1) de l'équation (E-2) on obtient
En intégrant l'équation de 0 à P, on obtient
(E-3)
Nous allons maintenant changer la variable d'intégration de P à v en utilisant la différentielle
d’un produit de deux fonctions
En utilisant la définition du facteur de compressibilité,
nous obtenons

En remplaçant de l'équation ci-dessus dans l'équation (E-3) on obtient
(E-4)
En développant le membre droit de l'équation on obtient
(E-5)
Nous pouvons intégrer la deuxième intégrale sur la droite de l'équation (E-5)
Ainsi
Nous allons maintenant procéder à l'intégration par rapport à en utilisant l'équation d'état de
Van der Waals
D’où
(E-6)

Nous devons évaluer le facteur de compressibilité Z à partir de l'équation d'état de Van der
Waals, qui s’écrit sous forme cubique
avec
et
les valeurs de Z obtenues à partir de la solution de l'équation de Van der Waals vont servir
pour déterminer la fugacité du CO2. (Z = 0.94359)
En termes de A et B, l'équation (E-6) devient
(E-7)
La fugacité peut être déterminée à partir de l'équation (E-7) avec les valeurs de Z
obtenues.
1
/
3
100%