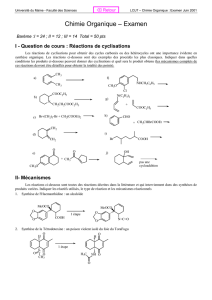
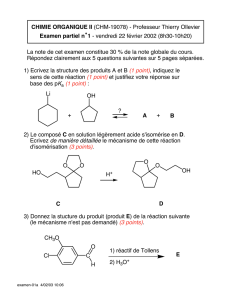
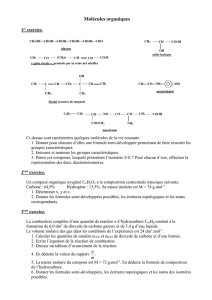
Equilibre Chimique : Corrigé d'Activité Expérimentale Terminale
Telechargé par
Noah Vila

Niveau : Terminale
Spécialité
Thème : Constitution et transformations de la
matière
Chapitre 8 : Evolution spontanée d’un système
chimique
Activité expérimentale – Etude d’un équilibre chimique - Corrigé
1. Caractère total ou non total d’une réaction chimique
Travail à effectuer
On rappelle que l’équation de la réaction associée à la transformation chimique de l’acide éthanoïque avec l’eau est :
1. Construire un tableau d’avancement de la réaction correspondant à l’expérience décrite dans le document 2.
Etat du système
Avancement
Etat initial
0
Solvant
0
0
Etat final
Solvant
2. On suppose la réaction totale. Calculer la valeur de l’avancement maximal noté .
Si on suppose la transformation totale alors l’acide éthanoïque est le réactif limitant.
On a donc soit .
3. En utilisant la mesure de pH effectuée lors de l’expérience, calculer la valeur de l’avancement final noté .
Par définition, et, d’après le tableau d’avancement, donc .
De plus, par définition, donc soit
4. En déduire le taux d’avancement final de la réaction puis conclure quant au caractère total ou non de la transformation
chimique qui a lieu entre l’acide éthanoïque et l’eau.
Par définition
donc la transformation chimique qui a lieu entre l’acide éthanoïque et l’eau n’est pas totale.
2. Quotient de réaction à l’état final
Travail à effectuer
1. Compléter le tableau d’avancement de la réaction ci-dessous pour une concentration molaire c en acide éthanoïque
et un volume V de solution :
Etat du système
Avancement
Etat initial
0
Solvant
0
0
Etat final
Solvant
2. A l’aide du tableau d’avancement :

3. Après avoir complété le tableau ci-dessous, montrer que la valeur du quotient de réaction à l’état final ne dépend
pas de la composition initiale du système à une température donnée.
Solution
Solution 1
Solution 2
Solution 3
pH
2,9
3,4
3,6
1
/
2
100%