Cours de chimie : Sécurité, Organique, Acides/Bases, Examens
Telechargé par
L'IntOuchable

Le SOLEIL
1
AVANT-PROPOS
Ce document est conforme au programme officiel. Sans prétention aucune de
détenir le monopole de la science infuse, j’ ai voulu mettre à la disposition des
élèves des classes de Terminales C,D&E, un outil de travail dans lequel
apparaissent de façon subtile presque tous les éléments leur permettant d’être à
la hauteur de nombreux défis qui les attendent dans cette classe, que ce soit à
l’examen officiel ou aux concours. Dans cet espace où foisonnent des
publications au même objectif, nous avons voulu nous démarquer par la
simplicité de l’approche, la pertinence des sujets abordés, l’approfondissement
du cours, la démonstration de l’inséparable lien qu’il y a entre la théorie et la
pratique. Nous vous proposons un cours presque complet qui n’occulte aucune
notion. Notre démarche vise à montrer à l’élève que le cours reste la pierre
angulaire de l’édification de ses connaissances. Nous avons ainsi voulu nous
démarquer de la démarche qui consiste à vous proposer un pseudo-cours d’une
demi-page et ensuite une flopée d’exercices car il faut prêcher par l’exemple. En
classe ,les enseignants demandent aux élèves d’apprendre le cours avant de se
jeter sur les exercices mais, quand ils produisent un document ,ils font tout le
contraire de ce qu’ils disent, induisant les élèves en erreur.
Ce livre est réparti en cinq thèmes : la sécurité au laboratoire, la chimie
organique, les acides et bases en solution aqueuse, la chimie générale et les
sujets d’examen.
L’élève, l’enseignant ou tout autre lecteur trouvera ici la réponse aux
nombreuses questions qui taraudent son esprit, car, comme dirait un auteur
contemporain , un bon livre est celui qui répond par foisonnement de points
d’interrogation . Je vous laisse la latitude de faire votre religion à la fin de la
lecture de ce document. Comme toute œuvre humaine n’est jamais parfaite, ce
document peut contenir des coquilles. Nous vous serons gré de nous faire
parvenir vos remarques, critiques et suggestions pour l’amélioration du contenu
de ce fascicule afin que ce bébé puisse se lever pour, non seulement pour
marcher, mais surtout courir pour vous apporter des informations dont vous
avez besoin et ainsi étancher votre soif de connaissances et savoirs.
Sincères remerciements à Kameni Kadji Achille alias Achille Phone.
Contacts : e-mail : dongm[email protected]
Tel : 96-30-76-34 / 22-66-13-92
L’ auteur
Toute reproduction totale ou même partielle de ce manuel est interdite. Les contrevenants
s’exposent à des poursuites judiciaires (loi de 1957)
Le SOLEIL
2
SOMMAIRE
CHAPITRE INTITULE PAGE
THEME 1 : LA SECURITE AU LABORATOIRE
CONSIGNES 3
THEME 2 : LA CHIMIE ORGANIQUE
CHAPITRE : 1
LES ALCOOLS 9
CHAPITRE :2 LES ALDEHYDES ET LES
CETONES 23
CHAPITRE :3 LES ACIDES CARBOXYLIQUES 29
CHAPITRE :4 LES AMINES 45
CHAPITRE :5 LES ACIDES α-AMINES 51
CHAPITRE :6 NOTION DE STEREOCHIMIE 58
THEME 3 : LES ACIDES ET BASES EN SOLUTION
AQUEUSE
CHAPITRE :7
GENERALITES SUR LES ACIDES
ET LES BASES EN SOLUTION
AQUEUSE
64
CHAPITRE :8
FORCE D’UN ACIDE ET D’UNE
BASE
NOTION DE COUPLE ACIDE/BASE
73
CHAPITRE :9 REACTIONS ACIDES/BASES
APPLICATION AUX DOSAGES 92
THEME 4 : CHIMIE GENERALE
CHAPITRE :10
NOTION DE CINETIQUE
CHIMIQUE 115
CHAPITRE :11
LES NIVEAUX D’ENERGIE 124
THEME 5 :
LES SUJETS D’EXAMEN
SUJETS EXAMEN BLANC , EXAMEN
ECRIT, EXAMEN T.P. 132

Le SOLEIL
3
THEME I : LA SECURITE AU LABORATOIRE
Ce thème apporte les éléments qui permettront aux élèves d’aborder sereinement l’examen
T.P. de chimie.
Avant d’égrener les consignes à respecter dans un laboratoire, définissons d’abord la chimie
et ensuite donnons les qualités d’un bon chimiste.
La chimie est la science qui étudie la constitution, les propriétés et les transformations de la
matière.
Les qualités d’un bon chimiste sont : l’ordre, la propreté, le calme
La manipulation dans un laboratoire de chimie nécessite de connaitre le matériel et de
respecter des règles de sécurité.
1-CONSIGNES DE BASES
-Travailler sur une paillasse propre et bien dégagé
-Manipuler debout, au dessus de la paillasse, avec les sièges rangés en dessous
-Pour toute manipulation, porter la blouse en coton toujours boutonnée et des lunettes de
protection.
-En cas d’utilisation de produit corrosif ou toxique, porter des gants
-En cas d’utilisation de produit inflammable, éloigner toute source de chaleur (chauffe-ballon,
plaque chauffante, flamme….)
2-LA MANIPULATION DE PRODUITS CHIMIQUES
-Avant d’utiliser un produit chimique, lire l’étiquette et respecter les consignes de sécurité
indiquées sur les pictogrammes de danger et les codes R et S.
-Ne prélever aucun solide avec les doigts ; utiliser une spatule
-Ne jamais pipeter de réactif avec la bouche ; toujours utiliser une pipette munie d’une poire,
d’une tétine, d’une propipette ou d’un pipeteur. Toujours reboucher le flacon après usage.
-Enfin de manipulation, ne pas jeter les solutions dans l’évier mais utiliser les bacs de
récupération lorsque ceux-ci existent. Danger : la plupart de produit chimique étant corrosif,
ils risquent d’oxyder l’évier qui est en fer ou en aluminium. Toujours diluer les solutions
rejetées à l’évier, en laissant couler l’eau quelques instants.
-Verser les produits du coté opposé à l’étiquette.
-Etiqueter convenablement tout récipient contenant des produits chimiques
-Ne jamais verser de l’eau dans un acide concentré mais toujours de l’acide dans l’eau car il y
risque de projection de l’acide avec pour conséquence des brûlures.
-Ne jamais ajouter de la pierre ponce dans un liquide chaud.
2-COMPORTEMENTS INTERDITS AU LABORATOIRE
-Boire -Manger -Courir -Pipeter à la bouche -Prélever un solide avec les doigts -Diriger
un tube à essai chauffé vers soi même ou vers ces camarades -Distiller à sec -Reconnaitre un
produit par son odeur –Utiliser un produit inflammable à côté d’une source de chaleur.-Lancer
un objet
Le SOLEIL
4
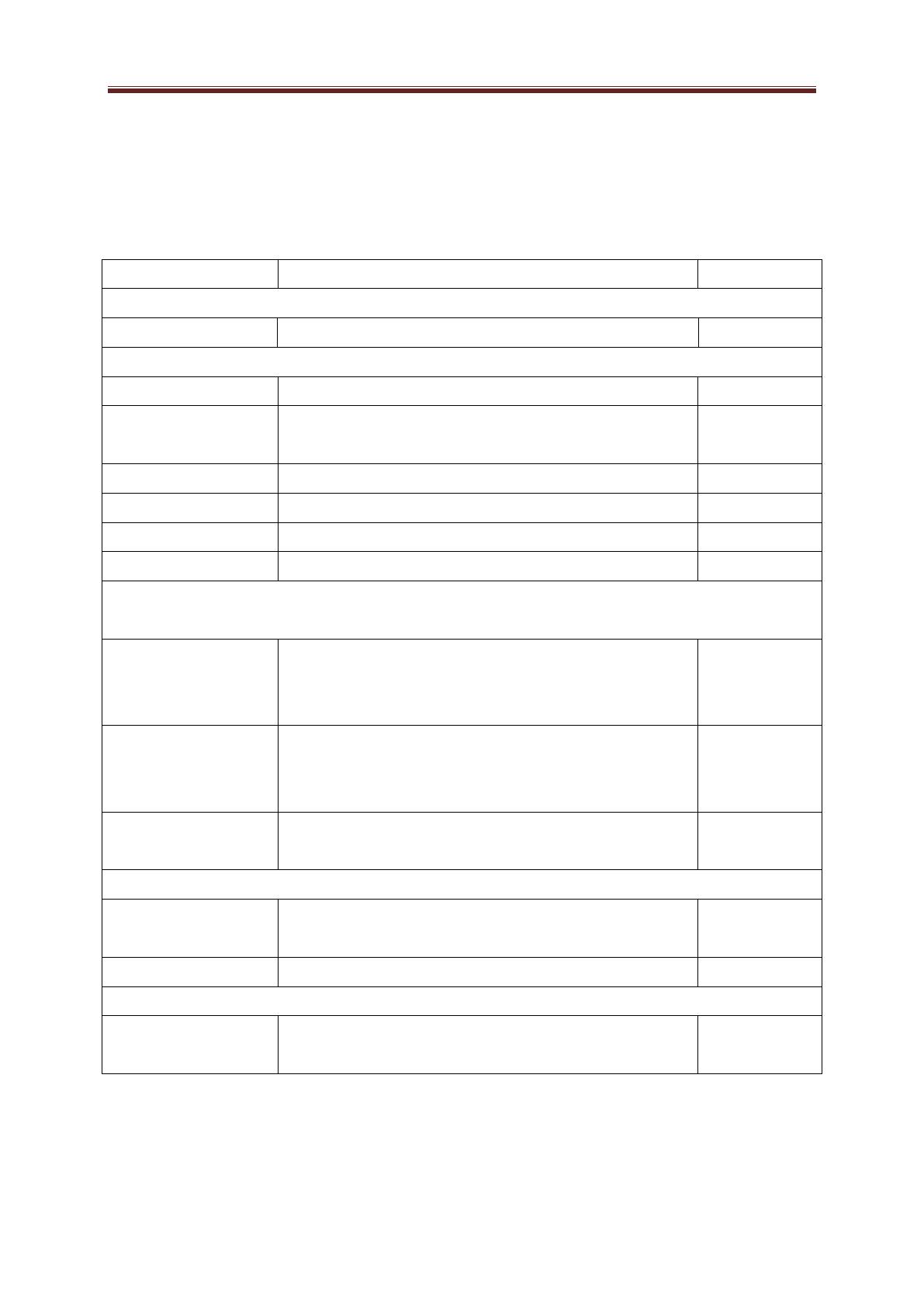
3-CONDUITE A TENIR EN CAS DE PROBLEMES
Quelque soit la situation aussi dramatique quelle se présente au laboratoire, il faut toujours
garder son sang froid, rester calme, ne pas paniquer, agir avec rapidité et surtout effectuer le
bon geste qui sera ci-dessous donné
Danger Règle de sécurité Gestes de première urgence
Produit avalé -interdit de pipeter à la
bouche
-utiliser les propipettes et
les tétines
-Rincer la bouche
-Ne pas faire boire
-Ne pas faire vomir
Projection dans l’œil -Utiliser les lunettes de
protection
-Rincer l’œil maintenu ouvert sous un filet
d’eau froide ou tiède, tête penchée, œil
contaminé en dessous de l’œil sain.
Brûlure thermique -Ni cheveux, ni
vêtements flottants
-Pas de vêtement
synthétiques-Porter une
blouse en coton
-Rincer immédiatement sous un filet d’eau
froide, 15 minutes.
-Garder les vêtements collés à la peau
Brûlure chimique -Porter une blouse
-Utiliser les petites
quantités
-Utiliser les
concentrations minimales
nécessaires
-Etiqueter les contenants
-Utiliser les gants si
nécessaire
- Rincer immédiatement sous un filet d’eau
froide,
-Enlever les vêtements contaminés sans
toucher le visage
Coupure -Utiliser des torchons et
lubrifier, pour enfiler un
tube dans un bouchon
-jeter la verrerie fendue
-Comprimer localement pour arrêter
l’hémorragie
-Faire assoir et rassurer
Incendie -Paillasse rangée
-Savoir utiliser
l’extincteur, la serpillère
mouillée et la couverture
antifeu
- feu est sur la paillasse : utiliser l’extincteur
à CO2 et attaquer les flammes par la base
-Sur une personne : utiliser la couverture
antifeu et/ou l’extincteur
Inhalation d’un gaz
irritant ou toxique
-Travailler sous une hotte
-Produire les quantités
minimales de gaz
-Faire sortir et respirer de l’air frais
Projection sur le corps -Utiliser la blouse en
coton
-Ne pas introduire de la
pierre ponce dans un
liquide chaud.
- Utiliser immédiatement la douche de
sécurité pour se laver abondamment à
l’eau et ôter aussitôt ses vêtements.
Renversement des
produits
-Paillasse rangée
-Savoir utiliser du papier
absorbant
-sol ou paillasse contaminés par un produit
peu toxique, peu volatile : nettoyer en
utilisant du papier absorbant. S’il s’agit d’un
acide ou d’une base, neutraliser avant de
nettoyer.
-si la substance est volatile, inflammable ou
toxique et la quantité importante, il faut
couper le courant électrique et quitter le
laboratoire

Le SOLEIL
5
4-LES PICTOGRAMMES ET LEURS SIGNIFICATIONS.
A la du document, nous vous proposerons les nouveaux pictogrammes entrés en vigueur en
Europe depuis 2010 et qui seront systématiquement utilisés à partir de 2015.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
1
/
195
100%











