UNIVERSITE DES SCIENCE TECHNOLOGIQUE HOUWARI BOUMEDIENE
Méthode physico-chimique
Tp3 :Electrophorèse SDS-page
Realisé par:
BOUREMANA meriem
SALAH MANSOUR Houda
Group: G1
Année universitaire : 2019 / 2020

Plan :
I. Introduction
II. But
III. Principe
IV. Matériel
V. Méthode
VI. Résultat
VII. Interprétation
VIII. Conclusion

I. Introduction :
Les protéines on été définies comme étant des macromolécules
biologiques présentes dans toutes les cellules vivantes, elles sont formées
d’une ou plusieurs chaines polypeptidiques. Chacune de ces chaines est
constituée de l’enchainement de résidus d’acides aminés liés entre eux par
des liaisons peptidiques.
Elles sont sous forme de réserve dans les graines (les protéagineux) comme
la fève et les petits pois.
II. But :
Séparation de protéines des feuilles et des graines pour déterminer le poids
moléculaire.
III. Principe :
Séparation des macromolécules chargées a travers un gel sous l’effet d’un
champ électrique.
IV. Matériel :
Mortier
Graines et feuilles de blé
Tampon (tris-HCl, glycérol, béta-mercaptoéthanol)
Centrifugeuse
Electrophorèse
Bleu de bromophénol
Tube à essai
V. Méthode :
Extraction :
Dans deux mortier on fait l’extraction des graines et feuilles de
séparément a sec puis on continue de broyer avec un tampon (tris-HCl,
glycérol) car les protéines sont solubles dans un milieu basique et on ajoute
le béta mercaptoéthanol pour détruire les Pons disulfures et on centrifuge
pendant 5 min (15000 tr/min). Le surnageons est récupéré et les protéines
sont dosées selon la méthode de Bradford a 595 nm en utilisant une
gamme étalon de BSA.

Préparation des 2 gels :
Gel de migration 15% il permet la séparation des molécules :
- acrylamide + Bis acrylamide
- Tris-HCl 1,5 M pH 8,8
- eau distillée
Au dernier moment ajouter
-PSA : un indicateur de polymérisation
-Du TEMED N, N, N’, N’- tétraméthylénediamin : accélérateur de
polymérisation (il est en solution)
D’abord, on met un peigne dans l’electrohorèse pour tracer la limite du gel
de migration puis verser une gélose pour éviter les fuites du gel et verser le
gel de migration immédiatement avant qu’il se gélifier. Entre temps on
prépare le gel de concentration 5% :
-acrylamide + Bis acrylamide
-Tris-HCl 0,5 M pH 6,8
-Eau distillée
-TEMED
-PSA (persulfate d’ammonium) a 10%
Apres la polymérisation du gel de migration verser le gel de concentration
sur le premier et placer le peigne profondément laissé polymériser 15 a 20
min.
Dosage :
1 ml de l’extrait de feuilles + 3 ml de Bradford dans 2 tubes.
20 µl de l’extrait de graines + 3 ml de Bradford + dilution 1/5 80 µl de l’eau
dans deux tubes. Après agiter les dans un agitateur.
Enlever le peigne, retourner l’appareil puis a l’aide d’une seringue déposer
les échantillons après avoir calculé la quantité a déposer.
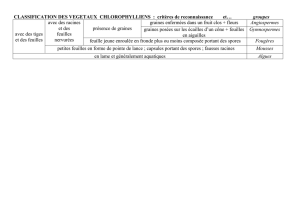
VI. Résultat :
1
2
Moyenne
concentration
Feuilles
0,71
0,84
0,77
1,52
Graines
0,51
0,69
0,6
6

DO = 0,506 [C]
[C] = 0,77
0,506 = 1,52 mg / ml
[C] = 0,6
0,506 = 1,18 * 5 = 6
-Graine :
6 mg →1 ml
6 µg → 1µl
50 µg → 8 µl d’extrait
80 µg → 13 µl
35 µg →5 µl
Vol
extrait
eau
Dénaturant
Graine 35
µg
5
10
15 µl
*4
Graine 50
µg
8
7
15 µl
*4
Graine 80
µg
13
2
15 µl
*4
-Feuille :
1,5 mg → 1 ml
1,5 µg → 1 µl
50 µg→ 33 µl
30 µg→ 20 µl
20 µg→ 13 µl
Feuille 30
µg
20
/
10
*4
Feuille 23
µg
15
/
15
*4
 6
6
 7
7
1
/
7
100%