Exercices Estérification et Hydrolyse : Chimie Organique
Telechargé par
abderrazzaq kraidy

Exercices d’application sur les réactions d’estérification et hydrolyse
Exercice 1
Compléter le tableau suivant
Formule semi développée
Formule
brute
Nom du
groupe
caractéristique
Nom de molécule
Alcool
Propane-1-ol
Acide -2-méthyle butanouique
2-méthyle propanoate de
butyle
Butanoate 2-méthyle propyle
3-éthyle 2-méthyle pentane2-ol

Exercice2
On mélange dans un ballon 0,1 mol d’alcool isoamylique, 0,1 mol d'acide éthanoïque et quelques
gouttes d’acide sulfurique concentré, puis on chauffe à reflux le mélange réactionnel pendant une
demi-heure. Une réaction d’estérification se produit. A l’équilibre, il se forme 0,067 mol d’éthanoate
d’isoamyle et de l’eau.
1- Quel est le rôle de l’acide sulfurique ajouté ?
2- Choisir, parmi les montages expérimentaux (a), (b) et (c), le montage du chauffage à reflux.
3- Citer deux caractéristiques de la réaction d’estérification.
4- Ecrire en utilisant les formules semi-développées, l’équation de la réaction d’estérification étudiée.
5- Calculer la constante d’équilibre K associée à l’équation de cette réaction.
Données :
- Formule chimique de l’acide éthanoïque: CH3 - CO 2 H .
- Formule semi-développée de l’alcool isoamylique: CH3 CH CH2 CH2 OH.
CH3
Exercice3
On mélange dans un ballon, la quantité n0 =1,5mol de l’acide propanoïque C2H5COOH avec la même
quantité n0 =1,5mol d’éthanol C2H5OH pur, puis on chauffe à reflux le mélange réactionnel
pendant une heure. On obtient à la fin de la réaction la quantité ne =1mol d’un ester E et de l’eau.
1- Ecrire l’équation chimique de cette estérification en utilisant les formules chimiques des
réactifs et des produits.
2- Nommer l’ester E.
3- Citer deux caractéristiques de cette réaction chimique.
4- Calculer le rendement r de cette transformation.
Exercice4
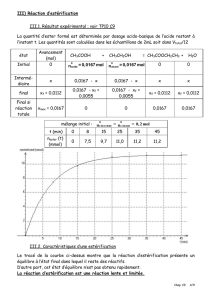
La synthèse de l'éthanoate de butyle (E), dont la
formule semi-développée est représentée ci-contre,
peut être réalisée à partir d'un acide carboxylique (A)
et d'un alcool (B).
L’équation chimique associée à la réaction modélisant la synthèse de (E) s'écrit :
(A) + (B) ↔ (E) + H2 O
1. Identifier, dans la formule du composé (E) , le groupe caractéristique.
2. Déduire, à partir de la formule semi développée de (E) les formules semi développées des

composés (A) et (B) .
3. Pour synthétiser au laboratoire l'éthanoate de butyle(E) à partir des composés (A) et (B) , on
introduit dans un bécher, placé dans un bain d'eau glacée, n A = 0,10 mol d'acide carboxylique (A)
n B = 0,10 mol d'alcool (B) et quelques gouttes d'acide sulfurique concentré.
On place le bécher dans un bain à 80 C et on déclenche
alors le chronomètre à l'instant t 0 0 . La courbe ci-
contre donne l'évolution temporelle de l'avancement x
de la réaction de synthèse de l'ester (E).
3.1. Quel rôle joue l'acide sulfurique dans le milieu
réactionnel?
3.2. Déterminer graphiquement, la valeur de
l'avancement final xf
3.3. Déterminer la valeur de la constante d'équilibre K
associée à l'équation chimique de la réaction
d'estérification.
3.4. Déterminer le rendement de cette synthèse
3.5. Définir le temps de demi-réaction t1/ 2 . Trouver sa valeur à partir du graphe.
3.6. Calculer en (mol.L1 .min 1 ) , la vitesse volumique de cette synthèse à l'instant t = 20 min ,
sachant que le volume du mélange est V 15 mL .
4. À partir des mêmes réactifs (acide carboxylique(A) et alcool (B) ), indiquer une méthode
permettant d'augmenter le taux d'avancement final.
Exercice5
On réalise expérimentalement l'estérification de l’acide éthanoïque C2H4O2 avec l’éthanol C2H6O .
1. Écrire, en utilisant les formules semi-développées, l’équation chimique de cette estérification.
Nommer l’ester formé.
2. Le mélange initial est constitué de n0 =1 mol d'acide et n0 =1 mol d'alcool et quelques gouttes
d'acide sulfurique concentré à température constante. Une fois l’équilibre chimique atteint, la
quantité de matière d'ester formé est néq (ester) = 0,67 mol .
2.1. Déterminer le rendement de cette synthèse.
2.2. Calculer la valeur de la constante d’équilibre K associée à l’équation chimique de cette
estérification.
2.3. À l’état d’équilibre précédant, on ajoute au système chimique 1 mol d’acide éthanoïque. On
obtient un nouvel état du système chimique
2.3.1. Donner la composition initiale du nouvel état du système chimique obtenue
2.3.2. Calculer la valeur du quotient de réaction Q r,ià cet état initial.
2.3.3. Déterminer le sens d’évolution de cette réaction. Justifier.
2.3.4. Proposer une autre méthode permettant de déplacer l’état d’équilibre du système dans le sens
direct.
1
/
3
100%