I1= 5 A
I1= 1,5 A
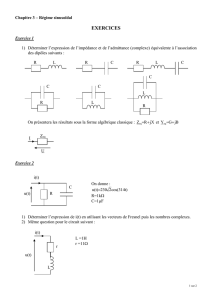
Exercices d’application
Exercice 1 : Convertir :
150 mA = …………………. A 1,2 mA = ………………………….. A
0,03 A = ……………… m A 30 A = ……………………… m A
4,5 mA = …………………. A 25 mA = ………………………….. A
Exercice 2 : Pour mesurer l’intensité I d’un courant dans un circuit, on utilise un
ampèremètre analogique réglé sur le calibre 50 mA. Schant que l’appareil comprend 100
divisions et que l’aiguille se stabilise devant la division 44. Calculez l’intensité du courant
en mA.
Exercice 3 :
L’ampèremètre A indique 2,1 A.
L’ampèremètre A1 indique 0,7 A
Calculer la valeur indiquée par
l’ampèremètre A2.
Exercice 4 : Une lampe porte les indications suivantes : 12 V- 1,5 A. Ce sont les valeurs
nominales qui ne doivent pas être dépassées, on choisit donc d’insérer dans le circuit un
fusible.
1° - Quel est le rôle d’un fusible.
2° - Parmi les différents fusibles : 1 A, 2 A, 4 A, 6 A, choisir celui qui convient le mieux.
3° - Schématiser le circuit électrique permettant le fonctionnnement de la lampe.
Exercice 5 : L’additivité des intensités est telle que : I = I1 + I2
Recopier et compléter le tableau suivant :
I
I1
I2
25 mA
5 mA
80 mA
0,036 A
2,37 A
0,95 A
6,05 A
3,6 A
Exercice 6 : Calculez les intensités manquantes dans les schémas ci-dessous :
I3= 5 A
I1= 2 A

Le: 17.09.07 SCIENCES : Contrôle N° 1 Classe:
2CO2
Nom : ...........................................
Exercice 1 : Convertir :
267 mA = …………………. A 35,7 mA = ………………………….. A
0,278 A = ……………… m A 2 A = ……………………… m A
5,68 mA = …………………. A 123,2 mA = ………………………….. A
Exercice 2 : Compléter le texte suivant :
L’intensité, notée ............, du courant électrique se mesure à l’aide d’un
................................................ branché en ......................... dans le circuit. L’unité de mesure de
l’intensité est ....................................
Exercice 3 :
L'ampèremètre A1 indique 0,080 A. Quelle indication porte alors
l'ampèremètre A2 ? Pourquoi, rappeler la loi ?
Exercice 4 :
L'ampèremètre A1 indique 0,325 A .
L'ampèremètre A3 indique 850 mA .
1. Indiquer le sens conventionnel du courant électrique.
2. Transformer les mA en A pour I3.
3. Quelle indication porte l'ampèremètre A2?
I2= ?
I2= ?

Exercice 5 : Déterminer la valeur et le sens du courant I1.
EXERCICE 1

Cochez les cases correspondant aux affirmations suivantes :
VRAI
FAUX
Les électrons vont de la borne – du générateur vers la borne +.
Le sens conventionnel du courant est aussi de la borne – du générateur vers la borne +.
La valeur de l’intensité est positive lorsque le courant circule dans le sens conventionnel.
La somme des courants arrivant à un nœud est égale à la somme des courants qui en partent.
Une pile est un récepteur.
Une batterie de voiture est un générateur.
Un aspirateur est un récepteur.
C’est le déplacement des électrons qui crée le courant électrique.
Les électrons circulent en dehors des fils électriques.
Plus il y a d’électrons, plus l’intensité du courant est grande.
C’est le compteur électrique qui mesure le courant.
2 Ampères, c’est 2 Coulomb qui circule en 1 seconde.
La lettre qui symbolise le courant est Q.
L’unité du courant est le Coulomb.
L’unité de la quantité d’électricité est le Coulomb.
EXERCICE 2
Complétez les phrases suivantes :
1 - La puissance est symbolisée par la lettre . Elle s’exprime en .
2 - L’énergie, symbolisée par la lettre a comme unité légale le
. Mais en électricité, on emploie souvent comme autre unité pour l’énergie le
.
3 – La résistance s’exprime en . Cette unité est symbolisée par la lettre
.
4 – La loi d’ohm est : .
5 – La tension est symbolisée par la lettre et s’exprime en .
6 – L’intensité d’un courant s’exprime en .
7 – La loi des nœuds dit que « la somme des qui entrent dans un nœud
est égale à la somme des qui en sortent ».
EXERCICE 3
1 - Calculer la tension aux bornes d’un conducteur de 0,9 lorsqu’il est traversé par un courant
d’intensité 5 A :
2 – Calculer la puissance perdue dans ce résistor :

EXERCICE 4
Un radiateur de 2,5 kW / 230 V est alimenté sous sa tension nominale.
1 - Calculer l’intensité du courant qui le traverse :
2 – Calculer la résistance de l’élément chauffant :
EXERCICE 5
Soit le montage suivant :
1 – Calculez la résistance équivalente totale du montage :
100
100
150
200
300
300
150
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%