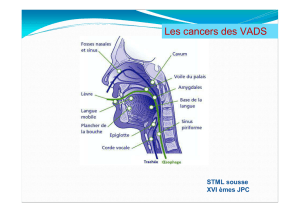
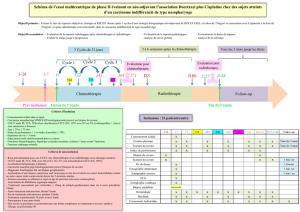
Cancer du Cavum: Étude Génétique et Épidémiologique - Master
Telechargé par
Khelifa Hamza

RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE
MINISTÈRE DE L’ENSEIGNEMENT SUPÉRIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
Université des Frères Mentouri Constantine
Faculté des Sciences de la Nature et de la Vie
Département de Biologie Animale
Mémoire présenté en vue de l’obtention du Diplôme de Master
Domaine : Sciences de la Nature et de la Vie
Filière : Sciences Biologiques
Spécialité : Génétique Moléculaire
Intitulé :
Jury d’évaluation :
Présidente du jury : SATTA D. Professeur, U. des Frères Mentouri Constantine
Rapporteur : DJEKKOUNE R. Maître de Conférences A, Université Constantine 3
Examinatrices : SEMMAME O. Maître assistante U. des Frères Mentouri Constantine
MEZIANE A. Maître assistante, Université Constantine 3
Année universitaire
2014 - 2015
Etude génétique et épidémiologique
du cancer du cavum
Présenté et soutenu par : BOUZNAD ROMAISSA Le : 01/07/2015
BENAMIRA NARIMENE

RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE
MINISTÈRE DE L’ENSEIGNEMENT SUPÉRIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
Université des Frères Mentouri Constantine
Faculté des Sciences de la Nature et de la Vie
Département de Biologie Animale
Mémoire présenté en vue de l’obtention du Diplôme de Master
Domaine : Sciences de la Nature et de la Vie
Filière : Sciences Biologiques
Spécialité : Génétique Moléculaire
Intitulé :
Jury d’évaluation :
Présidente du jury : SATTA D. Professeur, U. des Frères Mentouri Constantine
Rapporteur : DJEKKOUNE R. Maître de Conférences A, Université Constantine 3
Examinatrices : SEMMAME O. Maître assistante U. des Frères Mentouri Constantine
MEZIANE A. Maître assistante, Université Constantine 3
Année universitaire
2014 - 2015
Etude génétique et épidémiologique
du cancer du cavum
Présenté et soutenu par : BOUZNAD ROMAISSA Le : 01/07/2015
BENAMIRA NARIMENE


Avant tout nous devons nos remerciements à notre DIEU le tout puissant de nous avoir
donné la force, le courage et la patience pour terminer ce travail.

Remerciements
Nous tenons à exprimer notre reconnaissance à Mr DJEKKOUN R. professeur en
oncologie au CHUC qui a permis de réaliser ce travail sous sa direction. Nous le
remercions pour l’aide qu’il nous a apporté et le temps précieux qu’il nous a accordé
tout au long du travail.
A Mme TOUATI SABRINA pour ses conseils, son aide et surtout pour sa gentillesse.
Nous remercions Mr le Pr ABADI N., pour nous avoir accueillies dans le laboratoire
de Génétique et Biologie moléculaire.
Nous remercions également Pr BENLETRECHE pour nous avoir permises de
manipuler au laboratoire de Biochimie.
Nous voudrions adresser un grand et spécial remerciement à Mme SATTA D.,
responsable de la filière « Génétique moléculaire » pour sa disponibilité
, ces
orientations,
son écoute et son immense gentillesse durant ce travail et tout au long de
notre cursus.
Nos remerciements s’adressent également à Mme SEMMAM O., et Mme MEZIANE A.,
pour l’honneur qu’elles nous font d’accepter d’évaluer notre travail
Nos sincères remerciements vont également :
A Tous nos professeurs de l’option Génétique Moléculaire qui ont contribué à notre
formation. Veuillez trouver ici l’expression de notre profonde gratitude.
A Tout le personnel du laboratoire de biologie moléculaire CHUC.
A tout le personnel du service d’oncologie-radiothérapie CHUC.
Enfin nous tenons à remercier tous ceux qui ont contribués de près ou de loin à
l’aboutissement de ce travail.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
1
/
74
100%