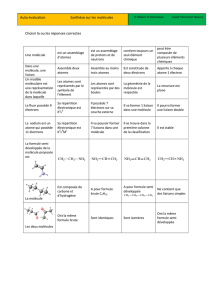
CHAPITRE I : STEREOCHIMIE
Définitions
La constitution d'une entité moléculaire précise la nature et les modes d'union des atomes
formant cette entité, en incluant la multiplicité des liaisons sans tenir compte de leur disposition
dans l'espace.
La configuration d'une entité moléculaire est la disposition spatiale des atomes ou des groupes
d'atomes de cette entité. Ce terme est propre aux stéréo-isomères dont l'isomérie n'est pas due à des
différences de conformations.
Les stéréoisomères de configuration peuvent être classés en fonction de critères de symétrie.
On distingue alors :
- les énantiomères ;
- les diastéréo-isomères.
Un atome ou un groupe d'atomes qui, dans une entité moléculaire, peut être considéré comme
à l'origine d'une stéréo-isomérie est appelé groupe stéréogène. Deux exemples de groupes
stéréogènes sont particulièrement importants :
- un atome asymétrique, centre chiral, avec les groupes qui lui sont liés ;
- un groupe d'atomes constitué d'une double liaison avec ses substituants qui peut donner
naissance à une isomérie cis-trans.
La Conformation d’une entité moléculaire est l’arrangement structural d’une molécule de
configuration donnée, obtenu par rotation autour des différentes liaisons ou par inversion d’un
atome. Ces stéréo-isomères présentent entre eux des relations de diastéréo-isomérie ou
d’énantiomérie.
I. Représentations graphiques des molécules organiques
I.1. Représentation en perspective et représentation de Cram
I.1.1. Molécules à un carbone tétraédrique
La représentation de Cram (1953) utilise les conventions représentées par la figure 1 pour le
dessin des liaisons.
a
C
bcd
liaison dans le plan
liaison devant le plan
liaison derrière le plan
Le dessin de la figure 2 représente l'un des stéréoisomères du 2, 3-diméthylbutane en utilisant
la représentation perspective (A) et la représentation de Cram (B).

HCH3
H3C
H
H3C
CH3
H3CCH3
CH3
CH3
AB
1
2
3
4
1234
Exemple : une molécule de 5-méthyl-2-isopropylcyclohexanol est représentée sur le dessin (I) sans
référence à la stéréochimie des groupes liés au cycle cyclohexanique. Le menthol est l'un des huit
stéréoisomères possibles correspondant à cette formule. Ce composé est représenté en utilisant les
conventions de Cram (II) et en perspective (III).
CH3
OH
H3C CH3
CH3
OH
H3C CH3
CH3
HO
(H3C)2HC
1
2
3
4
56
1
2
3
4
56
1
234
5
6
III III
I.1.2. Molécules à deux carbones tétraédriques
Dans une molécule possédant des carbones sp3, on peut mettre en évidence un phénomène de
libre rotation autour d’une liaison carbone-carbone. On appelle conformation (ou conformère) d’une
molécule une des structures spatiales (en nombre infini) que peut prendre cette molécule par libre
rotation.
Prenons l’exemple de l’éthane CH3-CH3. La représentation en projective montre deux
conformations extrêmes parmi une infinité de conformations : la conformation éclipsée (A) et la
conformation décalée (B).
H H H
H
H H
H
H
H
H
HH
Conformère éclipsé (A) Conformère décalé (B)
Dans la conformation éclipsée, tous les hydrogènes sont vis-à-vis deux à deux. L’angle dièdre
est ω = 0°. Dans la conformation décalée, les hydrogènes ne sont plus en vis-à-vis. L’angle dièdre
est ω = 60°.
Toutes les conformations n’ont pas la même énergie. La conformation éclipsée est de plus
haute énergie (donc moins stable). Par contre, la conformation décalée est de plus basse énergie
(donc plus stable). La différence énergétique est de l’ordre de 12,5 kJ/mole. On l’appelle barrière

de rotation. Cette valeur étant faible, à température ordinaire, on ne peut isoler ces différentes
conformations.
H
H H
H
HH
H
HH
H
H
H
La différence de stabilité des conformations éclipsées et décalées est due à des phénomènes
assez complexes (interactions électrostatiques, rayon atomique de Van der waals…).
I.1.3. Molécules à plusieurs carbones tétraédriques
Dans le cas de molécules à plusieurs carbones tétraédriques, on observe une conformation en
zig-zag.
I.1. Représentation de Newman
La molécule est dessinée en projection selon une liaison C−C perpendiculaire au plan du
papier. L'exemple suivant est celui de la molécule de butane en projection selon C2−C3.
H3C CH3CH3
H3C
H H
H
H
H
H
HH
Conformère éclipsé ( = )
CH3
H H
CH3
HH
CH3
HH
H
CH3
H
Conformère décalé anti ( = )

Il existe deux autres conformations décalées (ω = 60°) appelées gauches.
H
H CH3
CH3
HH H
H3C H
CH3
HH
Dans les cas de l’éthane-1,2-diol (I), du 2-chloro-éthan-1-ol (II) et du 2-amino-éthan-1-ol
(III), la conformation décalée la plus stable est conformation gauche car elle est stabilisée par
liaison hydrogène intramoléculaire.
H
H O
O
HH
H
H
+
−
IH
H Cl
O
HH
H+
−
II
H
H NH2
O
HH
H+
−
III
La molécule d'éthanal (IV) et celle d’un alcène (V) sont représentées selon la même méthode.
HH
H
HO
1
2
H
H
HOH ca
b d
c d
ba
V
IV
La projection de Newman est intéressante dans le cas de molécules cycliques comme le
cyclohexane car elle permet de mettre clairement en évidence les différents angles dièdres.
La projection de Newman peut également être mise à profit dans le cas de structures plus
complexes comme les allènes, ou les spirannes.
I.3. Représentation de Fisher ou Projection de Fischer
Ce mode de représentation est très utilisé dans la chimie des sucres. Les conventions sont les
suivantes :

- la chaîne carbonée est dessinée verticalement ;
- l'atome de carbone qui porte le numéro le plus petit (porteur de la fonction aldéhyde dans le cas
d'un sucre) est placé en haut ;
- les groupes sur l'horizontale pointent vers l'avant de la feuille de papier.
T
X
Y
Z
X
TZY X
TZY
Cram Fisher
Les oses les plus simples sont le (2R)-2,3-dihydroxypropanal (I) et son énantiomère le (2S)-
2,3-dihydroxypropanal (II). Ils sont représentés ci-dessous en utilisant la représentation de Cram et
la projection de Fischer. Ces sucres sont encore appelés glycéraldéhydes.
CH2OH
CHO
H
HO
Cram
CHO
CH2OH
OHH
Fisher
1
2
3CH2OH
CHO
HO
H
Cram
CHO
CH2OH
HHO
Fisher
333
22
2
111
b e
d
a
cf
abc ef d
Par convention, la chaine carbonée la plus longue est verticale avec
la fonction la plus oxydée toujours en haut (numéro 1 dans la
nomenclature)
La nomenclature D, L de Fischer peut être reliée à ce système de projection.
I.3. Représentation de Haworth
Ce mode de représentation est fréquemment utilisé dans la chimie des sucres et de leurs
dérivés. Il est beaucoup plus commode que la représentation de Fischer dans le cas des structures
cycliques. Les exemples ci-dessous, qui concernent les hémiacétals cycliques du glucose, montrent
la filiation entre cette représentation et celle utilisant un cycle cyclohexanique en perspective qu'on
utilise de plus en plus fréquemment à l'heure actuelle. On a représenté successivement :
- les α-glucopyranoses (A) et (A') ;
- les β-glucopyranoses (B) et (B').
OO
OH OH
HO
HO HO
HO HO
HO OH OH
O
OH OH
OH
OH
OH
O
OH OH
OH
OH
O
H
AA' BB'
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%