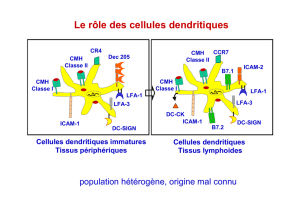
Étude des réservoirs VIH en primo-infection et impact du traitement précoce
Telechargé par
résident en immunologie

HAL Id: tel-01059807
https://tel.archives-ouvertes.fr/tel-01059807
Submitted on 2 Sep 2014
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entic research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diusion de documents
scientiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
Etude de l’établissement des réservoirs VIH lors de la
primo-infection et de l’impact des traitements
antirétroviraux très précoces sur ces réservoirs
Antoine Chéret
To cite this version:
Antoine Chéret. Etude de l’établissement des réservoirs VIH lors de la primo-infection et de l’impact
des traitements antirétroviraux très précoces sur ces réservoirs. Virologie. Université René Descartes
- Paris V, 2014. Français. �NNT : 2014PA05T013�. �tel-01059807�

0
Université Paris Descartes
Ecole doctorale 157
Génétique-cellule-Immunologie-Infectiologie-Développement-« Gc2iD »
Euipe d’aueil 77
Etude de l’étalisseet des réservoirs VIH lors de la
primo-ifetio et de l’ipat des taiteets
antirétroviraux très précoces sur ces réservoirs
Par Monsieur Antoine CHERET
Thèse de doctorat d’Infectiologie
Dirigée par Madame le Professeur Christine ROUZIOUX
Présentée et soutenue publiquement le 24 avril 2014
Devant un jury composé de :
Président du jury : Monsieur Olivier LORTHOLARY Professeur des Universités
Rapporteur : Monsieur Philippe MORLAT Professeur des Universités
Rapporteur : Madame Constance DELAUGERRE Maître de conférences des
Universités
Examinateur : Monsieur Gianfranco PANCINO Directeur de Recherches

1
Résumé :
La primo-infection est un moment critique de l’établissement du réservoir justifiant de l’initiation d’un
traitement précoce.
Nous avons initié un essai randomisé évaluant l’impact de deux ans d’un traitement antirétroviral intense
(essai ANRS147 OPTIPRIM, trithérapie versus pentathérapie) sur le réservoir et avons initié des études
physiopathologiques au cours de cet essai.
Nous montrons ainsi la faible diversité génétique des virus en primo-infection dans les compartiments
sanguins et rectaux. Le réservoir s’établit dès le premier mois de l’infection par diffusion d’un cluster
viral homogène au sein des lymphocytaires T CD4 naïfs (TN) et mémoires centrales (TCM),
transitionnelles (TTM), effectrices (TEM) quiescents. Il en résulte une perturbation de l’homéostasie
lymphocytaire associée à une faible contribution au réservoir des cellules peu différenciées à longue
demi-vie, TN et TCM. Par ailleurs nous montrons que la majorité des patients au moment de leur primo-
infection n’ont pas la capacité de développer des réponses T CD8 à même de supprimer la réplication
virale comme chez les patients HIV Controllers. Après deux ans de traitement, nous observons que la
diversité virale n’a pas évolué, par contre la taille du réservoir est fortement réduite. Les anomalies de
l’homéostasie lymphocytaire T CD4 persistent, par contre le traitement très précoce a permis de protéger
les TN et TCM. Il n’y a pas de bénéfice additionnel d’une pentathérapie mais nous avons validé le
concept qu’un traitement précoce permet d’induire un contrôle virologique au long cours après arrêt de
traitement. Nos résultats indiquent qu’un traitement plus long que deux ans permettrait de renforcer la
diminution du réservoir.
Ces résultats seront à prendre en compte pour l’élaboration de futurs essais en primo-infection visant à
réduire le réservoir pour une rémission au long cours.
Title : Study of the establishment of the HIV-1 reservoirs at the time of the primary
infection and impact of a Highly Active Anti-retroviral Therapy on these reservoirs
Abstract :
HIV primary infection is a critical period in the establishment of the reservoirs that justifies the
initiation of an early treatment.
We started a randomised trial to assess the impact of a two-year intense HAART (ANRS147 OPTIPRIM
trial: five-drug therapy versus. three-drug therapy) on the blood reservoir; within this this trial, we
included some pathophysiological studies.
Thus, we show that during the primary infection, viruses have a low genetic diversity in blood and rectal
compartments. The reservoir establishes itself as early as the first month of the infection by spreading a
homogeneous viral cluster in CD4 T cells subsets, naive T cells (TN), central memories (TCM),
transitional memories (TTM), effector memories (TEM), and resting T cells. This results in a disruption
of the lymphocyte homeostasis, linked to the low contribution to the reservoir of TN and TCM, which
are little differentiated cells with long half-lives. Moreover, we show that, at the time of the primary
infection, the majority of patients do not have the ability to develop CD8 T cells responses that could
suppress the viral replication, as HIV Controllers patients do. After two years of treatment, we observe
that there is no evolution of the viral diversity, but the size of the reservoir is significantly reduced. The
abnormalities of the CD4 T cells lymphocyte homeostasis remain, but the very early treatment was able
to protect the TN and TCM. The five-drug therapy does not have any additional benefit, but we confirm
the idea that early treatment can induce long-term virological control after the discontinuation of the
treatment. Our results show that a treatment lasting more than two years would be able to reinforce the
reduction of the reservoir.
These results should be taken into account in the development of future trials aiming to reduce the
reservoir in patients treated at the time of primary infection for a sustainable remission.
Key words: HIV reservoir, primary infection, early treatment, viral diversity, T cells subsets infection
Mots clés : Réservoir VIH, Primo-infection, traitement précoce, diversité virologique, infection des
sous-populations lymphocytaires

2
REMERCIEMENTS
Mes remerciements s’adressent tout particulièrement à Madame le Professeur Christine
Rouzioux à qui je tiens à témoigner ma profonde reconnaissance et ma très grande estime,
pour son enseignement, ses conseils «savoir-faire et faire savoir», son enthousiasme, ses
encouragements «sans cesse sur le métier remettez votre ouvrage», sa patience et ses cours
d’anglais, sa constante bienveillance à mon égard, sa très grande disponibilité et son soutien
sans faille dans mes projets professionnels, pour la confiance qu’elle a bien voulu m’accorder
et pour m’avoir fait découvrir et partager sa passion de la recherche. Cette rencontre
professionnelle et humaine est un évènement précieux et déterminant dans ma vie.
Je tiens à exprimer ma très grande reconnaissance et mon amitié à Madame le Professeur
Laurence Meyer pour m’avoir toujours guidé avec prévenance et générosité dans les
méandres de la méthodologie des essais et des statistiques dès le début d’OPTIPRIM, son sens
du travail en équipe avec le souci du respect de chacun, son accueil toujours sympathique au
sein de son service et pour la richesse de nos échanges.
Ce travail a été possible grâce à la précieuse collaboration avec Madame le Professeur
Brigitte Autran que je remercie sincèrement pour ses conseils, son écoute, son soutien, sa
réactivité, pour les discussions enrichissantes et la qualité des échanges tant sur le plan
scientifique que sur le plan humain.
Cette collaboration m’a permis de découvrir ma co-autrice Madame Charline Bacchus qui
depuis s’est envolée outre Atlantique, avec sa bonne humeur, ses compétences en
Immunologie et dans le maniement des logiciels de traitement des données biologiques et des
nouvelles technologies qui ont été un atout indispensable à l’aboutissement de nos travaux ce
que j’ai su apprécier et j’espère la retrouver pour d’autres aventures.
Un grand merci à toute l’équipe du Laboratoire de Virologie et particulièrement à Madame
Adeline Mélard, pour leur accueil, leur sympathie, leur aide, leur disponibilité qui ont été un
atout clef pour mener ce travail à terme.
Je remercie très amicalement les membres de l’équipe d’accueil EA 7γβ7, Madame le
Docteur Véronique Avettand-Fenoël, Monsieur le Docteur Jade Ghosn, Monsieur le
Docteur Pierre Frange et Monsieur le Professeur Jean-Paul Viard, pour leur soutien
régulier, leurs critiques constructives qui m’ont permis d’avancer dans la réflexion et
l’élaboration de ce travail.
Aux rapporteurs de ce travail, Monsieur le Professeur Philippe Morlat et Madame le
Docteur Constance Delaugerre, j’exprime toute ma gratitude pour l’intérêt qu’ils ont bien
voulu porter à mon travail en me faisant l’honneur d’avoir accepté de le juger et les remercie
pour leurs conseils et leur bienveillance qui ont permis d’enrichir ce manuscrit.
Je remercie Monsieur le Professeur Olivier Lortholary de m’avoir fait l’honneur de
présider mon jury de thèse.

3
Je remercie Madame le Professeur Christine Katlama pour son soutien et le groupe AC5
Stratégie de l’ANRS qui ont permis au protocole OPTIPRIM de voir le jour.
Je remercie l’ANRS, Monsieur le Professeur Jean-François Delfraissy et Monsieur le
Professeur Jean-Michel Molina pour leurs contributions indispensables à la réalisation du
protocole OPTIPRIM.
Un grand merci à Madame Sandrine Couffin-Cardiergues et Madame Juliette Saillard
qui ont su m’accompagner au fil de mes aventures à l’ANRS avec enthousiasme et sympathie.
Je remercie également les Docteurs Marie-Laure Chaix et Marianne Leruez-Ville, pour
leurs conseils, leurs compétences et leur bonne humeur qui ont contribué à la réalisation de ce
travail.
Je tiens à remercier Monsieur le Professeur Patrick Berche qui m’a fait l’honneur de
m’accueillir dans son laboratoire pour mener à bien ce travail.
Je remercie le Centre Hospitalier de Tourcoing et Messieurs les Professeurs Eric Senneville
et Yazdan Yazdanpanah de m’avoir accordé la disponibilité nécessaire à l’accomplissement
de ce travail et pour leurs encouragements.
Je tiens à remercier toute l’équipe du protocole OPTIPRIM, le centre de Méthodologie et de
Gestion de Madame le Professeur Laurence Meyer, Monsieur le Docteur Georges
Nembot très sympathique chef de projet de l’essai pour son investissement dans l’essai
OPTIPRIM, Monsieur le Docteur Faroudi Boufassa, Monsieur Laurent Tran pour leur
aide et leur contribution à ce travail. Je remercie Monsieur le Professeur Daniel Olive,
Monsieur le Docteur Alain Venet, Madame Camille Lecuroux, pour le versant
immunologique de l’essai et leur soutien ces dernières années. Je remercie également mes
acolytes du commencement d’OPTIPRIM qui me sont chères, Mesdames les Docteurs
Caroline Lascoux et Christiane Deveau
Un grand merci à toute l’équipe de PRIMO, à Madame le Professeur Cécile Goujard pour
son écoute et ses conseils avisés, à Madame le Docteur Asma Essat pour sa disponibilité et
sa réactivité.
Merci à mes collègues du sud, Madame le Docteur Isabelle Ravaux, Madame le Docteur
Catherine Tamalet, Monsieur le Docteur Halphon Philippe, Monsieur le Docteur Alain
Lafeuillade pour leur soutien dans la réalisation du protocole OPTIPRIM.
Je remercie tous les patients qui ont accepté de participer à ce travail de recherche.
J’adresse tous mes remerciements à l’équipe d’AFORIH pour son soutien à la réalisation de
ce travail, Josiane et Marc Jacquard, Joëlle Duvernay, Monique Toussaint et Patrice
Quillet avec lesquels j’espère encore partager d’autres aventures.
Ce travail a pris une grande place dans mon champ de vie ces dernières années et il appartient
donc également à mes parents, mes proches et Christophe que je remercie pour leur soutien
inconditionnel et indispensable.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
1
/
202
100%